文章信息
- 张磊, 王海荣, 邵昱璋, 严敏, 付婷, 胡妮, 高洁.
- Zhang Lei, Wang Hairong, Shao Yuzhang, Yan Min, Fu Ting, Hu Ni, Gao Jie.
- HBsAg阳性产妇孕晚期IFN-γ和IL-12表达对HBV宫内传播的影响
- Effect of IFN-γ and IL-12 expressions on intrauterine transmission in HBsAg-positive parturientsin late pregnancy
- 中华流行病学杂志, 2019, 40(9): 1077-1083
- Chinese Journal of Epidemiology, 2019, 40(9): 1077-1083
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.09.011
-
文章历史
收稿日期: 2019-02-18
2. 西安交通大学医学院 710061
2. Medical College, Xi'an Jiaotong University, Xi'an 710061, China
目前,全球约2.57亿HBV携带者[1],其中HBV垂直传播无法完全阻断而成为研究热点,最新研究提出HBV宫内传播(BIT)不仅包括HBV显性感染(DBT),而且还存在HBV隐匿性感染(OBI)现象[2]。HBV感染时,活化Th1型免疫应答中促进IFN-γ、白细胞介素12 (IL-12)的分泌,在病毒清除过程中发挥关键的效应和调节作用[3],因此本研究通过监测HBsAg阳性产妇外周血IFN-γ和IL-12水平,以探讨母体IFN-γ、IL-12水平对HBV宫内传播结局的发生产生影响。
对象与方法1.研究对象:收集2015年1月至2017年5月陕西省西北妇女儿童医院住院产妇282例,其新生儿285例。纳入标准:①HBsAg阳性产妇;②所生新生儿在出生24 h内未接种乙型肝炎(乙肝)疫苗和卡介苗前采集静脉血;③新生儿身体状况符合抽血条件;④知情同意。
2.研究方法:采用病例对照研究方法,比较病例组HBsAg阳性与对照组HBsAg阴性产妇外周血IFN-γ和IL-12水平的差异。HBsAg阳性产妇采取干预措施包括:抗病毒治疗、接种乙肝疫苗和注射免疫球蛋白(HBIG)情况。
(1) 分组:采用两组水平均数比较的样本量估计方法,根据IFN-γ检测预实验数据设定相关参数:病例组(27.63±30.00)pg/ml,对照组(11.11±20.53)pg/ml。等比例分组,采用PASS 16.0软件计算病例组与对照组样本量各为40例。同期随机选择43例正常产妇为对照组,纳入标准:①产妇血清HBsAg及HBV DNA均为阴性;②年龄匹配;③居住地匹配;④新生儿身体状况符合抽血条件。排除标准:①罹患其他感染性疾病;②未签署知情同意书。
(2) 问卷调查:产妇的一般情况、家族史、本次妊娠史以及生产情况和新生儿情况等。
(3) 标本采集:采集临产前HBsAg阳性产妇及其新生儿(出生24 h内)静脉血,并采集43例对照组产妇外周血。均1 500 r/min、6 min分离血清,-20 ℃保存备用。
(4) 血清HBV标志物检测:产妇及新生儿HBsAg、抗-HBs、HBeAg、抗-HBe和抗-HBc(乙肝五项)均采用ELISA法检测,操作和结果判定按试剂盒说明书(北京万泰生物药业股份有限公司)进行。HBV DNA载量采用PCR-荧光探针法检测,操作和结果判定按照试剂盒说明书(湖南圣湘生物科技有限公司)进行。
(5) 产妇外周血IFN-γ和IL-12检测:采用流式液相芯片法检测,7-PLEX HUMAN CYTOKINE PANEL 96 well plate Assay (SPR1036)试剂盒(美国MILLIPLEX公司)。各种检测均严格按照试剂盒说明书进行操作和判读结果,采用流式检测仪Luminex®200TM(美国伯乐公司)检测。
(6) 新生儿HBV感染结果判定:① BIT:DBI与OBI的统称[2],即HBsAg阳性产妇所生新生儿24 h静脉血中HBsAg阳性或HBV DNA载量≥200拷贝/ml;②DBI:HBsAg阳性产妇所生新生儿24 h静脉血中HBsAg阳性者;③OBI:HBsAg阳性产妇所生新生儿24 h静脉血中HBsAg阴性,但HBV DNA载量≥200拷贝/ml,或者新生儿在全程接种HBIG和3针乙肝疫苗后外周静脉血中HBsAg阴性,但HBV DNA载量≥200拷贝/ml;④HBV宫内未传播(NBIT):新生儿外周血检测HBsAg和HBV DNA均为阴性。
(7) 相关定义:①孕早期出血:孕1~13周,出现的阴道出血,血液多呈咖啡色或鲜红色;②孕晚期出血:孕28周后的阴道出血;③抗病毒治疗:为了降低HBsAg阳性孕妇发生婴儿感染风险,临床上对HBV DNA载量>2×106拷贝/ml或具有HBsAg阳性家族史或既往子代感染HBV指征的孕妇建议抗病毒治疗,建议在怀孕24~28周开始口服替诺福韦或替比夫定,并于分娩前检测HBV DNA;④乙肝疫苗接种:乙肝疫苗全程需接种3针,免疫程序为0-1-6个月,即接种第1针疫苗后,间隔1、6个月分别接种第2、3针疫苗,每针疫苗接种20 μg;⑤ HBIG注射:目前仍在一些医院允许在孕期使用HBIG用于预防HBV宫内感染,一般用于孕晚期,于孕28、32及36周肌肉注射HBIG 200 IU或每月1次(200 IU/次),使用3~5次;具体剂量依据检测HBeAg状态、孕妇主观要求而定。
3.质量控制:调查员和实验员统一培训,调查表采用双录入并随机抽取10%进行重复测量,发放问卷28份,通过Kappa系数法一致性检验分析,Kappa值为0.99,表明本次调查信度较好。实验检测均设有阴阳性对照、空白对照,并随机抽取30%进行复测,通过Kappa系数法一致性检验分析,乙肝五项ELISA检测结果Kappa值为0.98;HBV DNA载量检测结果Kappa值为0.94,IFN-γ检测结果Kappa值为0.89,IL-12检测结果Kappa值为0.83。表明本研究检测结果可信度较好。
4.统计学分析:采用SPSS 19.0软件进行统计学分析。计量资料方差齐者采用t检验,方差不齐者采用t检验,计数资料采用χ2检验。相关影响因素采用多元线性回归分析估计相关因素与IFN-γ和IL-12的线性关联强度。把握度(1-β)=0.08,检验水准α=0.05,双侧检验。
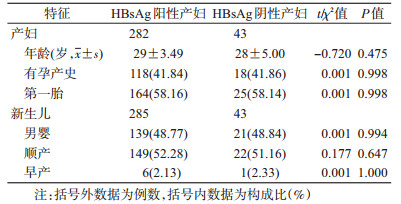
结果1.研究对象和BIT情况:HBsAg为阳性的产妇282例及其所生新生儿285例,产妇年龄(29±3.49)岁,HBsAg及HBV DNA均为阴性的正常产妇对照组43例,年龄(28±5.00)岁。2组社会人口学特征均衡可比(P>0.05)(表 1)。根据新生儿乙肝五项和HBV DNA检测发现:21例HBsAg为阳性者,HBsAg阴性新生儿中HBV DNA载量≥200拷贝/ml者116例,即该人群发生DBI率、OBI率和BIT率分别为7.37%(21/285)、40.70%(116/285)和48.07%(137/285)。
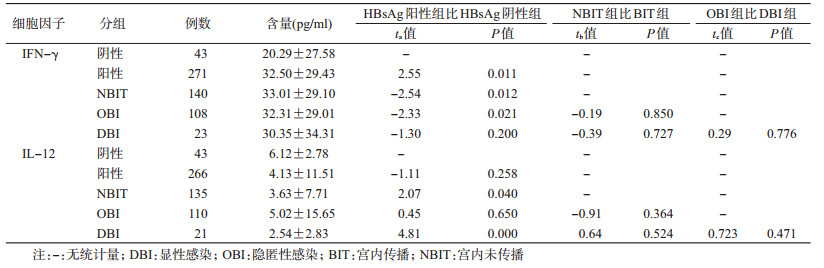
2.不同BIT分组产妇外周血的IFN-γ、IL-12水平比较:对照组IFN-γ水平低于HBsAg阳性产妇组(P=0.011)、NBIT组(P=0.012)和OBI组(P=0.021),除DBI组外,其他组差异均有统计学意义;对照组IL-12水平显著高于HBsAg阳性产妇NBIT组(P=0.040)和DBI组(P<0.001)(表 2)。
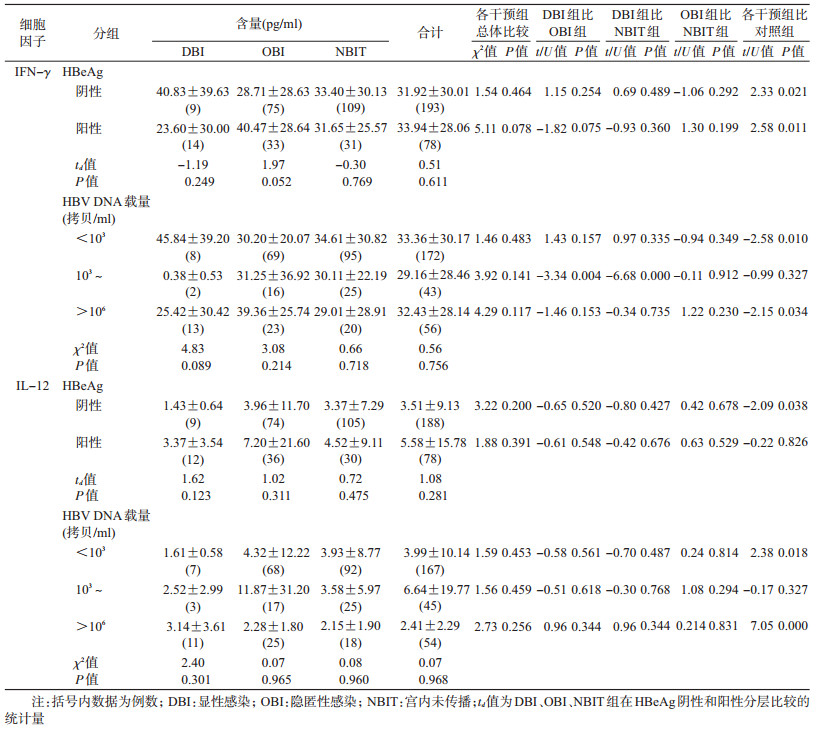
3.不同HBV感染特征的产妇外周血中IFN-γ、IL-12状况:HBsAg阳性产妇HBV感染特征包括:HBeAg和HBV DNA载量,①对照组的IFN-γ水平显著低于HBsAg阳性产妇的HBeAg阴性组和HBeAg阳性组(P<0.05),对照组的IL-12水平显著高于HBsAg阳性产妇的HBeAg阴性组(P=0.038);②HBV DNA载量按103拷贝/ml、106拷贝/ml为截点分组,各组IFN-γ水平均高于对照组,除103~106拷贝/ml组外,其他差异均有统计学意义(P<0.05),103~106拷贝/ml组中DBI组IFN-γ水平显著低于OBI组和NBIT组(P<0.01),除103~106拷贝/ml组外,其他组的IL-12水平显著低于对照组(P<0.05)(表 3)。
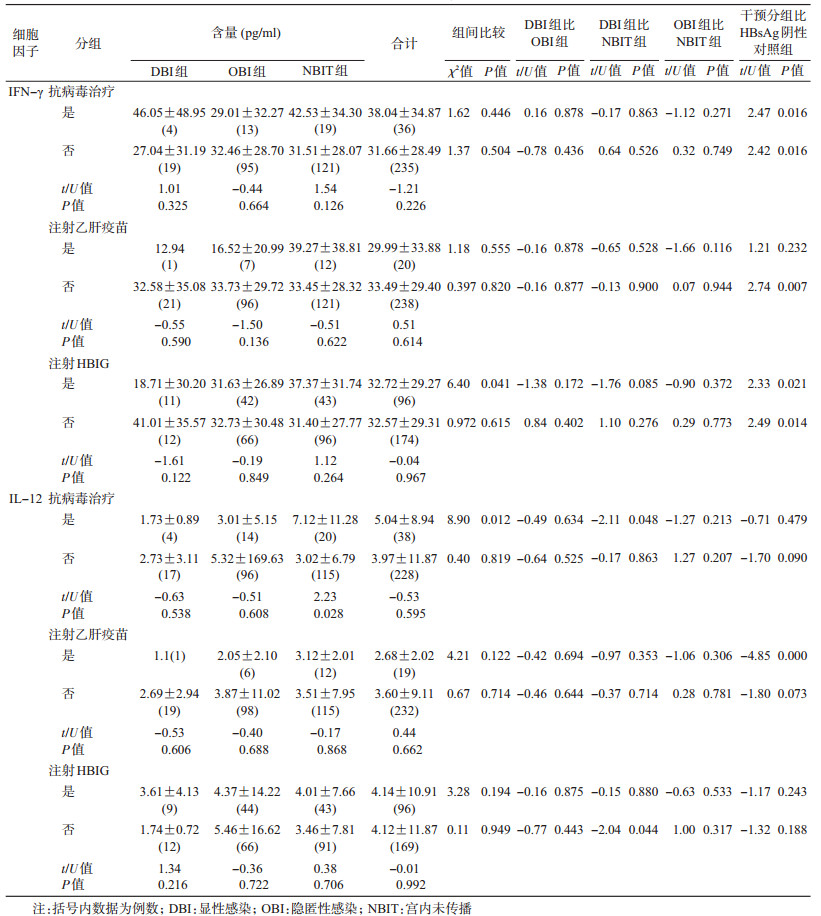
4. HBsAg阳性产妇孕期干预情况与IFN-γ、IL-12水平的关系:除接种乙肝疫苗组外,其他组均呈现IFN-γ水平显著高于对照组(P<0.05),注射HBIG组中随着BIT程度的加重,其IFN-γ含量明显减少(P=0.041);抗病毒治疗组中随着BIT程度的加重,其IL-12含量明显减少(P=0.012),尤其DBI组IL-12水平显著低于NBIT组(P=0.048),NBIT组中抗病毒治疗组IL-12水平显著高于未治疗组(P=0.028),未注射HBIG组中DBI组IL-12水平显著低于NBIT组(P=0.044)(表 4)。
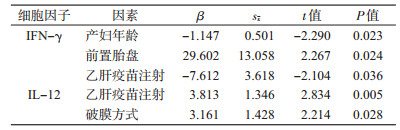
5. HBsAg阳性产妇各因素与IFN-γ、IL-12水平多因素分析:对母体的HBV感染血清学因素、妊娠过程中的暴露史以及新生儿出生时情况与IFN-γ、IL-12进行了相关分析,发现产妇IFN-γ水平与其年龄(P=0.035)、HBeAg(P=0.015)、乙肝疫苗注射(P=0.006)、HBIG注射(P=0.011)、抗病毒治疗(P=0.017)和前置胎盘(P=0.036)相关,IL-12与破膜方式相关(P=0.026),将相关因素列入回归模型(逐步法)进行多因素分析,排除了其他因素影响后结果显示,产妇年龄、前置胎盘和乙肝疫苗注射与母体IFN-γ水平的线性关系有统计学意义(P<0.05),破膜方式和乙肝疫苗注射与母体IL-12水平的线性关系有统计学意义(P<0.05)(表 5)。
CD8+ T细胞是HBV感染模型中清除病毒最主要的效应T细胞,IFN-γ是CD8+ T细胞功能活化的指标,不仅可通过调节机体免疫反应来抑制HBV的合成,还可通过非溶细胞机制直接抑制HBV复制[3-5]。本研究发现HBsAg阴性对照外周血中IFN-γ水平低于HBsAg阳性产妇、NBIT组和OBI组,同时按HBsAg阳性产妇HBV DNA载量不同分组,各组IFN-γ水平均高于对照组,均提示HBV感染可以刺激孕妇体内IFN-γ的分泌,有利于其体内HBV的清除。同时本研究还显示对照组IL-12水平显著高于HBsAg阳性产妇NBIT、DBI和HBeAg阴性组,在HBsAg阳性产妇HBV DNA载量≤106拷贝/ml,随着病毒载量的升高IL-12水平呈升高趋势,但当HBV DNA载量>106拷贝/ml时,其IL-12水平则显著下降。慢性HBV感染的自然史包括免疫耐受、免疫清除和非活动病毒携带期组成,影响其炎症过程的主要因素是病毒相关的免疫反应环节。本研究人群是HBsAg阳性产妇,均为孕早期至分娩期间(>6个月)多次体检检测外周血血清HBsAg阳性者,可能处于慢性HBV感染的不同免疫反应期,而病毒持续感染可以导致幼稚T细胞减少,效应T细胞的数量增加,但其功能受到影响[6],本研究的IFN-γ和IL-12因子水平出现标准差变异较大的现象,这可能是慢性HBV感染过程中T细胞表达的细胞因子动态变化所致,进一步验证低载量的HBV可以刺激母体的Th1细胞分泌IL-12。当HBV DNA载量>106拷贝/ml时,DBI组IL-12水平在3组中呈现最低的现象,并且随着BIT发生的严重程度加重,其IL-12水平呈现递减趋势,即当HBV DNA载量升高>106拷贝/ml时,其体内IL-12水平呈现缺乏,高水平的IL-12很可能是BIT的保护因素,这与动物研究[7]中使用IL-12能够抑制HBV在肝脏的复制,达到阻断宫内感染的发生是一致的;同时HBV DNA载量103~106拷贝/ml组中DBI组IFN-γ水平也显著低于OBI组和NBIT组,本研究表象与有关研究提出Th1细胞免疫下调,是导致HBV宫内感染的主要原因之一相符[8],发现在不同情况下均存在母体IFN-γ、IL-12水平低下者更易发生BIT,但IL-12又受到产妇体内病毒载量高低的影响,表明其在宫内感染中发挥抗病毒能力的作用是受限的。
新生儿展开乙肝疫苗和HBIG联合阻断HBV母婴传播已全面推广,但仍有10%~20%的母婴传播阻断失败,国内外专家提出HBV宫内感染是新生儿出生后乙肝疫苗接种失败的主要原因,本研究HBsAg阳性产妇采取的干预措施有抗病毒治疗、注射乙肝疫苗和HBIG,研究发现注射HBIG组中呈现随着BIT程度的加重,其IFN-γ含量明显减少的趋势;抗病毒治疗组中呈随着BIT程度的加重,其IL-12含量明显减少的趋势,尤其DBI组IL-12水平显著低于NBIT组,未注射HBIG组中DBI组IL-12水平显著低于NBIT组,即无论哪种干预措施,发生DBI的产妇其IFN-γ、IL-12水平均发生明显下调。Th1型免疫反应能增强宿主抵抗微生物的感染,尤其是对免疫调节、抗肿瘤及抗感染等具有十分重要的作用,体内IFN-γ、IL-12的分泌是通过增加Th1型细胞的活化实现的[9],HBsAg阳性产妇的IFN-γ、IL-12下调导致其机体抵抗HBV感染能力下降,发生DBI的概率则增加;既往有研究提出诱导免疫细胞产生足够的IFN-γ,或可消除或逆转免疫耐受,从而达到更有效的免疫应答[10],本研究发现NBIT组中抗病毒治疗组IL-12水平显著高于未治疗组,提示抗病毒治疗可以增强HBsAg阳性产妇的Th1型免疫反应,刺激IL-12分泌。IL-12参与机体细胞免疫应答,纠正HBV引起的免疫紊乱,有利于母体内HBV的清除[11],有效降低了胎儿HBV感染率,这与本次研究结果相一致。因此,提高HBsAg阳性产妇体内的IFN-γ、IL-12水平有利于阻断DBI。
妊娠是一个复杂机体免疫过程,不同孕期、多种内外因素都会导致体内细胞因子的波动,本研究提示产妇年龄、前置胎盘和乙肝疫苗注射与母体IFN-γ水平相关,破膜方式和乙肝疫苗注射与母体IL-12水平相关。剖宫产、人工破膜作为一种手术干预手段,手术创伤必然导致机体应激性反应,致使母体增强免疫反应,诱导机体Th1细胞免疫应答,从而促进IFN-γ、IL-12炎性因子水平升高[12-13],因此,提示在深入研究时,可以扩大样本量将这些因素进行分层研究。
OBI不能等同于宫内感染,目前也尚未见OBI的临床相关报道,关于该领域研究目前属于摸索阶段。既往HBV宫内感染的研究无论是新生儿在1个月内还是7个月大,均以HBsAg检测呈阳性作为宫内感染的诊断标准,本研究中采用更精确的定义名称——“HBV宫内显性感染”,研究中OBI的判定源自于一般人群HBV隐匿性感染的发现和定义,其阳性的截断点在本研究中选用了一般人群OBI的判断标准,可能存在人群适用性的问题,也是本研究的局限性,需要我们展开后期的随访进一步为OBI的科学判定提供依据。
控制BIT是一项复杂而艰巨的任务,必须建立在摸清BIT内在机制的基础上才能获得正确有效的干预措施;本研究受样本量的限制以及孕产妇体内多种复杂因素影响,还需要扩大样本量进行分层研究,进一步确定各项细胞因子在高危产妇中的作用。据此,HBV在特定情况下可以激发孕产妇体内IFN-γ的表达,同时有限度地抑制IL-12的分泌,但是IFN-γ在HBsAg阳性产妇体内的表达呈现组内分化现象,在HBeAg阳性和高载量的环境下母体IFN-γ的水平会下降;控制HBV宫内感染的首要任务是增强孕妇细胞免疫,以减少体内病毒负荷量。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
de Clercq E. Current treatment of hepatitis B virus infections[J]. Rev Med Virol, 2015, 25(6): 354-365. DOI:10.1002/rmv.1849 |
| [2] |
黄睿, 曹引丽, 高洁, 等. 西安市HBV宫内感染的发生情况及其影响因素研究[J]. 华南预防医学, 2017, 43(6): 507-511. Huang R, Cao YL, Gao J, et al. HBV intrauterine infection and its influencing factors in Xi'an[J]. South China J Prev Med, 2017, 43(6): 507-511. DOI:10.13217/j.scjpm.2017.0507 |
| [3] |
Li J, Ren WH, Ma W, et al. Interleukin-21 responses in patients with chronic hepatitis B[J]. J Interferon Cytokine Res, 2015, 35(2): 134-142. DOI:10.1089/jir.2013.0119 |
| [4] |
Li L, Jiang YX, Lao SH, et al. Mycobacterium tuberculosis- specific IL-21+IFN-γ+CD4+ T cells are regulated by IL-12[J]. PLoS One, 2016, 11(1): e0147356. DOI:10.1371/journal.pone.0147356 |
| [5] |
Zeng ZT, Kong XH, Li FL, et al. IL-12-based vaccination therapy reverses liver-induced systemic tolerance in a mouse model of hepatitis B virus carrier[J]. J Immunol, 2013, 191(8): 4184-4193. DOI:10.4049/jimmunol.1203449 |
| [6] |
Almanzar G, Schwaiger S, Jenewein B, et al. Long-term cytomegalovirus infection leads to significant changes in the composition of the CD8+ T-cell repertoire, which may be the basis for an imbalance in the cytokine production profile in elderly persons[J]. J Virol, 2005, 79(6): 3675-3683. DOI:10.1128/jvi.79.6.3675-3683.2005 |
| [7] |
Hamza T, Barnett JB, Li BY. Interleukin 12 a key immunoregulatory cytokine in infection applications[J]. Int J Mol Sci, 2010, 11(3): 789-806. DOI:10.3390/ijms11030789 |
| [8] |
冯永亮, 王素萍, 史晓红, 等. 人类白细胞抗原等位基因与HBV宫内感染关系[J]. 中国公共卫生, 2007, 23(1): 75-77. Feng YL, Wang SP, Shi XH, et al. Association between HLA-DR alleles and HBV intrauterine infection[J]. Chin J Public Health, 2007, 23(1): 75-77. DOI:10.3321/j.issn:1001-0580.2007.01.036 |
| [9] |
Guidotti LG, Isogawa M, Chisari FV. Host-virus interactions in hepatitis B virus infection[J]. Curr Opin Immunol, 2015, 36: 61-66. DOI:10.1016/j.coi.2015.06.016 |
| [10] |
王建设, 朱启镕. 宫内感染乙型肝炎病毒免疫失败儿童1型和2型细胞因子研究[J]. 中华儿科杂志, 2002, 40(8): 481-484. Wang JS, Zhu QR. Nonspecific overexpression of type 1 cytokine and low response to specific antigen in hepatitis B immunization failed children[J]. Chin J Pediatr, 2002, 40(8): 481-484. DOI:10.3760/j.issn:0578-1310.2002.08.014 |
| [11] |
罗琼, 李景平. IL-12的表达与细胞因子IFN-γ、IL-4在HBV宫内感染的相关性[J]. 山西医科大学学报, 2013, 44(8): 645-648. Luo Q, Li JP. Correlation between the expression of IL-12 and cytokines IFN-γ and IL-4 in HBV intrauterine infection[J]. J Shanxi Med Univ, 2013, 44(8): 645-648. DOI:10.3969/J.ISSN.1007-6611.2013.08.017 |
| [12] |
茹仙古丽·乌斯曼, 赵莉, 董武, 等. 分娩方式及剖宫产术后切口愈合情况对产妇血液流变学和细胞因子的影响[J]. 中国医药导报, 2016, 13(24): 113-116. Ruxianguli·Wusiman, Zhao L, Dong W, et al. Effect of delivery mode and wound healing on blood rheology and cytokines of puerpera after cesarean section[J]. Chin Med Her, 2016, 13(24): 113-116. |
| [13] |
Tsai S, Hardison NE, James AH, et al. Transcriptional profiling of human placentas from pregnancies complicated by preeclampsia reveals disregulation of sialic acid acetylesterase and immune signalling pathways[J]. Placenta, 2011, 32(2): 175-182. DOI:10.1016/j.placenta.2010.11.014 |
 2019, Vol. 40
2019, Vol. 40