文章信息
- 邵昱璋, 严敏, 胡妮, 王海荣, 付婷, 高洁, 张磊.
- Shao Yuzhang, Yan Min, Hu Ni, Wang Hairong, Fu Ting, Gao Jie, Zhang Lei.
- 母源外周血和胎盘组织中Toll样受体9表达在HBV宫内传播中的作用
- Role of TLR 9 expression in maternal peripheral blood and placenta in intrauterine transmission of HBV
- 中华流行病学杂志, 2019, 40(9): 1065-1070
- Chinese Journal of Epidemiology, 2019, 40(9): 1065-1070
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.09.009
-
文章历史
收稿日期: 2019-02-01
2. 空军军医大学军事预防医学系流行病学教研室 特殊作业环境危害评估与防治教育部重点实验室, 西安 710032
2. Department of Epidemiology, Key Laboratory of Hazard Assessment and Control in Special Operational Environment of Ministry of Education, School of Military Preventive Medicine, Air Force Military Medical University, Xi'an 710032, China
目前我国人群HBsAg阳性携带率高达6.1%[1],HBV垂直传播是重要传播途径之一[2-3]。Toll样受体家族(TLRs)是天然免疫系统的重要组成部分,其中Toll样受体9(TLR 9)在固有免疫和获得性免疫中具有重要作用,与乙型肝炎(乙肝)的发生、发展、治疗及预后密切相关[2]。本研究以HBsAg阳性产妇外周血和胎盘的TLR 9表达为监测目标,根据其新生儿HBV传播状况为结局,探讨母体TLR 9水平对胎儿HBV宫内传播(BIT)的影响作用,为探索BIT的预警指标提供参考依据。
对象与方法1.研究对象:收集2015年1月至2017年6月经陕西省西北妇女儿童医院产前筛查HBsAg为阳性的产妇及其新生儿,产妇290例,新生儿291例。纳入标准:①HBsAg为阳性产妇;②所生新生儿在出生24 h内未接种乙型肝炎(乙肝)疫苗和卡介苗前采集静脉血者;③知情同意。
2.研究方法:采用病例对照研究方法,根据HBsAg阳性产妇的新生儿HBV感染结果判定,分为病例组与对照组,比较病例组HBsAg阳性与对照组HBsAg阴性产妇TLR 9水平的差别。
(1) 分组:采用两组均数比较的样本量估计方法,根据预实验数据求得相关参数:病例组(0.41±0.39),对照组(4.14±8.42),等比例分组,采用PASS 16.0软件计算病例组与对照组样本量各为43例。同期选择年龄匹配的45例健康产妇为对照组,纳入标准:HBsAg、抗-HBs、HBeAg、抗-HBe和抗-HBc(乙肝五项)及HBV DNA检测均为阴性结果。排除标准:①罹患其他感染性疾病;②未签署知情同意书。
(2) 问卷调查:统一制定流行病学调查问卷,主要内容:产妇的一般情况、家族史、本次妊娠史、孕期干预史以及生产情况和新生儿情况等。
(3) 标本采集:采集临产前的产妇及其新生儿(出生24 h内)未抗凝静脉血,新生儿需未接种乙肝疫苗和卡介苗前。分离血清,-20 ℃保存备用。采集产妇胎盘组织,10%福尔马林浸泡,蜡块包埋,切片备用。
(4) 血清HBV标志物检测:产妇及新生儿乙肝五项均采用ELISA法检测,操作和结果判定按试剂盒说明书(北京万泰生物药业股份有限公司)进行。HBV DNA载量采用PCR-荧光探针法检测,操作和结果判定按照试剂盒说明书(湖南圣湘生物科技有限公司)进行。
(5) 产妇外周血TLR 9检测:采用人TLR 9 ELISA试剂盒(北京方程生物有限公司)。检测均严格按照试剂盒说明书进行操作和判读结果。
(6) 胎盘组织TLR 9检测:鼠抗人TLR 9单克隆抗体(美国Imgenex公司),鼠抗人HBsAg单克隆抗体(上海长岛生物技术有限公司),免疫组织化学试剂盒(武汉博士德生物工程有限公司)。设立阴性对照:5例健康产妇足月胎盘组织;空白对照:以磷酸盐缓冲生理盐水代替一抗。Olympus DP70数码显微镜在相同条件下采集图片,使用Image-Pro Plus 6.0图像分析系统中macro下的pathology宏批量检测TLR 9的累计光密度(integrated optical density,IOD)。
(7) 新生儿HBV感染结果判定:① BIT:HBV宫内显性感染(DBI)与HBV宫内隐匿性感染(OBI)的统称[2],即HBsAg阳性产妇所生新生儿24 h静脉血中HBsAg阳性或HBV DNA载量≥200拷贝/ml[3];②DBI:HBsAg阳性产妇所生新生儿24 h静脉血中HBsAg阳性者;③OBI:HBsAg阳性产妇所生新生儿24 h静脉血中HBsAg阴性,但HBV DNA载量≥200拷贝/ml,或者新生儿在全程接种乙肝免疫球蛋白(HBIG)和3针乙肝疫苗后外周静脉血中HBsAg阴性,但HBV DNA载量≥200拷贝/ml;④HBV宫内未传播(NBIT):新生儿外周血检测HBsAg和HBV DNA均为阴性。
3.质量控制:调查员、实验员进行统一培训,采用双人双录入核对,随机抽取10%重复测量,发放问卷30份,通过Kappa系数法一致性检验分析,Kappa值为0.99,表明本次调查的信度较好。实验均设阴阳性、空白对照,并随机抽取30%进行复测,通过Kappa系数法一致性检验分析,乙肝五项ELISA检测结果Kappa值为0.99;HBV DNA载量检测结果Kappa值为0.91,TLR 9检测结果Kappa值为0.79,表明本次检测可信度较好。
4.统计学分析:采用SPSS 19.0软件进行统计学分析。正态分布采用(x±s)描述,偏态分布采用M(P25~P75)描述。两组比较方差齐者采用t检验,方差不齐者采用Mann-Whitney U检验;多组比较方差齐者采用方差分析,方差不齐者采用非参Kruskal- Wallis检验。把握度(1-β)=0.08,检验水准α=0.05,双侧检验。
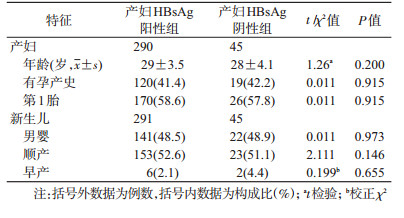
结果1.社会人口学特征和BIT情况:收集2015年1月至2017年6月经陕西省西北妇女儿童医院产前筛查的290例HBsAg为阳性产妇,年龄[(29±3.5)20~45]岁,45例健康产妇年龄[20~45(28±4.1)]岁,人口学特征见表 1。结果发现,291名新生儿中HBsAg为阳性者27例,HBsAg阴性新生儿中HBV DNA载量≥200拷贝/ml者117例,即该人群DBI、OBI和BIT率分别为9.28%(27/291)、40.21%(117/291)、49.48%(144/291)。
2. HBsAg阳性产妇及其BIT分组与对照组外周血中TLR 9水平比较:HBsAg阳性产妇外周血的TLR 9水平[290例,(2.41±4.48) pg/ml]显著低于HBsAg阴性者[45例,1.83(0.84~4.00) pg/ml](U=4 457.00,P=0.001),其中NBIT组[146例,0.70(0.14~1.60)pg/ml]和OBI组[117例,0.74(0.14~1.60)pg/ml]均显著低于对照组(U=1 825.00,P=0.000;U=1 672.00,P=0.000);NBIT组TLR 9水平显著低于BIT组[144例,1.21(0.28~4.31)pg/ml](U=8 779.00,P=0.015);DBI组的TLR 9水平[27例,5.06(3.70~8.07)pg/ml]显著高于NBIT组[146例,0.70(0.14~1.60)pg/ml](U=537.00,P=0.000)和OBI组[117例,0.74(0.14~1.60)pg/ml](U=475.00,P=0.000),随着BIT程度的加重,HBsAg阳性产妇外周血TLR 9含量呈增加趋势(χ2=37.75,P= 0.000)(图 1)。

|
| 注:DBI:显性感染;OBI:隐匿性感染;BIT:宫内传播;NBIT:宫内未传播 图 1 HBsAg阳性产妇及各分组与对照组Toll样受体9(TLR 9)水平 |
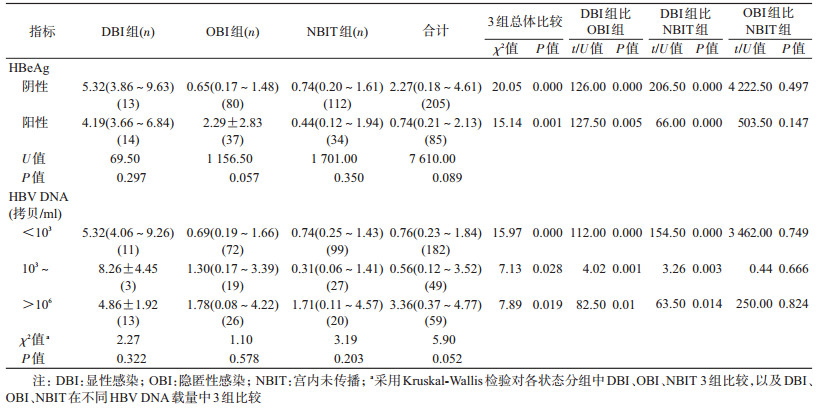
3. HBsAg阳性产妇不同HBV感染状态下TLR 9水平状况:HBsAg阳性产妇HBV感染状态包括HBeAg和HBV DNA载量:①HBeAg:HBeAg阴性组产妇的TLR 9水平显著低于HBsAg阴性对照组(U=2 795.00,P=0.000),HBeAg阳性组TLR 9水平虽然低于HBsAg阴性对照组,但差异无统计学意义(U=69.50,P=0.297);每组按BIT程度分为:DBI、OBI和NBIT组,均随着BIT程度的加重,产妇TLR 9含量呈增加趋势(P<0.01);无论HBeAg阴性和阳性组,DBI组TLR 9水平均显著高于OBI组和NBIT组(P<0.01)。②HBV DNA载量:按103拷贝/ml、106拷贝/ml为截点分3个层次,每层均随BIT程度的加重,其TLR 9含量呈增加趋势(P<0.05),每层中DBI组TLR 9水平均显著高于OBI组和NBIT组(P<0.05)(表 2)。
4. HBsAg阳性产妇孕期干预情况与TLR 9水平的关系:DBI、OBI、NBIT组在抗病毒治疗、接种乙肝疫苗和注射HBIG各因素干预与未干预间TLR 9水平差异均无统计学意义(P>0.05)。抗病毒治疗、注射HBIG和未接种乙肝疫苗组,均随着BIT程度的加重,产妇外周血TLR 9含量呈增加趋势(P<0.05),除注射乙肝疫苗组外,其他组别均呈现DBI组的TLR 9水平显著高于OBI组和NBIT组(P<0.05)(表 3)。
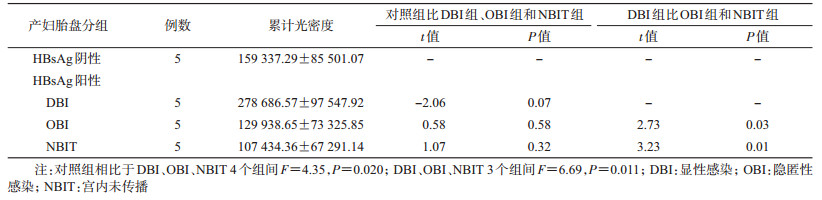
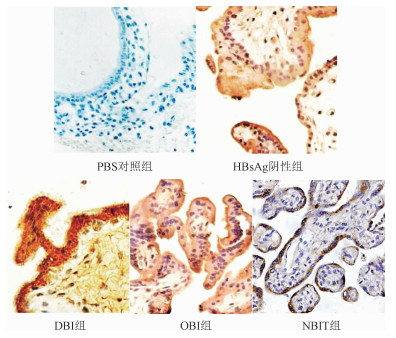
5.胎盘组织TLR 9检测情况:免疫组化显示,生理盐水缓冲液(PBS)对照组未见TLR 9棕黄色阳性信号,5例HBsAg阴性胎盘组织和15例HBsAg阳性胎盘组织(包括5例DBI组、5例OBI组和5例NBIT组)均能检测到TLR 9阳性信号,各组间方差分析呈现的差异有统计学意义(P<0.05),其中DBI组胎盘TLR 9表达强度明显强于HBsAg阴性胎盘组织、OBI组和NBIT组胎盘组织,其免疫组化累计光密度差异有统计学意义(P<0.05)(表 4、图 2)。
|
| 注:DBI:显性感染;OBI:隐匿性感染;NBIT:宫内未传播;PBS:生理盐水缓冲液 图 2 胎盘组织中TLR 9的免疫组化结果(×200) |
既往研究发现约>50%的HBV感染新病例是母婴传播引起的[3],本研究发现该HBsAg阳性产妇发生DBI率、OBI率、BIT率分别为9.28%、40.21%和49.48%,其中OBI是DBI的5.18倍,这部分人群可能是潜在乙肝疫苗无应答以及发生HBV母婴传播的高危人群,因此,对于BIT的预警监测研究不仅要包括DBI者,还要包括OBI者,才能实现全方位防控乙肝的目的。
表达于细胞器膜上的TLR 9在与细菌/病毒等DNA的非甲基化CpG为配体结合后有诱导凋亡的潜力[4]。有研究认为慢性乙肝患者TLR 9的表达下调,诱导病毒持续感染或机会性感染明显增加[5]。本研究发现HBsAg阳性产妇外周血的TLR 9水平显著低于HBsAg阴性产妇,其中NBIT组产妇和OBI组产妇均显著低于对照组,既往研究提出HBV的病毒核心dsDNA主要被TLR 9所识别,HBV感染能显著抑制TLR 9的表达[6],本研究结果与文献一致。
在病毒保护实验中发现通过激活TLR 9加强肝细胞的免疫应答能力,不但可以抑制HBV复制,还可能加快HBV在机体内的清除速度[7],本研究发现HBsAg阳性产妇随着BIT程度的加重,产妇外周血TLR 9含量呈增加趋势。不仅HBsAg阳性产妇中DBI组母体TLR 9均发生上调,随着BIT程度的加重,其TLR 9含量呈增加趋势,而且按HBV DNA载量103拷贝/ml、106拷贝/ml为截点分3个层次,每层均随着BIT程度的加重,其TLR 9含量呈明显增加趋势。有研究发现慢性重型乙型肝炎(CSHB)患者外周单核细胞(PBMCs)中TLR 9的mRNA表达比肝硬化患者明显增高,虽然CSHB患者PBMCs作为APC通过TLR 9途径呈递HBV抗原并提供第二信号刺激的能力受损,但通过PBMCs中B淋巴细胞代偿性上调TLR 9表达,增强了第二信号刺激,提示重症肝炎反而存在TLR 9上调表达的现象[8],本研究结果符合既往研究推论。BIT中胎盘是一个重要途径,在本免疫组化结果显示DBI的胎盘组织中TLR 9表达显著高于OBI组和NBIT组,和母体外周血的TLR 9表达水平一致。进一步佐证了在HBsAg阳性孕妇体内TLR 9水平呈增高的组内交叉分化现象,这为早期预测DBI提供了一个有效指标。
除注射乙肝疫苗组样本量太少外,其他干预组与未干预组呈现DBI组的TLR 9水平显著高于OBI组和NBIT组,并随着BIT程度的加重,产妇外周血TLR 9含量有明显增加趋势。进一步分析发现孕期抗病毒治疗和注射HBIG的孕妇皆为HBV DNA高载量或者HBeAg阳性者,其感染病情重于其他HBsAg阳性孕妇,推测发生BIT的母体由于体内HBV的活跃性高于NBIT组,可能存在刺激母体B淋巴细胞免疫应答,代偿性上调TLR 9表达,此研究结局符合既往研究结论[8]。
综上所述,HBV一定程度上会抑制产妇体内分泌TLR 9,但HBeAg能刺激母体TLR 9分泌,随着BIT程度的加重,其体内TLR 9水平呈增高的组内交叉分化现象,因此,TLR 9不是一个能独立筛选分组的标记,但可以做为HBsAg阳性产妇监测管理的参考指标。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Zhang WL, Ji ZH, Wang L, et al. A Meta-analysis of HBsAg- positive rate among general Chinese populations aged 1-59 years[J]. Infect Dis, 2015, 47(12): 878-888. DOI:10.3109/23744235.2015.1064541 |
| [2] |
Shahrakyvahed A, Sanchooli J, Sanadgol N, et al. TLR 9:an important molecule in the fight against hepatitis B virus[J]. Postgrad Med J, 2014, 90(1065): 396-401. DOI:10.1136/postgradmedj-2013-132309 |
| [3] |
黄睿, 曹引丽, 高洁, 等. 西安市HBV宫内感染的发生情况及其影响因素研究[J]. 华南预防医学, 2017, 43(6): 507-511. Huang R, Cao YL, Gao J, et al. HBV intrauterine infection and its influencing factors in Xi'an[J]. South China J Prev Med, 2017, 43(6): 507-511. DOI:10.13217/j.scjpm.2017.0507 |
| [4] |
Mahla RS, Reddy MC, Prasad DVR, et al. Sweeten PAMPs:Role of sugar complexed PAMPs in innate immunity and vaccine biology[J]. Front Immunol, 2013, 4: 248. DOI:10.3389/fimmu.2013.00248 |
| [5] |
贾妮娜, 谢青, 安宝燕, 等. 慢性乙型肝炎病毒感染者外周血浆样树突状细胞Toll样受体9的表达和分泌功能[J]. 中华传染病杂志, 2007, 25(12): 714-718. Jia NN, Xie Q, An BY, et al. Toll like receptor 9 expression and functions of plasmacytoid dendritic cells in the peripheral blood of patients with chronic hepatitis B virus infection[J]. Chin J Infect Dis, 2007, 25(12): 714-718. DOI:10.3760/j.issn:1000-6680.2007.12.003 |
| [6] |
Wagner H. The sweetness of the DNA backbone drives Toll-like receptor 9[J]. Curr Opin Immunol, 2008, 20(4): 396-400. DOI:10.1016/j.coi.2008.06.013 |
| [7] |
Wu J, Lu MJ, Meng ZJ, et al. Toll-like receptor-mediated control of HBV replication by nonparenchymal liver cells in mice[J]. Hepatology, 2007, 46(6): 1769-1778. DOI:10.1002/hep.21897 |
| [8] |
陈煜, 时红波, 张帆, 等. 慢性重型肝炎患者外周血单个核细胞中TLR 2、TLR 3和TLR 9的mRNA表达[J]. 肝脏, 2010, 15(4): 244-246, 315. Chen Y, Shi HB, Zhang F, et al. Expression of TLR 2, TLR 3, TLR 9 mRNA in PBMC of patients with chronic severe hepatitis[J]. Chin Hepatol, 2010, 15(4): 244-246, 315. DOI:10.3969/j.issn.1008-1704.2010.04.002 |
 2019, Vol. 40
2019, Vol. 40