文章信息
- 胡妮, 续靖宁, 李芳, 付婷, 王海荣, 高洁, 张磊.
- Hu Ni, Xu Jingning, Li Fang, Fu Ting, Wang Hairong, Gao Jie, Zhang Lei.
- 西安市HBsAg阳性产妇HBV宫内传播的流行病学研究
- Epidemiology study of intrauterine transmission of HBV in HBsAg-positive parturients in Xi'an
- 中华流行病学杂志, 2019, 40(9): 1059-1064
- Chinese Journal of Epidemiology, 2019, 40(9): 1059-1064
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.09.008
-
文章历史
收稿日期: 2019-02-01
2. 西安市疾病预防控制中心 710054;
3. 西北妇女儿童医院, 西安 710061
2. Xi'an Municipal Center for Disease Control and Prevention, Xi'an, 710054, China;
3. Northwest Women and Children Hospital, Xi'an 710061, China
HBV感染是全球性公共卫生问题,我国属乙型肝炎(乙肝)高负担国家,近年来随着乙肝疫苗推广应用,我国人群HBsAg阳性携带率控制至6.1%[1]。乙肝疫苗有效地遏制了HBV水平传播,但是HBV垂直传播无法完全阻断[2];同时,HBV垂直传播不仅存在于HBsAg阳性孕妇中,而且HBV宫内隐匿性感染(OBI)的产妇也存在OBI占垂直传播14%的比例[3]。本研究发现,HBsAg阳性产妇所生新生儿发生OBI的比例为40.07%[4]。本研究对此展开随访,以期全面描述HBV宫内传播(BIT)的特征。
对象与方法1.研究对象:连续收集2015年1月至2018年1月在陕西省西北妇幼儿童医院产前检查和筛查HBsAg阳性产妇及其所生新生儿,且知情同意,愿意并能够采集新生儿外周血者,共收集产妇341例,新生儿344例(双胞胎3例)。并从2016年8月至2018年10月随访该队列母亲及其婴儿HBV感染状况。
2.研究方法:采用巢式病例对照研究的成组设计。
(1) 分组:根据HBsAg阳性产妇的新生儿HBV感染结果判定,分为病例组与对照组,病例组分为HBV宫内显性感染(DBI)、OBI以及BIT 3个组,对照组为HBV宫内未传播(NBIT)组。
(2) 问卷调查:①产时调查内容:产妇和新生儿的一般情况、家族史、本次妊娠情况以及生产情况。②随访调查内容:婴幼儿喂养、生活护理、患病就医和免疫接种情况。
(3) 标本采集:①产时:采集产妇静脉血及其新生儿(出生24 h内)股静脉血;②随访:采血后新生儿接种乙肝疫苗、卡介苗和乙肝免疫球蛋白(HBIG),完成乙肝疫苗全程0-1-6方案免疫接种2个月后采集其外周静脉血,均1 500 r/min、6 min分离血清,-20 ℃保存备用。
(4) 血清HBV标志物检测:产妇和新生儿HBsAg、抗-HBs、HBeAg、抗-HBe、抗-HBc(乙肝五项)采用ELISA法检测,操作和结果判定按试剂盒说明书(北京万泰生物药业股份有限公司)进行。新生儿和产妇HBV DNA载量采用PCR-荧光探针法试剂检测,操作和结果判定按照试剂盒说明书(湖南圣湘生物科技有限公司)进行。
(5) 新生儿HBV感染结果判定[5-6]:① BIT:DBI与OBI的统称[2],即HBsAg阳性产妇所生新生儿24 h静脉血中HBsAg阳性或HBV DNA载量≥200拷贝/ml[3];②DBI:HBsAg阳性产妇所生新生儿24 h静脉血中HBsAg阳性者;③OBI:HBsAg阳性产妇所生新生儿24 h静脉血中HBsAg阴性,但HBV DNA载量≥200拷贝/ml,或者新生儿在全程接种HBIG和3针乙肝疫苗后外周静脉血中HBsAg阴性,但HBV DNA载量≥200拷贝/ml;④NBIT:新生儿外周血检测HBsAg和HBV DNA均为阴性者。
(6) 相关定义:①孕早期出血:孕1~13周,出现的阴道出血,血液多呈咖啡色或鲜红色;②孕晚期出血:孕28周后的阴道出血;③抗病毒治疗:为了降低HBV感染孕妇发生婴儿感染的危险,临床上对HBV DNA载量>2×106拷贝/ml或具有HBsAg阳性家族史或既往子代感染HBV指征的孕妇建议抗病毒治疗,建议在怀孕24~28周开始口服替诺福韦或替比夫定,并于分娩前检测HBV DNA;④乙肝疫苗注射:乙肝疫苗全程需接种3针,免疫程序为0-1-6个月,即接种第1针疫苗后,间隔1、6个月分别注射第2、3针疫苗,每针接种20 μg;⑤HBIG注射:目前仍在一些医院允许在孕期使用HBIG预防HBV宫内感染;一般用于孕晚期,于孕28、32及36周肌肉注射HBIG 200 IU或每月1次(200 IU/次),使用3~5次;具体剂量依据检测HBeAg状态、孕妇主观要求而定。
3.质量控制:调查员进行统一培训,抽取10%调查表在1周内进行重复调查;调查表采用双人双录入核对;实验检测均设有阴阳性对照、空白对照,并随机抽取30%进行复测;乙肝五项首次测定结束,抽取10%标本进行HBsAg复测;随访调查时,每对母子均进行电话访问与面访2次调查核对,并将问卷内容同其免疫接种证或病案史核对。
4.统计学分析:采用SPSS 19.0软件进行统计学分析。计数资料采用χ2检验,计量资料采用t检验。HBsAg阳性产妇HBV血清学状况、孕期事件对新生儿发生BIT的相关因素分析采用logistic回归分析。双侧检验,以P<0.05为差异有统计学意义。
结果1.调查情况:产妇共86 244例,HBsAg阳性者3 025例(3.51%),纳入研究对象有341例(86.99%),年龄[18~45(29.6±3.7)]岁。抽取40份调查表在1周内进行重复调查,符合率为99%;乙肝五项首次测定结束,抽取80份标本进行HBsAg复测,Kappa值为0.82;抽取90份标本进行ELISA复测,Kappa值为0.97;抽取80份标本进行HBV DNA载量复测,Kappa值为0.91,可信度较好。
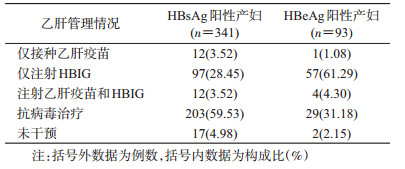
2. HBsAg阳性产妇孕期乙肝管理情况:341例HBsAg阳性产妇在孕期仅24例(7.04%)进行了乙肝疫苗接种,109例(31.96%)注射HBIG,乙肝疫苗和HBIG均注射者仅12例(3.52%)。其中93例HBeAg阳性产妇中61例(65.59%)进行了HBIG注射,29例(31.18%)进行了抗病毒治疗(表 1)。
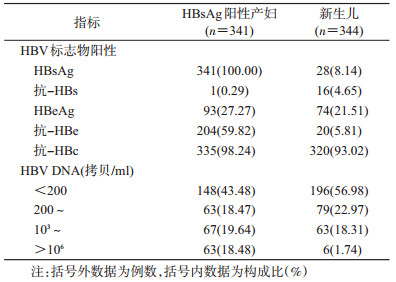
3. HBsAg阳性产妇及其新生儿外周血HBV标志物:341例HBsAg阳性产妇中HBsAg、HBeAg、抗-HBc均阳性者90例(26.39%),HBsAg、抗-HBe、抗-HBc均阳性者204例(59.82%),其他类型47例(13.78%)。344例新生儿出生24 h之内HBsAg为阳性的28例,即DBI为8.14%(28/344);荧光定量PCR检测新生儿外周血HBV DNA载量发现:HBsAg为阴性且HBV DNA≥200拷贝/ml者132例,即OBI率为38.37%(132/344)(表 2)。
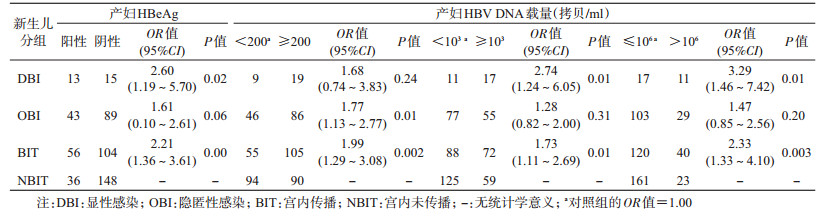
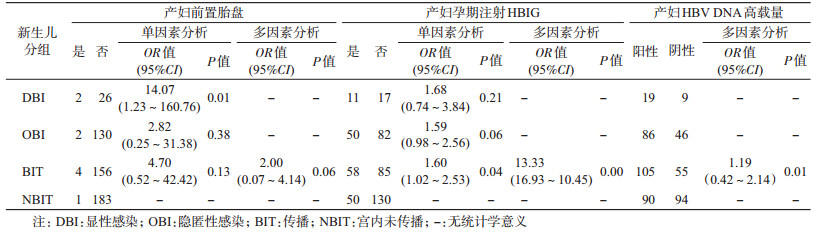
4. HBsAg阳性产妇HBV血清学状况、孕期事件对新生儿发生BIT的相关因素分析:产妇HBeAg阳性、HBV DNA高载量和前置胎盘3个因素分别与发生BIT均呈显著相关(P<0.05)。DBI、OBI和BIT病例组,与NBIT对照组比较,HBeAg阳性产妇的新生儿发生DBI的风险是HBeAg阴性者的2.60倍;发生BIT的风险是HBeAg阴性者的2.21倍;产妇HBV DNA载量≥103、>106拷贝/ml者所生新生儿发生DBI的风险分别是<103、≤106拷贝/ml者的2.74、3.29倍;HBV DNA载量≥200拷贝/ml者所生新生儿发生OBI的风险是<200拷贝/ml者的1.77倍;HBV DNA载量≥200、≥103和>106拷贝/ml者所生新生儿发生BIT的风险分别是<200、<103和≤106拷贝/ml者的1.99、1.73和2.33倍(表 3)。孕期有前置胎盘者的新生儿发生DBI是无前置胎盘者的14.07倍(表 4);孕期未注射HBIG产妇的新生儿发生BIT是注射者的1.60倍(表 5)。将产妇HBeAg阳性、HBV DNA高载量、前置胎盘进行多因素logistic回归模型分析结果显示,产妇HBV DNA载量与新生儿发生BIT呈正相关(P<0.01),孕期HBIG注射与新生儿发生BIT负相关(P<0.01)(表 4)。
5.随访结果:
(1) 随访基本情况:344例研究对象随访到91例,随访率为26.45%。随访人群和基线人群在性别、生产方式、生产时间和年龄等一般特征进行了均衡性检验,差异无统计学意义(P>0.05)。DBI组随访到14例(14/28,50.00%),OBI组随访到37例(37/132,24.24%),NBIT组随访到40例(40/184,21.74%)。
(2) 随访母亲情况:随访到母亲91例,HBsAg转阴率为14.28%(13/91),抗-HBs转阳率为7.69%(7/91),其中有1例母亲为HBsAg和抗-HBs双阳性。
(3) 随访幼儿情况:14例DBI组新生儿中,9例发生HBsAg转阴(9/14),5例仍为HBsAg阳性(5/14),即HBV母婴传播率为5.49%(5/91);OBI组新生儿的HBV DNA转阴率为62.16%(23/37)。抗-HBc阳性转阴性的比例为51.64%(47/91);OBI率为24.17%(22/91),总的乙肝疫苗免疫应答率为69.23%(63/91),DBI、OBI和NBIT组的乙肝疫苗免疫应答率分别为57.14%(8/14)、78.38%(29/37)和65.00%(26/40)。随访幼儿中,OBI组乙肝疫苗免疫应答率为59.09%(13/22)。基线中各组与NBIT组比较发现,OBI组在幼儿期发生OBI的风险是NBIT组的3.00倍(95%CI:1.02~9.23)。见表 5。
讨论我国是HBV感染中高流行区,慢性HBV携带者中约有40%~50%是通过母婴传播感染的[6],本研究提出的DBI即为传统研究的HBV宫内感染,既往研究报道HBV宫内感染发生率为3.07%~16.87%[7-10],本研究采取新生儿24 h内未注射乙肝疫苗及卡介苗的股静脉血,采用特异性高的ELISA方法,确保了样本检测的可靠性和准确性,341例HBsAg阳性产妇所产新生儿的HBsAg阳性率(即DBI率)为8.14%,显著高于重庆市(3.07%)[7],但低于湖北省(15.96%)[8]、河北省(16.87%)[9]和浙江省(11.32%)[10]的HBV宫内感染率;同时本研究发现该人群还存在新生儿的OBI率为38.37%。在发达国家,HBsAg阴性献血员中有0.007%~0.05%的HBV DNA检测结果呈阳性[11-14],国内报道合格献血者的HBV OBI为0.79%~2.86%[15-16],安徽省报道婴儿脐带血OBI为29.46%[13]。本研究的HBsAg阳性产妇的新生儿属于高危暴露人群,在孕育和产程中可能存在HBV通过胎盘进入胎儿体内,因此OBI率显著高于普通人群和献血员,尤其新生儿发生OBI率是DBI的4.7倍,故更应关注HBsAg阳性产妇所生新生儿发生OBI的情况。
本研究发现,与BIT显著相关的因素包括:①孕妇HBeAg的状态:HBeAg阳性产妇其新生儿发生DBI、BIT的风险是HBeAg阴性者的2.60倍和2.21倍,提示产妇HBeAg阳性不仅能增加DBI的风险,也能增加BIT的风险。与既往研究相符,HBeAg阳性产妇相比HBeAg阴性产妇更易发生垂直传播[17],建议育龄女性孕前检查HBeAg阳性者,应在医师指导下采用核苷类药物干预,做到疾病一级预防。②HBV DNA载量水平:产妇外周血HBV DNA载量≥103拷贝/ml以及>106拷贝/ml者所生新生儿发生DBI的危险分别是<103拷贝/ml及≤106拷贝/ml者的2.74及3.29倍,产妇HBV DNA高载量是BIT的高危因素之一,得到了多项研究的证实[18],本研究也发现产妇外周血HBV DNA载量高水平是DBI发生的危险因素;同时,产妇外周血HBV DNA载量≥200拷贝/ml所生新生儿发生OBI的危险是<200拷贝/ml的1.77倍,既往研究认为HBV DNA≥103拷贝/ml才有临床意义,本研究发现HBsAg阳性产妇其HBV DNA≥200拷贝/ml时,其新生儿发生BIT和OBI的危险均增大,建议临床应以HBV DNA≥200拷贝/ml为截点对育龄妇女进行相应的健康指导。③前置胎盘:HBsAg阳性产妇合并前置胎盘所生新生儿发生DBI是无前置胎盘者的14.07倍,有研究报道前置胎盘者其胎盘屏障功能易破坏,功能易受到一定损伤[2],增加了HBV通过胎盘屏障的概率。④孕期干预:既往有文献报告孕期HBIG注射对HBV宫内感染有2种倾向,本研究发现孕期注射HBIG对阻断BIT具有一定意义。
本研究发现,随访幼儿中的HBV母婴传播率为5.49%,与2015年武汉地区的HBV母婴传播率5.44%持平[19];DBI组幼儿中,64.28%发生HBsAg阴转,37例OBI组幼儿中62.16%HBV DNA转阴,51.64%幼儿抗-HBc阳性转为抗-HBc阴性(47/91),但是HBsAg阴性幼儿的OBI率为24.17%,进一步分析发现OBI组在幼儿期发生OBI的危险性是NBIT组的3倍,远高于甘肃省武威市HBsAg阳性母亲所生的乙肝疫苗接种幼儿OBI率为4.92%[20]。91例幼儿均全程接种乙肝疫苗3针,乙肝疫苗免疫应答率为69.23%,DBI组免疫应答率为57.14%(8/14),OBI组免疫应答率为78.38%(29/37),NBIT组免疫应答率为65.00%(26/40);在随访幼儿中,OBI组幼儿的乙肝疫苗免疫应答率仅为59.09%(13/22),与甘肃省武威市调查0~12岁社区儿童乙肝疫苗免疫应答率仅为57.35%接近[21]。一项中国儿童OBI的研究表明,OBI与乙肝疫苗全程接种后的无应答显著相关,父母HBsAg阳性是幼儿低或无应答的高危因素[21],现有的疫苗对OBI没有保护作用,可能是由于OBI与乙肝疫苗的无应答以及保护性抗体滴度减少有关[22]。
综上所述,育龄妇女孕前优生健康检查应包括乙肝五项和HBV DNA;学龄前儿童感染HBV慢性化的风险远高于成年人,继而引发肝硬化和肝癌。OBI容易造成免疫无应答,特殊情况下有被激活的风险,因此OBI更应受到重视。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Zhang WL, Ji ZH, Wang L, et al. A Meta-analysis of HBsAg- positive rate among general Chinese populations aged 1-59 years[J]. Infect Dis, 2015, 47(12): 878-888. DOI:10.3109/23744235.2015.1064541 |
| [2] |
World Health Orgnization. Guidelines for the prevention, care and treatment of persons with chronic hepatitis B infection[EB/OL].(2015-03-01)[2019-01-01]. https://www.who.int/hiv/pub/hepatitis/hepatitis-b-guidelines/en/.
|
| [3] |
Raimondo G, Caccamo G, Filomia R, et al. Occult HBV infection[J]. Semin Immunopathol, 2013, 35(1): 39-52. DOI:10.1007/s00281-012-0327-7 |
| [4] |
黄睿, 曹引丽, 高洁, 等. 西安市HBV宫内感染的发生情况及其影响因素研究[J]. 华南预防医学, 2017, 43(6): 507-511. Huang R, Cao YL, Gao J, et al. HBV intrauterine infection and its influencing factors in Xi'an[J]. South China J Prev Med, 2017, 43(6): 507-511. DOI:10.13217/j.scjpm.2017.0507 |
| [5] |
Raimondo G, Allain JP, Brunetto MR, et al. Statements from the Taormina expert meeting on occult hepatitis B virus infection[J]. J Hepatol, 2008, 49(4): 652-657. DOI:10.1016/j.jhep.2008.07.014 |
| [6] |
Shi ZJ, Yang YB, Wang H, et al. Breastfeeding of newborns by mothers carrying hepatitis B virus:a Meta-analysis and systematic review[J]. Arch Pediatr Adolesc Med, 2011, 165(9): 837-846. DOI:10.1001/archpediatrics.2011.72 |
| [7] |
李雪黎, 张俊, 汪成丽. 乙型肝炎孕妇感染标志物与新生儿感染相关性分析[J]. 国际检验医学杂志, 2018, 39(4): 495-498. Li XL, Zhang J, Wang CL. Analysis of the correlation between infection markers of pregnant women with hepatitis B and neonatal infection[J]. Int J Lab Med, 2018, 39(4): 495-498. DOI:10.3969/j.issn.1673-4130.2018.04.034 |
| [8] |
杜二球, 段学英, 高霞, 等. 562例HBsAg阳性孕妇HBV宫内感染及产后随访分析[J]. 中国妇幼健康研究, 2017, 28(2): 178-180. Du EQ, Duan XY, Gao X, et al. HBV intrauterine infection and postpartum follow-up in 562 cases of HBV positive pregnant women[J]. Chin J Woman Child Health Res, 2017, 28(2): 178-180. DOI:10.3969/j.issn.1673-5293.2017.02.026 |
| [9] |
王兰芳.乙肝病毒携带产妇感染状态与新生儿母婴传播的相关性研究[D].合肥: 安徽医科大学, 2014. Wang LF. A correlation study of the impact of maternal HBV infection on the mother-to-fetus transmission to newborn infants[D]. Hefei: Anhui Medical University, 2014. |
| [10] |
冯珍珍.乙肝病毒复制水平、基因变异与母婴传播宫内感染关系的研究[D].石家庄: 河北医科大学, 2015. Feng ZZ. The relationship between the level of HBV replication, gene variation and mother-to-child transmission intrauterine infection[D]. Shijiazhuang: Hebei Medical University, 2015. |
| [11] |
Manzini P, Girotto M, Borsotti R, et al. Italian blood donors with anti-HBc and occult hepatitis B virus infection[J]. Haematologica, 2007, 92(12): 1664-1670. DOI:10.3324/haematol.11224 |
| [12] |
Brojer E, Grabarczyk P, Liszewski G, et al. Characterization of HBV DNA+/HBsAg- blood donors in Poland identified by triplex NAT[J]. Hepatology, 2006, 44(6): 1666-1674. DOI:10.1002/hep.21413 |
| [13] |
González R, Torres P, Castro E, et al. Efficacy of hepatitis B virus(HBV) DNA screening and characterization of acute and occult HBV infections among blood donors from Madrid, Spain[J]. Transfusion, 2010, 50(1): 221-230. DOI:10.1111/j.1537-2995.2009.02343.x |
| [14] |
Katsoulidou A, Paraskevis D, Magiorkinis E, et al. Molecular characterization of occult hepatitis B cases in Greek blood donors[J]. J Med Virol, 2009, 81(5): 815-825. DOI:10.1002/jmv.21499 |
| [15] |
叶贤林, 杜鹏, 冯旭, 等. 深圳市18~25岁抗-HBc阳性合格献血者隐匿性乙肝病毒感染的血清学和分子生物学特性分析[J]. 中国输血杂志, 2014, 27(11): 1112-1116. Ye XL, Du P, Feng X, et al. Serological and molecular characterization of occult hepatitis B virus infection in anti-HBc positive healthy blood donors in Shenzhen[J]. Chin J Blood Transfus, 2014, 27(11): 1112-1116. DOI:10.13303/j.cjbt.issn.1004-549x.2014.11.010 |
| [16] |
叶贤林, 李彤, 孙淑君, 等. 核心抗体阳性合格献血者隐匿性乙肝病毒感染分子生物学特性及追踪结果的研究[J]. 中国输血杂志, 2016, 29(9): 890-894. Ye XL, Li T, Sun SJ, et al. Characterization and follow-up study of occult hepatitis B viral Infection in anti-HBc positive qualified blood donors[J]. Chin J Blood Transfus, 2016, 29(9): 890-894. DOI:10.13303/j.cjbt.issn.1004-549x.2016.09.005 |
| [17] |
Shao ZJ, Zhang L, Xu JQ, et al. Mother-to-infant transmission of hepatitis B virus:a Chinese experience[J]. J Med Virol, 2011, 83(5): 791-795. DOI:10.1002/jmv.22043 |
| [18] |
Chen LZ, Zhou WQ, Zhao SS, et al. A nested case-control study of maternal-neonatal transmission of hepatitis B virus in a Chinese population[J]. World J Gastroenterol, 2011, 17(31): 3640-3644. DOI:10.3748/wjg.v17.i31.3640 |
| [19] |
万志华.乙型肝炎病毒宫内感染的遗传易感性研究[D].武汉: 华中科技大学, 2017. Wan ZH. Study on genetic susceptibility to intrauterine infection of hepatitis B virus[D]. Wuhan: Huazhong University of Science and Technology, 2017. |
| [20] |
Su HX, Zhang YH, Xu DZ, et al. Occult hepatitis B virus infection in anti-HBs-positive infants born to HBsAg-positive mothers in China[J]. PLoS One, 2013, 8(8): e70768. DOI:10.1371/journal.pone.0070768 |
| [21] |
Su HX, Shao ZJ, Pu ZS, et al. Overt and occult hepatitis B virus infection among community children in Northwest China[J]. J Viral Hepat, 2017, 24(9): 797-803. DOI:10.1111/jvh.12709 |
| [22] |
Stramer SL, Townsend RL, Foster GA, et al. C-4 The role of hepatitis B virus surface proteins in immune protection and escape-Occult hepatitis B virus infections in vaccinated and non- vaccinated blood donors[J]. J Clin Virol, 2009, 46(Suppl 1): S1-2. DOI:10.1016/S1386-6532(09)70022-8 |
 2019, Vol. 40
2019, Vol. 40