文章信息
- 余绍静, 彭威军, 张恒, 陈献振, 魏木红, 严薇荣.
- Yu Shaojing, Peng Weijun, Zhang Heng, Chen Xianzhen, Wei Muhong, Yan Weirong.
- 母亲、子代血管紧张素原基因单核苷酸多态性与先兆子痫/子痫的关联研究
- Association between both maternal and fetal angiotensinogen gene single nucleotide polymorphism and preeclampsia/eclampsia
- 中华流行病学杂志, 2019, 40(8): 997-1002
- Chinese Journal of Epidemiology, 2019, 40(8): 997-1002
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.08.023
-
文章历史
收稿日期: 2019-01-07
先兆子痫以高血压和蛋白尿为特征,全球发病率为3%~5%[1],我国先兆子痫发病率约为2.9%[2]。子痫是在先兆子痫基础上发生的不能用其他原因解释的抽搐,是先兆子痫的一种严重并发症,在一些低收入国家,其死亡率达到了15%[3]。肾素-血管紧张素系统(renin-angiotensin system,RAS)在调节血压和水盐平衡中发挥着重要作用,并且有研究报告显示,在妊娠早期,RAS所有成分在孕产妇的子宫螺旋动脉内外均有分布,可能参与了妊娠期间的血管重塑[4-5]。RAS通过一系列链式反应将血管紧张素原(angiotensinogen,AGT)转化为血管紧张素Ⅱ(angiotensinⅡ,ANG Ⅱ),再与相应的受体结合从而介导血管的舒张和收缩功能[6]。AGT作为此链式反应的底物,其浓度变化直接影响了整个过程的转化速度,它与先兆子痫/子痫的关联也已在一些研究中报道[7-8]。RAS的所有成分在母体子宫蜕膜和新生儿胎盘组织中均有表达,并且已有研究报道显示,母子基因效应均与先兆子痫/子痫的发生有关[9-10]。本研究采用病例-父母/对照-母亲混合研究设计探究母亲、子代AGT单核苷酸多态性(SNP)与先兆子痫/子痫的关联,为先兆子痫/子痫的发病原因提供一定依据,从而指导先兆子痫/子痫的早期筛查和预防,降低其发病率和死亡率。
对象与方法1.研究对象:2008年1月至2015年10月,收集在湖北省宜昌市妇幼保健院及河南省安阳市妇幼保健院住院分娩的孕产妇及其配偶、新生儿,包括病例-父母三元组和对照-母亲二元组。先兆子痫的诊断标准[11]:妊娠20周后出现血压≥140 mmHg(1 mmHg=0.133 kPa)/90 mmHg,尿蛋白≥0.3 g/24 h或随机尿蛋白(+)。子痫定义为在先兆子痫的基础上发生的不能用其他原因解释的抽搐。满足诊断标准的孕产妇及其配偶、新生儿被纳入病例组,同期同院分娩的正常孕产妇及其新生儿被纳入对照组。同时要求纳入的孕产妇为单胎妊娠,无高血压、糖尿病、肾病、心血管疾病及其他妊娠合并症,且分娩新生儿无先天性畸形或其他严重疾病。最后,347组病例和700组对照被纳入此研究。
2.研究方法:通过问卷调查收集研究对象的相关人口学特征,由受过专业培训的调查员对孕产妇进行访谈式问卷调查。调查孕妇年龄、文化程度、血压、BMI、高血压家族史、孕期压力、新生儿出生体重及怀孕期间丈夫是否吸烟等。相关医护人员采用EDTA二钠抗凝管分别采集病例组孕妇、配偶的外周静脉血及其新生儿的脐静脉血和对照组孕妇的外周静脉血及新生儿的脐静脉血各5 ml。然后以3 000 rpm(有效离心半径为8 cm)的转速离心3 min分离血清,血清与血细胞均储存于-80 ℃冰箱中备用。本研究通过华中科技大学的伦理审查委员会审查,研究对象在接受调查前均签署知情同意书。
3. SNP位点的选择:从HapMap网站(http://hapmap.ncbi.nlm.nih.gov/)检索到的所有AGT SNP导入到Haploview软件中。按照最小等位基因频率(minor allele frequency,MAF)>0.2的标准,筛选出了25个符合条件的SNP。根据各位点之间的连锁不平衡的指数r2>0.8,将25个SNP分为5个高度连锁组。结合文献证据,从5个连锁组中选取5个标签SNP:rs5051、rs2004776、rs2478545、rs2493132、rs3789679。
4.实验室检测:采用全血基因组DNA提取试剂盒(百泰克生物技术有限公司)提取血样DNA,采用NanoDrop2000紫外分光光度计测定DNA的浓度和纯度,质量合格的DNA(浓度≥25 ng/μl,纯度:A260/A280≥1.8)保存于-80 ℃冰箱中备用。基因分型检测采用TaqMan探针法,DNA首先在高速基因扩增仪(PCR9700)中进行目的基因片段的扩增,PCR扩增反应体系总体积5 μl:DNA样本1 μl,无酶水1.375 μl,PCR mix(2×) 2.5 μl,探针和引物混合物(40×) 0.125 μl,所有试剂均购自美国ABI公司(探针及引物货号:PN4351376)。PCR扩增条件:95 ℃预变性10 min;92 ℃变性15 s,60 ℃退火,延伸60 s,50个循环;4 ℃保存。扩增完成后将其放入7900荧光定量PCR仪中,根据荧光信号的强度进行基因分型。
5.统计学分析:采用病例-父母/对照-母亲混合研究设计的数据,采用对数线性建模的方法同时探究母亲、子代AGT各SNP与先兆子痫/子痫的关联[12]。应用最大期望法将对照组数据整合至对数线性模型中,然后采用极大似然法迭代拟合实际频数与理论频数构建模型:
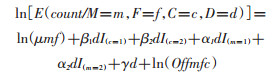 (1)
(1)
对模型(1)进行衍变,基于病例-父母的设计方法研究母、子基因交互作用对母亲先兆子痫/子痫发病的影响,模型[13]:
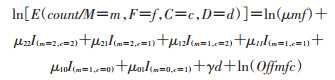 (2)
(2)
μmf为婚配类型参数。当括号里的条件满足时I()取值为1,不满足时为0。D表示疾病水平,d为1表示病例,为0表示对照。exp(α1)、exp(α2)、exp(β1)及exp(β2)分别为母亲、子代携带1个或2个易感等位基因时相对于不携带该等位基因时患所研究疾病的相对危险度。μ22、μ21、μ12、μ11、μ10、μ01为母亲、新生儿不同基因型组合相对于母体、新生儿均为μ00时患所研究疾病的相对危险度。γ用来调整拟合模型。Offmfc表示孟德尔遗传概率。以上计算在The Log- linear Expectation Maximization(LEM)软件中实现。
问卷数据经EpiData软件录入后汇总,采用Excel和SPSS 21软件整理和分析数据。计量资料组间比较采用t检验,计数资料用χ2检验,运用非条件logistic回归的方法分析母亲、子代AGT各SNP在显性/隐性遗传模型下与先兆子痫/子痫的关联。采用错误发现率法(false discovery rate,FDR)对统计结果进行多重检验校正[14]。以P<0.05为差异有统计学意义。
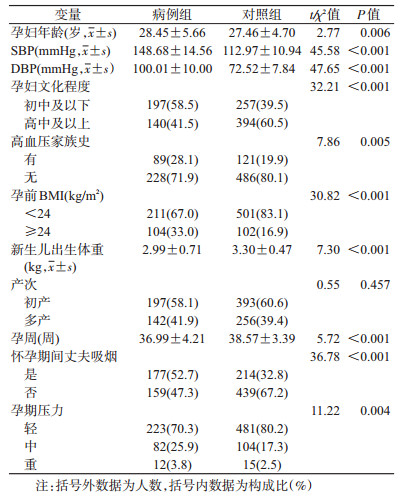
结果1.一般情况:与对照组相比,病例组孕妇的年龄较大、整体文化程度较低、孕前BMI较高、孕期压力较大,差异均有统计学意义(均P<0.05)。先兆子痫/子痫组孕妇中有高血压家族史的比例(28.1%)高于对照组(19.9%)、怀孕期间丈夫吸烟的比例(52.7%)高于对照组(32.8%),差异均有统计学意义(均P<0.05)。见表 1。
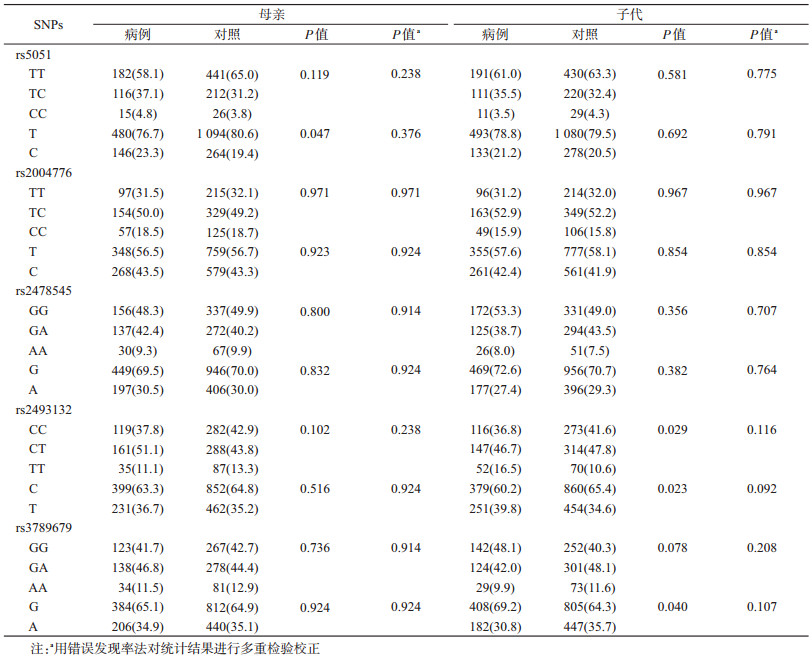
2.母亲、子代AGT各SNP基因型及等位基因的分布:所有位点都服从Hardy-Weinberg遗传平衡。母亲rs5051的2种等位基因T和C在病例组和对照组中的分布差异有统计学意义(P=0.047)。子代中,rs2493132的3种基因型和2种等位基因及rs3789679的2种等位基因在病例组和对照组中的分布差异有统计学意义(P<0.05)。但经多重检验校正后,并未发现AGT各SNP位点母亲、子代的基因型、等位基因频率在病例及对照中的分布差异有统计学意义(均P>0.05)。见表 2。
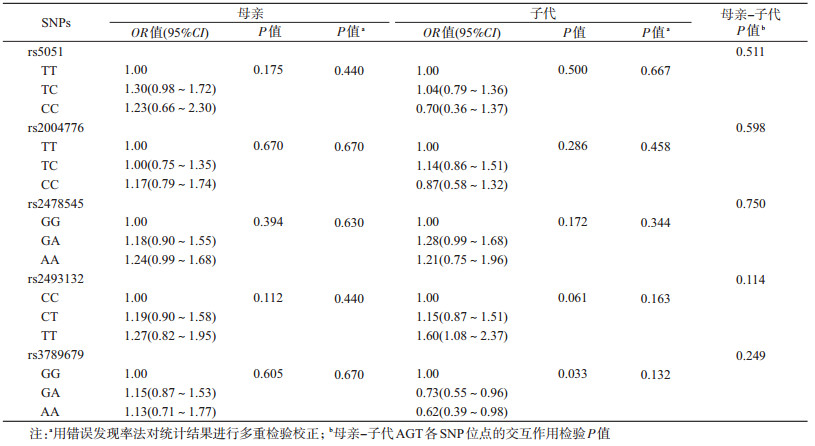
3.母亲、子代AGT各SNP位点及两者的交互作用与先兆子痫/子痫的关联性分析:采用对数线性模型,分别利用病例-父母/对照-母亲混合设计及病例-父母设计的数据,研究母亲、子代AGT各SNP位点及两者的交互作用与先兆子痫/子痫的关联。对于rs2493132,当子代基因型为TT时,其母亲发生先兆子痫/子痫的风险相对于子代基因型为CC的母亲升高(OR=1.60,95%CI:1.08~2.37)。对于rs3789679,当子代基因型为GA或AA时,其母亲发生先兆子痫/子痫的风险相对于子代基因型为GG的母亲降低(OR=0.73,95%CI:0.55~0.96;OR=0.62,95%CI:0.39~0.98)。但经多重检验校正后没有发现母亲、子代AGT各SNP位点与先兆子痫/子痫的关联。另外,在本研究中并未发现母亲-子代基因交互作用对疾病有影响。见表 3。
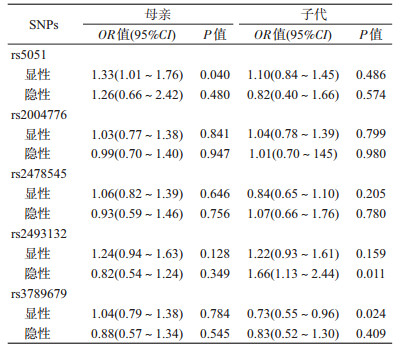
4.显性/隐性遗传模型下母亲、子代AGT各SNP位点与先兆子痫/子痫关联性分析:母亲rs5051在显性模型下(OR=1.33,95%CI:1.01~1.76)、子代rs2493132在隐性模型下(OR=1.66,95%CI:1.13~2.44)增加了孕妇发生先兆子痫/子痫的风险,而子代rs3789679在显性模型下(OR=0.73,95%CI:0.55~0.96)降低了其母亲发生先兆子痫/子痫的风险。见表 4。
本研究运用对数线性模型对病例-父母/对照-母亲混合设计的数据进行分析,以探究母亲、子代AGT各SNP位点基因型与先兆子痫/子痫的关联性。结果显示,在对数线性模型分析中,当子代rs3789679基因型为GA和AA时,其母亲发生先兆子痫/子痫的风险降低,但经多重检验校正后此关联消失。在遗传模型分析中,子代rs3789679在显性模型(AA+GA/GG)下降低了其母亲发生先兆子痫/子痫的风险。1项来自欧洲基因组-表型档案的荟萃分析(纳入了3项欧洲全基因组关联性分析,共有2 858名病例和308 267名对照)并未发现子代rs3789679基因型与母亲先兆子痫/子痫有关[15]。上述荟萃分析所纳入的研究对象均来自欧洲地区,有研究发现,遗传因素、社会经济地位等人口学特征以及环境暴露均可对疾病的发生产生影响[16],这些因素可能导致其结果与本研究不一致。另外,研究设计不同也是一个重要影响因素,上述研究均是病例对照设计,而本研究为病例-父母/对照-母亲混合设计,其优势性表现为能同时探讨母亲、子代基因效应与先兆子痫/子痫的关联,并且由于对照母亲、子代的纳入,可以避免人群分层带来的偏倚,有更高的研究效力[17]。先兆子痫以高血压和蛋白尿为特征,并且有研究发现,先兆子痫/子痫和高血压病、心血管疾病拥有相同的危险因素,如代谢异常、炎症反应、氧化应激等[18-19]。同时,rs3789679与高血压及心血管疾病之间的关系也在2015年1项以云南省哈尼族为研究对象的报道中被部分证实[20]。
子代rs2493132的T等位基因在病例组中的比例高于对照组,在对数线性模型分析中发现,与子代rs2493132 CC基因型相比,TT基因型增加了其母亲发生先兆子痫/子痫的风险,此关联经多重检验校正后消失。但在遗传模型的分析中,子代rs2493132在隐性模型(TT/TC+CC)下增加了母亲发生先兆子痫/子痫的风险,提示T等位基因可能是先兆子痫/子痫的隐性致病基因,但还需进一步研究验证。来自欧洲地区的荟萃分析也研究了子代rs2493132与先兆子痫/子痫的相关性,但未发现二者有关联[15]。来自墨西哥和中国的研究均提示rs2493132与高血压的发病风险相关[21-22],但其研究发现rs2493132的TT基因型相比于TC+CC降低了人群发生高血压的风险。因此,关于rs2493132与先兆子痫/子痫的关联还需更多研究对其进行验证。
对于rs5051,在对数线性模型分析中未发现其与先兆子痫/子痫的关联性,但在遗传模型的分析中,母亲rs5051在显性模型(CC+TC/TT)下显示出增加了其发生先兆子痫/子痫的风险。目前关于rs5051与先兆子痫的关联性研究较少,1项来自德国的病例对照设计及上述来自欧洲地区的荟萃分析未发现母亲或者子代rs5051与先兆子痫/子痫的关联[15, 23]。其结果与本研究不一致,除上述提到的人口学特征、环境暴露及研究设计的差异外,rs5051在不同种族中的分布差异也可能对结果产生影响。研究发现,rs5051在白种人及亚裔日本人中与高血压有关[24],而在非裔美国人中未发现其与高血压的关联性[25]。在中国彝族及汉族人群中rs5051与高血压没有关联性,但在藏族女性中rs5051的C等位基因增加了高血压的风险[26]。以上证据提示rs5051与高血压的关联具有种族差异性。目前,虽然没有足够的证据支持rs5051与先兆子痫/子痫的关联具有种族差异性,但有研究表明,高血压与先兆子痫/子痫具有遗传关联性[27-28]。因此,我们推测rs5051与先兆子痫/子痫的关联也可能存在种族差异性。另外,在本研究中并未发现母亲-子代AGT基因的交互作用与先兆子痫/子痫的关联性,尚待更多研究对此发现进行探讨和验证。
本研究使用了病例-父母/对照-母亲混合设计,此种设计结合了病例-父母对照研究和传统病例对照研究的优点,可以避免由人群分层带来的偏倚,其研究效力也更高[17]。其次,本研究利用对数线性模型同时研究了母亲和子代的基因效应,这与其他学者提出的先兆子痫/子痫受母、子基因共同影响的假说吻合[9-10]。本研究主要的局限性在于未能进行功能学机制的探讨,无法从分子学机制上来解释相应的基因型效应与疾病的关联。另外,研究对象主要来自中国的中部地区,并且都是汉族人群,因此使本研究结果的外推性受到一定限制。
综上所述,本研究发现,在显性遗传模型下,子代rs3789679 GA和AA基因型降低了其母亲发生先兆子痫/子痫的风险,母亲rs5051 TC和CC基因型增加了孕妇发生先兆子痫/子痫的风险。在隐性遗传模型下,子代rs2493132 TT基因型增加了其母亲发生疾病的风险。但这种关联还应在不同人群中进行验证,也应进一步开展功能性实验探寻其背后的机制。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Mol BWJ, Roberts CT, Thangaratinam S, et al. Pre-eclampsia[J]. Lancet, 2016, 387(10022): 999-1011. DOI:10.1016/s0140-6736(15)00070-7 |
| [2] |
Ye C, Ruan Y, Zou LY, et al. The 2011 survey on hypertensive disorders of pregnancy (HDP) in China:prevalence, risk factors, complications, pregnancy and perinatal outcomes[J]. PLoS One, 2014, 9(6): e100180. DOI:10.1371/journal.pone.0100180 |
| [3] |
Ghulmiyyah L, Sibai B. Maternal mortality from preeclampsia/eclampsia[J]. Semin Perinatol, 2012, 36(1): 56-59. DOI:10.1053/j.semperi.2011.09.011 |
| [4] |
van Thiel BS, van der Pluijm I, Te Riet L, et al. The renin- angiotensin system and its involvement in vascular disease[J]. Eur J Pharmacol, 2015, 763: 3-14. DOI:10.1016/j.ejphar.2015.03.090 |
| [5] |
Leung PS, Tsai SJ, Wallukat G, et al. The upregulation of angiotensinⅡreceptor AT1 in human preeclamptic placenta[J]. Mol Cell Endocrinol, 2001, 184(1/2): 95-102. DOI:0.1016/S0303-7207(01)00637-2 |
| [6] |
Shah DM. Role of the renin-angiotensin system in the pathogenesis of preeclampsia[J]. Am J Physiol Renal Physiol, 2005, 288(4): F614-625. DOI:10.1152/ajprenal.00410.2003 |
| [7] |
Le TH, Coffman TM. Targeting genes in the renin-angiotensin system[J]. Curr Opin Nephrol Hypertens, 2008, 17(1): 57-63. DOI:10.1097/MNH.0b013e3282f2fd39 |
| [8] |
Li X, Tan HZ, Zhou SJ, et al. Renin-angiotensin-aldosterone system gene polymorphisms in gestational hypertension and preeclampsia:a case-control gene-association study[J]. Sci Rep, 2016, 6: 38030. DOI:10.1038/srep38030 |
| [9] |
Cnattingius S, Reilly M, Pawitan Y, et al. Maternal and fetal genetic factors account for most of familial aggregation of preeclampsia:a population-based Swedish cohort study[J]. Am J Med Genet A, 2004, 130A(4): 365-371. DOI:10.1002/ajmg.a.30257 |
| [10] |
Morgan L, Crawshaw S, Baker PN, et al. Distortion of maternal- fetal angiotensin Ⅱ type Ⅰ receptor allele transmission in pre- eclampsia[J]. J Med Genet, 1998, 35: 632-636. DOI:10.1136/jmg.35.8.632 |
| [11] |
乐杰. 妇产科学[M]. 7版. 北京: 人民卫生出版社, 2008. Le J. Obstetrics and Gynaecology[M]. 7th ed. Beijing: People's Health Publishing House, 2008. |
| [12] |
Vermeulen SH, Shi M, Weinberg CR, et al. A hybrid design:case-parent triads supplemented by control-mother dyads[J]. Genet Epidemiol, 2009, 33(2): 136-144. DOI:10.1002/gepi.20365 |
| [13] |
朱明, 聂绍发, 严薇荣. 对数线性模型在病例-父母对照研究中的应用[J]. 中华流行病学杂志, 2012, 33(4): 435-438. Zhu M, Nie SF, Yan WR. Application of log-linear model in the case-parent triad study[J]. Chin J Epidemiol, 2012, 33(4): 435-438. |
| [14] |
Benjamini Y, Drai D, Elmer G, et al. Controlling the false discovery rate in behavior genetics research[J]. Behav Brain Res, 2001, 125(1/2): 279-284. DOI:10.1016/S0166-4328(01)00297-2 |
| [15] |
European Genome-phenome Archive[EB/OL]. [2018-12-18]. https://ega-archive.org/studies/EGAS00001001048.
|
| [16] |
Shah DA, Khalil RA. Bioactive factors in uteroplacental and systemic circulation link placental ischemia to generalized vascular dysfunction in hypertensive pregnancy and preeclampsia[J]. Biochem Pharmacol, 2015, 95(4): 211-226. DOI:10.1016/j.bcp.2015.04.012 |
| [17] |
Weinberg CR, Umbach DM. A hybrid design for studying genetic influences on risk of diseases with onset early in life[J]. Am J Hum Genet, 2005, 77(4): 627-636. DOI:10.1086/496900 |
| [18] |
Ghossein-Doha C, Peeters L, va Heijstern S, et al. Hypertension after preeclampsia is preceded by changes in cardiac structure and function[J]. Hypertension, 2013, 62(2): 382-390. DOI:10.1161/hypertensionaha.113.01319 |
| [19] |
Garovic VD, Hayman SR. Hypertension in pregnancy:an emerging risk factor for cardiovascular disease[J]. Nat Clin Pract Nephrol, 2007, 3(11): 613-622. DOI:10.1038/ncpneph0623 |
| [20] |
Li Q, Sun LJ, Du J, et al. Risk given by AGT polymorphisms in inducing susceptibility to essential hypertension among isolated populations from a remote region of China:a case-control study among the isolated populations[J]. J Renin Angiotensin Aldosterone Syst, 2015, 16(4): 1202-1217. DOI:10.1177/1470320315606315 |
| [21] |
Balam-Ortiz E, Esquivel-Villarreal A, Huerta-Hernandez D, et al. Hypercontrols in genotype-phenotype analysis reveal ancestral haplotypes associated with essential hypertension[J]. Hypertension, 2012, 59(4): 847-853. DOI:10.1161/hypertensionaha.111.176453 |
| [22] |
Ji LD, Cai XB, Zhang LN, et al. Association between polymorphisms in the renin-angiotensin-aldosterone system genes and essential hypertension in the Han Chinese population[J]. PLoS One, 2013, 8(8): e72701. DOI:10.1371/journal.pone.0072701 |
| [23] |
Knyrim E, Muetze S, Eggermann T, et al. Genetic analysis of the angiotensinogen gene in pre-eclampsia:study of German women and review of the literature[J]. Gynecol Obstet Invest, 2008, 66(3): 203-208. DOI:10.1159/000146084 |
| [24] |
Jeunemaitre X, Inoue I, Williams C, et al. Haplotypes of angiotensinogen in essential hypertension[J]. Am J Hum Genet, 1997, 60(6): 1448-1460. DOI:10.1086/515452 |
| [25] |
Larson N, Hutchinson R, Boerwinkle E. Lack of association of 3 functional gene variants with hypertension in African Americans[J]. Hypertension, 2000, 35(6): 1297-1300. DOI:10.1161/01.HYP.35.6.1297 |
| [26] |
Liu YW, Qin WJ, Hou SQ, et al. A-6G variant of the angiotensinogen gene and essential hypertension in Han, Tibetan, and Yi populations[J]. Hypertens Res, 2001, 24(2): 159-163. DOI:10.1291/hypres.24.159 |
| [27] |
Ward K, Hata A, Jeunemaitre X, et al. A molecular variant of angiotensinogen associated with preeclampsia[J]. Nat Genet, 1993, 4(1): 59-61. DOI:10.1038/ng0593-59 |
| [28] |
Walker JJ. Pre-eclampsia[J]. Lancet, 2000, 356(9237): 1260-1265. DOI:10.1016/S0140-6736(00)02800-2 |
 2019, Vol. 40
2019, Vol. 40