文章信息
- 陈青, 林李嵩, 陈林, 林菁, 丁言, 包晓丹, 伍俊锋, 林亮坤, 鄢灵君, 王瑞, 施斌, 邱宇, 郑晓燕, 潘丽珍, 陈法, 汪靖, 蔡琳, 何保昌, 刘凤琼.
- Chen Qing, Lin Lisong, Chen Lin, Lin Jing, Ding Yan, Bao Xiaodan, Wu Junfeng, Lin Liangkun, Yan Lingjun, Wang Rui, Shi Bin, Qiu Yu, Zheng Xiaoyan, Pan Lizhen, Chen Fa, Wang Jing, Cai Lin, He Baochang, Liu Fengqiong.
- 硒元素与口腔癌发病关联的病例对照研究
- Relationship between selenium and the risk for oral cancer:a case-control study
- 中华流行病学杂志, 2019, 40(7): 810-814
- Chinese journal of Epidemiology, 2019, 40(7): 810-814
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.07.015
-
文章历史
收稿日期: 2018-12-02
2. 福建医科大学附属第一医院口腔颌面外科, 福州 350004
2. Department of Stomatology, The First Affiliated Hospital of Fujian Medical University, Fuzhou 350005, China
口腔癌是指发生于口腔颌面部的恶性肿瘤,超过90%的病理类型属于口腔鳞状细胞癌。全世界每年的新发口腔癌病例约35万例,死亡病例约17万例,分别占全世界新发和死亡病例的2.0%和1.9%[1]。硒是人体必需的微量元素之一,在机体内具有重要的生物学功能,如提高机体的抗氧化能力和具有抗炎作用等[2-4]。现有研究表明,血浆硒水平与前列腺癌的全因死亡率、乳腺癌的死亡风险预测以及喉癌患者的预后改善有关[5-7]。近年来已有流行病学研究探讨了硒元素与口腔癌的关系,但结果尚存在争议。其中一些研究认为硒元素可降低口腔癌的发病风险[8],但也有研究显示硒元素与口腔癌的发病并未存在关联[9]。此外,吸烟、饮酒、摄入水果和鱼类已经被证实与口腔癌的发病有关[10],在研究血清硒与口腔癌的关系时,这些因素是否存在混杂作用有待研究。为此在福建地区开展病例对照研究,采用分层分析和交互作用分析,探讨硒元素与口腔癌发病的关联,为口腔癌的预防提供科学依据。
对象与方法1.调查对象:2010年9月至2018年1月在福建医科大学附属第一医院口腔颌面外科确诊的口腔癌新发患者325例。病例的纳入标准:①经手术取得组织标本,经病理或细胞学检查确诊;②原发性口腔癌的新发病例(采血前未经过放化疗治疗);③病例的性别、年龄和组织病理学分型及分期无任何限制;④在福建省居住>10年。病例的排除标准:经病理或细胞学确诊为口腔炎症、良性病变、继发肿瘤及病情危重不能清晰回答问题者,职业接触重金属的特殊暴露个体。采用频数匹配选取对照,按病例的性别、年龄(±2岁)选取同期前往医院的健康体检人群以及社区健康人群作为对照。对照的纳入标准:①社区健康人群;②同家医院的健康体检人群;③在福建省居住>10年。对照的排除标准:①有肿瘤疾病史;②本研究口腔癌病例组的直系亲属;③职业接触重金属的特殊暴露个体。所有研究对象均为>20岁,能清晰回答问题者。本研究通过福建医科大学伦理委员会批准,所有参加者均签署了知情同意书。
2.调查内容:采用InterCHANGE生活方式调查问卷,该问卷由美国犹他大学和中国医科院肿瘤研究所联合国内著名流行病学专家结合国内实际情况编制而成[11]。根据知情同意的原则,由经过培训的调查员对调查对象进行面访式问卷调查。调查内容包括:研究对象的一般资料、吸烟史、饮酒史、饮茶史、口腔卫生状况、既往疾病史、肿瘤家族史、职业史、居住环境、膳食因素及膳食相关因素。吸烟是指过去吸烟累积达100支[12]。饮酒定义为每周饮酒≥1次,持续半年以上者[13]。肿瘤家族史定义为研究对象的亲生父母或兄弟姐妹中的一个及以上在任何部位发生癌症[14]。
3.硒元素检测:采集病例及对照外周血液标本,于-80 ℃冰箱进行保存。血清硒元素经微波消解后绘制标准曲线,然后用质谱调谐液优化电感耦合等离子体质谱仪(ICP-MS)检测血清中硒元素的含量,最后进行质量控制。
4.质量控制:经由统一培训的调查员,对所有的研究对象进行面访调查。在面访结束后,由调查员对问卷质量进行审核,如发现问题及时予以纠正,并对不合格的问卷进行剔除。
5.统计学方法:采用EpiData 3.1软件建立数据库,进行数据的双核录入及逻辑纠错,并随机抽样10%复查。采用Stata 13.0软件进行统计学分析。采用χ2检验对病例组和对照组的一般人口学特征进行均衡性检验;采用秩和检验,检验病例组及对照组血清硒元素含量分布是否存在差异。采用非条件logistic回归模型,计算生活方式因素和血清硒元素含量与口腔癌发病风险关系的OR值及其95%CI,及经吸烟、饮酒、摄入水果和摄入鱼类分层后,血清硒元素和口腔癌发病风险的aOR值及其95%CI并进行相乘作用分析和交互作用分析。均为双侧检验,以P<0.05为差异有统计学意义。
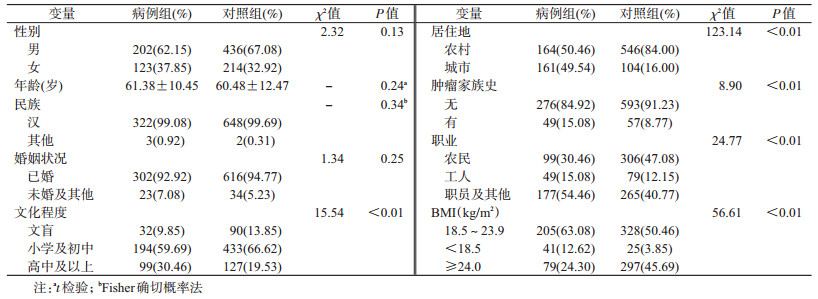
结果1.一般情况:两组经均衡性检验在性别、年龄、民族、婚姻状况差异均无统计学意义(P>0.05),但文化程度、居住地、肿瘤家族史、BMI、职业分布差异有统计学意义(P<0.05)(表 1)。
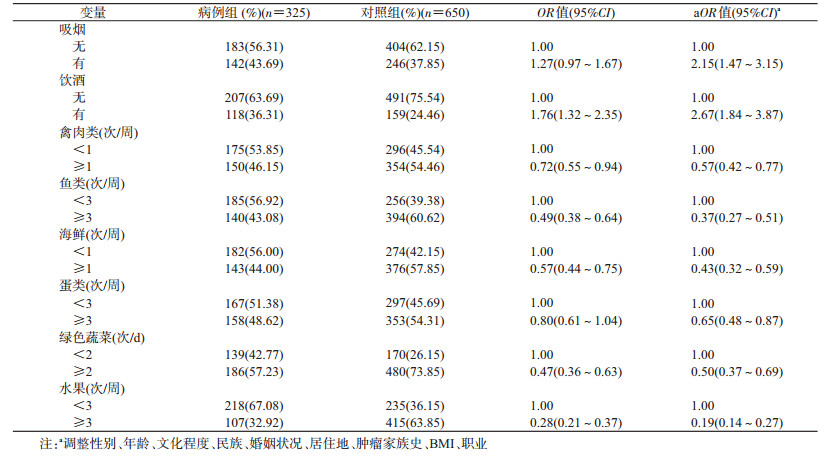
2.生活方式因素与口腔癌发病关联分析:调整性别、年龄、文化程度、民族、婚姻状况、居住地、肿瘤家族史、BMI、职业后,单因素分析结果显示,吸烟、饮酒可增加口腔癌发病风险,摄入禽肉类(≥1次/周)、鱼类(≥3次/周)、海鲜(≥1次/周)、蛋类(≥3次/周)、绿色蔬菜(≥2次/d)、水果(≥3次/周)可降低口腔癌的发病风险(表 2)。
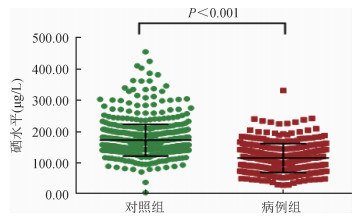
3.两组间血清硒元素含量比较:经正态性检验,血清硒元素水平不符合正态分布,用M(P25~P75)表示。病例组血清硒元素水平[112.42(80.98~145.06)μg/L]低于对照组[164.85(144.44~188.53)μg/L],差异有统计学意义(P<0.01)。病例组和对照组血清硒元素水平比较,病例组明显低于对照组(图 1)。
|
| 图 1 病例组和对照组血清硒水平的比较 |
4.血清硒与口腔癌的logistic回归分析:按对照组血清硒元素的中位数,将血清硒元素分为低水平组(<164.85 μg/L)和高水平组(≥164.85 μg/L),对照组人数均为325人,高水平和低水平组的病例组人数分别为276人和49人。模型1调整了性别、年龄、文化程度、民族、婚姻状况、居住地、肿瘤家族史、BMI、职业,发现血清硒元素水平与口腔癌的发病风险存在负相关,高水平组患口腔癌的风险是低水平组的0.15(95%CI:0.10~0.22)倍;模型2在模型1基础上进一步调整了吸烟、饮酒、摄入家禽、鱼肉、海鲜、蛋类、绿色蔬菜、水果等变量,高水平组的患口腔癌风险是低水平组的0.16(0.11~0.25)倍。
5.分层分析:按是否吸烟、饮酒以及水果和鱼类的摄入频次分别分层,调整混杂因素后,各亚组均发现血清硒元素水平与口腔癌存在负相关,见表 3。
6.交互作用分析:血清硒与吸烟、饮酒、水果和鱼类的摄入频次之间存在相乘交互作用,调整后OR值(95%CI)分别为0.22(0.14~0.34)、0.22(0.14~0.33)、0.13(0.08~0.22)和0.16(0.10~0.25),P值均<0.05(表 4)。
硒是人体必需的微量元素之一,可增强机体的免疫功能[15]、有效清除自由基[16]、还可以提高机体的抗氧化能力[17],从而降低患癌风险。本研究结果显示,病例组血清硒水平[112.42(80.98~145.06)μg/L]低于对照组[164.85(144.44~188.53)μg/L],差异有统计学意义(P<0.001),并且进一步的调整潜在的混杂因素后,血清硒元素与降低口腔癌的发病风险相关,提示血清硒元素对口腔癌发生起保护作用,与Khanna等[8]在口腔癌中的研究结果一致。除了口腔癌之外,在其他肿瘤如胃癌[19]、头颈部肿瘤[9]等的相关研究中,也观察到血清硒元素可降低癌症的发病风险。但也有研究结果显示硒元素与口腔癌没有关联,如Rogers等[20]在美国人群中发现,指甲中的硒元素与口腔癌没有关联,造成不同研究之间结果不一致的可能原因是地区和人群差异,以及硒元素的检测方法不同等。
吸烟、饮酒已经被公认为是口腔癌的危险因素之一。本研究按吸烟状况分层,结果显示,吸烟者中高水平血清硒可降低口腔癌的发病风险。进一步进行交互作用分析发现,血清硒与吸烟存在相乘交互作用(aOR=0.22,95%CI:0.14~0.34)。与低水平血清硒且吸烟者相比,高水平血清硒组中,无论有无吸烟,其对口腔癌的保护作用均大于低水平血清硒组,且差异有统计学意义。本研究交互作用结果还发现,血清硒与饮酒存在相乘交互作用(aOR=0.22,95%CI:0.14~0.33),在高水平血清硒组中,无论有无饮酒,其对口腔癌的保护作用均大于低水平血清硒组。但在高水平血清硒组中,本研究未观察到未吸烟者和吸烟者、未饮酒者和饮酒者之间口腔癌的患病风险差异,可能是硒元素的保护作用太强,以至于掩盖了吸烟、饮酒的作用;也可能因为病例组中高水平硒元素组的例数较少,无法真实反映吸烟、饮酒与高水平硒元素的交互作用。
本研究交互作用分析结果显示,血清硒与摄入鱼类存在相乘交互作用(aOR=0.16,95%CI:0.10~0.26),高水平血清硒且摄入鱼类≥3次/周组的保护作用最强,差异具有统计学意义。一方面,鱼类中含有丰富的ω-3多不饱和脂肪酸,有研究表明,ω-3多不饱和脂肪酸作为一种天然的环氧合酶抑制剂,可通过降低环氧合酶COX-2和PGPGE2的水平从而抑制肿瘤细胞的生长[21]。另一方面,硒元素具有抗氧作用,因此血清硒水平与摄入鱼类在口腔癌发病中存在协同作用。
本研究采用病例对照方法,回忆偏倚难以避免,但本研究所采用的病例是新近被诊断的病例,可减低回忆偏倚的影响。本研究是病例对照研究,很难明确低水平血清硒是口腔癌的病因还是口腔癌产生的结果,仅能提示血清硒元素水平与口腔癌的发病有关联,如要进一步明确二者的因果关系需进行前瞻性研究。此外本研究是在较小规模的人群样本用病例对照的设计方式进行的探索性的检测和分析,后期需扩大样本量及进一步研究(尤其是前瞻性研究)对本研究结果加以验证。
综上所述,口腔癌患者人群中血清硒元素水平显著低于健康对照人群,血清硒元素是口腔癌发病的保护因素,但硒元素的血清水平受日常饮食模式的影响较大,并且有关硒元素与口腔癌关系的作用机制尚不明确,需扩大研究样本或开展前瞻性研究。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA:Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
Gandin V, Khalkar P, Braude J, et al. Organic selenium compounds as potential chemotherapeutic agents for improved cancer treatment[J]. Free Radic Biol Med, 2018, 127: 80-97. DOI:10.1016/j.freeradbiomed.2018.05.001 |
| [3] |
Kiełczykowska M, Kocot J, Paździor M, et al. Selenium-a fascinating antioxidant of protective properties[J]. Adv Clin Exp Med, 2018, 27(2): 245-255. DOI:10.17219/acem/67222 |
| [4] |
Wrobel JK, Power R, Toborek M. Biological activity of selenium:revisited[J]. IUBMB Life, 2016, 68(2): 97-105. DOI:10.1002/iub.1466 |
| [5] |
Outzen M, Tjønneland A, Larsen EH, et al. Selenium status and risk of prostate cancer in a Danish population[J]. Br J Nutr, 2016, 115(Suppl 9): 1669-1677. DOI:10.1017/S0007114516000726 |
| [6] |
Lubiński J, Marciniak W, Muszynska M, et al. Serum selenium levels predict survival after breast cancer[J]. Breast Cancer Res Treat, 2018, 167(2): 591-598. DOI:10.1007/s10549-017-4525-9 |
| [7] |
Lubiński J, Marciniak W, Muszynska M, et al. Serum selenium levels and the risk of progression of laryngeal cancer[J]. PLoS One, 2018, 13(1): e0184873. DOI:10.1371/journal.pone.0184873 |
| [8] |
Khanna S, Udas AC, Kumar GK, et al. Trace elements (copper, zinc, selenium and molybdenum) as markers in oral sub mucous fibrosis and oral squamous cell carcinoma[J]. J Trace Elem Med Biol, 2013, 27(4): 307-311. DOI:10.1016/j.jtemb.2013.04.003 |
| [9] |
Maasland DHE, Schouten LJ, Kremer B, et al. Toenail selenium status and risk of subtypes of head-neck cancer:the Netherlands Cohort Study[J]. Eur J Cancer, 2016, 60: 83-92. DOI:10.1016/j.ejca.2016.03.003 |
| [10] |
Maasland DHE, van den Brandt PA, Kremer B, et al. Alcohol consumption, cigarette smoking and the risk of subtypes of head-neck cancer:results from the Netherlands Cohort Study[J]. BMC Cancer, 2014, 14(1): 187. DOI:10.1186/1471-2407-14-187 |
| [11] |
Radoï L, Paget-Bailly S, Menvielle G, et al. Tea and coffee consumption and risk of oral cavity cancer:results of a large population-based case-control study, the ICARE study[J]. Cancer Epidemiol, 2013, 37(3): 284-289. DOI:10.1016/j.canep.2013.02.001 |
| [12] |
杨功焕, 马杰民, 刘娜, 等. 中国人群2002年吸烟和被动吸烟的现状调查[J]. 中华流行病学杂志, 2005, 26(2): 77-83. Yang GH, Ma JM, Liu N, et al. Smoking and passive smoking in Chinese, 2002[J]. Chin J Epidemiol, 2005, 26(2): 77-83. DOI:10.3760/j.issn:0254-6450.2005.02.001 |
| [13] |
张林峰, 赵连成, 周北凡, 等. 男性饮酒与缺血性脑卒中发病关系的研究[J]. 中华流行病学杂志, 2004, 25(11): 954-957. Zhang LF, Zhao LC, Zhou BF, et al. Alcohol consumption and incidence of ischemic stroke in male Chinese[J]. Chin J Epidemiol, 2004, 25(11): 954-957. DOI:10.3760/j.issn:0254-6450.2004.11.009 |
| [14] |
Yan LJ, Chen F, He BC, et al. A novel environmental exposure index and its interaction with familial susceptibility on oral cancer in non-smokers and non-drinkers:a case-control study[J]. Eur Arch Oto-Rhino-Laryngol, 2017, 274(4): 1945-1950. DOI:10.1007/s00405-016-4427-1 |
| [15] |
Hosnedlova B, Kepinska M, Skalickova S, et al. A summary of new findings on the biological effects of selenium in selected animal species-a critical review[J]. Int J Mol Sci, 2017, 18(10): 2209. DOI:10.3390/ijms18102209 |
| [16] |
Zimmerman MT, Bayse CA, Ramoutar RR, et al. Sulfur and selenium antioxidants:challenging radical scavenging mechanisms and developing structure-activity relationships based on metal binding[J]. J Inorg Biochem, 2015, 145: 30-40. DOI:10.1016/j.jinorgbio.2014.12.020 |
| [17] |
Bai K, Hong B, He J, et al. Preparation and antioxidant properties of selenium nanoparticles-loaded chitosan microspheres[J]. Int J Nanomed, 2017, 12: 4527-4539. DOI:10.2147/IJN.S129958 |
| [18] |
Jaworska K, Gupta S, Durda K, et al. Selenium and the risk of cancer of the lung and larynx. A case-control study from a region with low selenium[J]. Hered Cancer Clin Pract, 2012, 10(Suppl 3): A7. DOI:10.1186/1897-4287-10-S3-A7 |
| [19] |
Mark SD, Qiao YL, Dawsey SM, et al. Prospective study of serum selenium levels and incident esophageal and gastric cancers[J]. J Natl Cancer Inst, 2000, 92(21): 1753-1763. DOI:10.1093/jnci/92.21.1753 |
| [20] |
Rogers MAM, Thomas DB, Davis S, et al. A case-control study of oral cancer and pre-diagnostic concentrations of selenium and zinc in nail tissue[J]. Int J Cancer, 1991, 48(2): 182-188. DOI:10.1002/ijc.2910480205 |
| [21] |
Kobayashi N, Barnard RJ, Henning SM, et al. Effect of altering dietary ω-6/ω-3 fatty acid ratios on prostate cancer membrane composition, cyclooxygenase-2, and prostaglandin E2[J]. Clin Cancer Res, 2006, 12(15): 4662-4670. DOI:10.1158/1078-0432.CCR-06-0459 |
 2019, Vol. 40
2019, Vol. 40