文章信息
- 唐林, 孙坤, 陈方方, 李东民.
- Tang Lin, Sun Kun, Chen Fangfang, Li Dongmin.
- 艾滋病疫情估计与预测方法研究进展
- Progress on estimation and projection of HIV epidemics
- 中华流行病学杂志, 2019, 40(6): 731-738
- Chinese Journal of Epidemiology, 2019, 40(6): 731-738
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.06.024
-
文章历史
收稿日期: 2018-12-26
由于艾滋病相关高危人群的隐匿性、疾病潜伏期长以及检测覆盖面等因素的影响[1-2],仅靠病例报告等监测数据难以全面反映艾滋病疫情的真实情况;同时,为实现2020年“三个90%”的艾滋病防治目标,需要及时、准确地估计艾滋病疫情流行情况,以便更好地评估艾滋病防治效果和合理分配卫生资源[3-4]。本研究对不同的艾滋病疫情估计与预测方法从原理、适用条件、应用、优点及局限性等进行综述,为今后艾滋病疫情估计工作提供参考。
一、数理模型/方法在疫情估计与预测中的应用1. 自回归移动平均模型(ARIMA模型):
(1)基本原理:ARIMA模型是时间序列模型的一种,是Box和Jenkins[5]于1970年代提出的一种时间序列预测方法,其基本思想是将预测对象随时间变化的数据视作一个随机序列,在平稳性的基础上,利用该序列不同时间点之间的相关性建立起数学模型,模型包括自回归(AR)模型、移动平均(MA)模型、季节性自回归移动平均(SARIMA)模型等[6]。
(2)计算公式:表达式为ARIMA (p,d,q)×(P,D,Q)s,模型参数分别为自回归阶数p,趋势差分次数d,移动平均阶数q,季节性自回归阶数P,季节性差分次数D,季节性移动平均阶数Q,季节性移动平均值s[7];ARIMA模型主要包括模型识别、模型估计和模型诊断3个步骤,其首要条件是序列平稳化[8]。
(3)适用条件:①适用于线性、平稳的数据资料;②呈趋势性、季节性、周期性变化特征的急性传染病数据[8];③对于非平稳化、波动性的时间序列资料,经过平稳化处理后亦可进行分析。
(4)应用:Rosel等[9]根据西班牙1984-1996年艾滋病报告数据呈线性趋势,采用ARIMA模型预测1997年及以后艾滋病发病情况,但并未得到HIV新发感染者数;刘英等[10]利用2005-2015年湖南省HIV感染月报告数据拟合ARIMA模型,预测2016-2018年各月HIV感染数呈上升趋势,尽管使用了2015年的报告数去验证模型,但模型预测结果仍是报告数,而非HIV新发感染者数。
(5)优点:①对呈线性趋势、周期性分布特征的传染病拟合效果更好[8];②利用数学函数关系,可减小艾滋病早期监测资料中缺失值的影响[9]。
(6)局限性:①艾滋病监测数据质量的优劣直接影响模型预测结果的准确性[11];②模型设计结构单一,抗病毒治疗等干预措施的介入易造成模型的不稳定[12];③ARIMA模型从数据平稳性假设出发,具有极强的时间序列性,但无季节性发生规律的艾滋病的预测没有其他传染性疾病效果好[13];④ ARIMA模型是利用HIV报告数进行预测,预测结果也为报告数,不能反映实际的HIV新发感染状况。
2. 灰色预测模型(Grey model,GM):
(1)基本原理:GM是基于灰色系统理论,对变量变化趋势进行系统预测的一种数学模型;GM(1,1)是最简单的灰色预测模型,其建模思想是:首先将无规律的原始数据进行累加,生成有规律的数列,在此基础上建立相应的微分方程求解,从而预测疾病未来的发展趋势[14-15]。
(2)计算公式: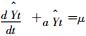
(3)适用条件:①适用于小样本的不确定性问题和无严格概率分布要求的数据[16];②处理不确定、不完整和数据质量较差的信息,这部分信息也可称为贫(灰色)信息,经过模型处理,提高其白化度[14]。
(4)应用:林建潮等[17]基于2004-2014年全国的HIV/AIDS报告数据,利用GM(1,1)预测模型估计我国2015-2017年的艾滋病发病率分别为4.77/10万、6.06/10万和7.71/10万,尽管模型预测结果与实际值之差较为集中,后验差比值较小,但预测结果仍为报告数和报告发病率;刘文东等[16]根据2006-2011年全国HIV/AIDS年报数据,预测2012-2015年全国HIV感染者数分别为81 832、91 576、103 618、117 494例,结果显示未来4年全国HIV感染率呈逐年增长趋势,预测结果与实际的报告数据虽然比较接近,但仍为报告数,同样都不是实际的HIV新发感染者数。
(5)优点:①不需要大量的监测数据,只需要部分信息即可对艾滋病流行趋势进行建模拟合;②对原始数据二次处理,提高数据平滑度减少干扰因素的影响[18]。
(6)局限性:①对于艾滋病动态变化的预测效果较差,只能不断更新参数来提高预测的准确性[16];②艾滋病短期预测效果较好,长期监测资料由于影响因素复杂、波动性大及离散程度较高,预测效果较差[19];③灰色系统模型多是利用HIV报告数进行预测,预测结果也为报告数,不能得到HIV新发感染者数。
3. 改良反向计算法(Modified back-calculation method):
(1)基本原理:反向计算法是艾滋病疫情估计早期常用方法之一,基本原理是利用艾滋病病例报告数和每年HIV感染者发展为艾滋病的概率,反推每年HIV新发感染者数[20];而“改良反向计算法”是在反向计算法的基础上的方法改进,主要是根据CD4+T淋巴细胞计数(CD4)在人体内的消除速度反推感染的时间,以首次诊断检测的CD4为观察终点而非艾滋病感染状态,结合HIV感染到首次CD4检测的时间分布,从而推算各年度HIV新发感染者数、HIV诊断发现比例[21-22]。
(2)计算公式[23]: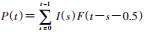
(3)适用条件:须有完善的、准确的HIV/AIDS报告资料和CD4检测数据,并在抗病毒治疗前进行CD4检测[21]。
(4)应用:Fellows等[22]利用西雅图HIV/AIDS报告资料预测当地MSM的HIV新发感染者数为5 863例,推算仍有5.9%HIV感染者尚未被诊断发现;Song等[21]使用改良反向计算法估计2010年美国HIV新发感染者数为43 400例(95%CI:41 800~44 900),相比于之前的估计结果点值略有下降(47 500例,95%CI:42 000~53 000),但此方法以HIV检测后、抗病毒治疗前首次CD4为观察终点,估算精度有所提高。
(5)优点:“改良反向计算法”观察终点由艾滋病的疾病状态向确诊HIV感染后的首次CD4检测状态前移,降低了艾滋病抗病毒治疗对估算结果的影响,使结果估计更准确[21]。
(6)局限性:CD4检测必须是在HIV首次诊断后、未进行抗病毒治疗前完成,因此,缺乏治疗前的CD4检测数据将无法使用该方法。
4. 传染病动力学模型(Dynamic model):
(1)基本原理:根据疾病的发生、发展、传播规律以及环境变化情况等构建能够反映传染病动力学特性的数学模型,并通过模型模拟疾病的传播过程,反映疾病的传播规律和发展趋势[24]。仓室(SIR)模型是最常用的传染病动力学模型之一,主要原理是将研究人群N(t)按疾病状态分为不同的区或仓室,各仓室分别代表着易感者(S)、HIV感染者(I)、移除者或免疫者(R),研究疾病在各个仓室之间的传播率。
(2)计算公式(SIR模型的微分方程):
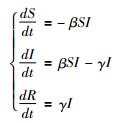
β为传染率系数,γ为移除比例系数,模型主要输出参数是基本再生率R0,R0=βS0/γ,表示在人群普遍易感的疾病流行初期,一个感染者能够感染他人的数量;若R0>1时,则表示疾病处于流行状态,若R0<1时,则表示疾病处于消亡状态[25-26]。
(3)SIR模型成立条件[27]:①研究人群始终保持相对稳定的状态,不考虑人群中出生、死亡或者流动等情况;②具有一定的传染力,感染者一旦与易感者接触,则必然会传染易感者;③单位时间内从感染者中移出的人数(R)与感染者数量(I)成正比,比例系数为γ,即γI(t)。
(4)应用:Luo等[28]通过构建SIR模型探讨提高HIV检测率和抗病毒治疗覆盖率对北京市MSM人群HIV新发感染情况的影响,当HIV检测率和抗病毒治疗覆盖率同时增加至90%时,将有效降低北京市MSM的HIV新发感染者数;徐勇等[29]利用SIR模型估计我国注射吸毒人群年HIV新发感染率自1996年达到峰值(4.06%)后逐年下降,2008年后维持在0.50%~0.90%水平,与Zhang等[30]做的我国1995-2010年注射吸毒人群HIV新发感染率Meta分析结果(0.40%~0.80%)相似。
(5)优点:①模拟艾滋病的传播过程,能直接研究不同状态下的疾病转归情况;②与改良反向计算法相比,传染病动力学模型能够对不完整的疫情监测资料进行估计与拟合[26]。
(6)局限性:①动力学模型参数来自文献资料或先验信息,参数设定具有一定的主观性[29];②传染病动力学模型属于确定性模型中的一种[25],其简化了艾滋病的传播过程,不能完全考虑到影响艾滋病传播的各种社会、经济、文化等因素,故其预测结果仅作为参考[31];③相比于急性传染病而言,传染病动力学模型在艾滋病中的应用要考虑艾滋病具有较长的潜伏期,在此过程中HIV感染者的传播力、CD4水平以及病毒载量各不相同,相应的细化参数尽管可以更好的进行模型估计,但却会增加参数获取的难度。
5. 马尔科夫模型(Markov model):
(1)基本原理:马尔科夫模型是一种基于概率统计的数学模型,主要是通过模拟随机变量在不同时刻所处状态之间的变化规律,利用变量X在t时刻的状态和动向去预测t+1时刻的状态与变化趋势[32];当t时刻,给定Xt值时,Xt+1的概率分布只依赖于Xt的值,而与X1,X2,…,Xt-1的值无关,这种特性称为马尔科夫的无后效性[33]。在疾病发病率或患病率预测方面,马尔科夫模型的建模过程是将所研究的疾病细分为若干状态,并根据不同时间间隔计算各个状态之间的转移频次,以确定概率转移矩阵,从而对矩阵中最大的转移概率做出预测[34]。
(2)适用条件:①具有多阶段多状态过程特点的疾病[35];②具有波动性特征且时间序列较长的传染病资料[32]。
(3)应用:Nunez等[35]利用多状态马尔科夫模型基于不同CD4水平拟合艾滋病的传播过程,估计截至2013年底西班牙存活HIV感染者数为14.1万,其中18%的感染者不知晓自己的感染状态;Palombi等[36]根据2002-2009年的病例报告数据及CD4资料,运用马尔科夫模型模拟撒哈拉以南非洲艾滋病经过抗病毒治疗后2年内,HIV感染率将从7%下降至2%,随后20年内HIV感染率≤1%。
(4)优点:①马尔科夫模型能真实地拟合艾滋病的传播过程,对于呈多状态多阶段特点的艾滋病具有更好的预测效果[35];②通过瞬时转移概率的计算,能更加灵活地处理艾滋病病程中不同CD4状态之间的转移关系[37];③模型对资料要求不高,具有波动性改变的随机过程资料即可[32];④马尔科夫模型利用现有的CD4以及病例报告数据,常与反向计算法[35]、贝叶斯方法结合对艾滋病疫情进行估计[38],具有较为广泛的应用前景。
(5)局限性:①马尔科夫模型对于艾滋病疫情短期预测效果较好,长期预测结果不理想;②艾滋病的发展与既往史有关,模型的无后效性假设对其有一定的限制[33]。
6. 贝叶斯模型(Bayesian model):
(1)基本原理:核心理论是贝叶斯定理,主要是基于总体信息、样本信息和先验信息3种信息进行的统计推断;与经典统计学相比,最大的区别在于贝叶斯统计充分地利用了先验信息,并将未知参数视为一个随机变量而非常数,对于未知参数的估计需要样本信息和经验(先验信息)共同去解释[39]。
(2)计算公式:贝叶斯公式可写成Pr(B|A)=Pr(A和B)/Pr(A),研究的是在结果事件A发生的条件下,原因事件B发生的条件概率。
(3)适用条件:①适用于具有丰富先验信息的未知参数的推断;②也适用于未知参数先验信息不充分的情况下,可采用无信息先验对参数进行推断[39]。
(4)应用:Rosinska 等[40]利用波兰MSM人群的监测数据、诊断检测及行为学调查数据作为先验信息,在贝叶斯框架下估计2009年MSM人群的HIV感染率为2.3%,但是未诊断发现的比例高达68.3%;李爱华等[41]利用2006-2015年德宏傣族景颇族自治州报告HIV感染者数,根据贝叶斯基本理论推算从2008年开始,当地每年HIV新发感染者数呈下降趋势,截至2015年底HIV诊断发现率为87.7%。
(5)优点:①充分利用艾滋病相关的先验信息或经验,提高了信息利用度,使疫情总体推断结果更加准确[42];②贝叶斯统计在其他艾滋病疫情估计模型中参数估计优于经典统计[43]。
(6)局限性:①先验信息的参数多来源于文献或者经验,具有一定的主观性[41];②艾滋病监测数据质量与有效性影响预测的效果[40]。
二、计算机软件估计与预测模型1. 工作簿法(Workbook approach):
(1)基本原理:Workbook法是基于组分法原理,由疫情估计工作簿和流行曲线工作簿两部分构成[44],其中疫情估计是根据各类艾滋病高危人群的规模估计数和HIV感染率的高、低值,两两交叉相乘后得到4个乘积值,求取其均值作为各亚人群的感染者估计数;而对患病率的曲线拟合则是根据连续长期的监测资料,基于简单双logistic模型拟合出疫情的时间变化趋势[45]。
(2)适用条件:适用于艾滋病低流行或聚集性流行的国家或地区,该方法是在Excel工作簿基础上对疫情进行时点估计和短期流行趋势的预测,数据质量越高,其预测效果越好。
(3)应用:vanVeen 等[46]利用Workbook法估计2008年新西兰HIV感染者数为23 969人,相比于Spectrum/估计与预测软件包(Estimation and Projection Package,EPP)估计的HIV感染者19 115例(95%CI:15 902~22 577)点值略有上升,尽管估计范围有所重叠,但精度有所下降;我国在2003-2011年曾使用Workbook法每2年对全国艾滋病疫情进行估计,估计全人群HIV感染率为0.05%~0.058%[47-48]。
(4)优点:①Workbook法依托Excel工作簿进行疫情估计,仅需要高危人群规模估计数和感染率即可进行点值估计,易于在基层推广;②模型能够进行一致性核查,减少错误,进行质量控制[49]。
(5)局限性:①预测结果与人群规模和感染率密切相关,这两类指标直接影响预测质量[49];②覆盖人群不够全面,未考虑15~49岁年龄段之外的人群、母婴传播人群、血液传播人群以及外籍人群等;③高危人群规模估计存在交叉重复的问题;④未能纳入行为学指标以及很难对行为学改变后的流行趋势进行预测[44];⑤输出结果指标较少,可利用的数据较少,只能假设各人群在研究期间是静态的,无法反映人群间的流动特征。
2. 亚洲流行模型(Asian epidemic model,AEM):
(1)基本原理:AEM模型是一种半经验化模型,主要是对HIV感染率进行模型拟合,通过参数调整,得到HIV患病率随时间变化的最佳拟合曲线;模型输入指标为艾滋病行为学指标、流行病学指标和生物学指标,进入模型的是15~49岁年龄组,模型产出指标为按年龄分层的HIV新发感染或累计感染者数、AIDS相关死亡数以及随时间变化的HIV感染率曲线等[50]。
(2)适用条件:AEM模型是针对亚洲国家艾滋病流行特点和传播方式进行的疫情估计模型,适用于具有足够数据的亚洲国家艾滋病疫情的预测与估计,也可预测干预措施实施后艾滋病疫情的发展。
(3)应用:Thisyakorn等[51]利用泰国孕产妇门诊数据预测该人群HIV感染率从1990年代中期的2%下降至2015年的0.6%,并探讨了母婴阻断策略对疫情防治的积极效果;Mishra等[52]则利用AEM模型估计印度孟买HIV新发感染者数从2000年的7 878人下降至2017年的306人,并绘制出各高危人群干预措施实施后的患病率曲线,其中暗娼患病率由2000年的40%下降至2017年的0.5%左右,下降幅度最大。
(4)优点:①AEM模型输入指标很多,产出的结果指标也多,相比于Workbook法,可分析的数据多,能够更好的反映实际情况[50];②能够对干预措施实施后的疫情进行预测[51]。
(5)局限性:①相比于Workbook和EPP,AEM设定参数最多,包括行为学和流行病学参数,设置较为复杂;②低流行国家或地区由于参数设置无参考依据,其应用受到一定程度的限制;③抗病毒治疗覆盖率对艾滋病流行的影响可能会间接造成模型预测精度下降[53]。
3. EPP:
(1)基本原理:EPP模型是对某地区不同人群(广泛流行地区以城乡划分,聚集性流行地区以高危人群类别划分)连续多年的感染率监测数据进行拟合,进而实现对艾滋病感染率和发病率的短期预测;模型包括流行开始年份t0、感染强度r、流行初期易感者在成年人中所占比例f0和行为调整参数φ 4个主要参数,对于聚集性流行地区还考虑了高危人群转归时间d[46, 54]。随着EPP在艾滋病疫情估计中的应用,开发者对该模型也不断的进行改进,2007年引入贝叶斯方法,增强了艾滋病疫情的不确定性估计[55];2009年增加抗病毒治疗对HIV感染率的影响[56];2011年UNAIDS将EPP嵌入Spectrum软件中,作为预测发病率的主要推荐方法之一,共同完成对疫情估计指标的估算[57]。
(2)适应条件:EPP模型最初主要适用于艾滋病广泛流行地区,2005年优化后也可以满足艾滋病聚集性流行地区使用的需要[58]。
(3)应用:Melesse等[59]根据巴基斯坦的艾滋病流行特点,选择聚集性流行模式,估计巴基斯坦高危人群的患病率从2015年的16.1%上升至2020年的20.8%;杨介者等[60]利用EPP模型估计浙江省HIV新发感染者数从2012年的1 950例下降至2016年的1 714例,根据实际的监测数据对模型参数优化调整后,更加适合当地的艾滋病疫情流行情况。
(4)优点:①充分利用艾滋病的监测数据,生成符合实际的流行病学曲线;②能够通过参数权重调整处理艾滋病流行的地域多样性;③考虑了抗病毒治疗对HIV感染率的影响[56];④在与Spectrum软件进行合并后实现了功能上的互补,对艾滋病疫情的估计过程更为完整。
(5)局限性:①数据质量和代表性将会影响模型预测结果[54];②对监测数据要求较高,需要有多年的连续监测数据,即要求每个人群需提供≥3年的感染率[61];③不适用于低流行地区的艾滋病疫情估计。
4. Spectrum模型:
(1)基本原理:Spectrum模型主要包括人口学预测(DemProj)、艾滋病影响模块(AIM) 、目标模块(Goals)、计划生育(FamPlan)、预防HIV母婴传播(PMTCT)等。其中,DemProj模块通过基线年人口数、总和生育率、年龄别生育率、出生性别比、期望寿命、寿命表、人口流动等指标构建研究地区的背景人口信息,基于DemProj模块提供的人口学数据,结合AIM模块对各类人群HIV感染率、人群规模及转归等数据、抗病毒治疗数据、母婴阻断数据进行拟合,并考虑了不同治疗状态以及不同CD4水平疾病进展,最终得到HIV/AIDS存活感染数、新发感染数、艾滋病相关死亡数、艾滋病致孤儿童数、治疗需求、治疗后的生存时间等一系列丰富的结果[62]。Spectrum模型也是不断的更新和完善,2005年增加了PMTCT概率,引入了抗病毒治疗预防的效果,并以蒙特卡罗方法进行不确定性计算[63];2007年更新了抗病毒治疗后患者生存情况、预防母婴传播风险,提高了死亡率估计的准确性[64];2011年Spectrum和EPP整合成一个软件,整合的Spectrum/EPP模型可以将EPP的有关结果直接导入使用[57]。
(2)适用条件:适用于艾滋病低流行、聚集性流行以及广泛流行国家或地区,在艾滋病疫情估计中属于较为成熟的一种估计方法。
(3)应用:目前,Spectrum模型已在160多个国家使用,成为当前全球应用最为广泛的艾滋病疫情估计工具[65];印度[66]、乌干达[67]、牙买加[68]等国都利用此模型对本国的艾滋病疫情从国家层面进行过估计;卢飞豹等[69]利用Spectrum模型估计江西省2010年全省存活的HIV感染者为8 736例,HIV新发感染者数为1 031例,曲线拟合未来5年内江西省艾滋病疫情呈上升趋势,可能与该地区扩大HIV检测力度有关。
(4)优点:①多个模块组成,输出的指标信息丰富;②考虑了抗病毒治疗和预防母婴传播对疫情的影响;③结合了当前疫情估计中较为主流、成熟的方法(如EPP法、AEM法等),与之互为补充,方法的灵活性较大,适用范围较广[57]。
(5)局限性:①涉及参数较多,参数默认值的来源较为有限,不一定适用于所有人群和地区[62];②对发病率的拟合,需依托EPP进行,两模型假设不同或不能保持一致性,将会影响预测结果[70];③所需收集的信息较多,限制了在数据缺乏地区的使用[61]。
三、小结艾滋病疫情估计由于利用的数据、模型或方法的不同导致各种估计预测结果也不一样。数理模型中ARIMA模型和灰色系统模型多基于艾滋病报告数进行疫情估计,并未考虑艾滋病作为慢性传染病潜伏期等因素,其预测结果也为报告数,不能完全反映实际的HIV新发感染流行趋势;改良反向计算法、传染病动力学模型以及马尔科夫模型均可根据疾病不同感染状态及CD4水平模拟艾滋病发展过程,以HIV新发感染者数为结果指标,更能准确的反映艾滋病的流行水平和趋势,但传染病动力学模型模拟艾滋病传播过程过于简单,与马尔科夫模型相比,后者在拟合艾滋病多阶段多状态的过程中更具有优势;贝叶斯模型则利用艾滋病病例报告数据、专题调查数据以及先验信息进行参数推断,常与反向计算法、传染病动力学模型、马尔科夫模型结合共同对HIV新发感染者数进行估计,提高了数据的利用度;而计算机软件模型中的Workbook法仅依赖于高危人群规模和感染率两个指标进行疫情估计,估计结果也仅是时点估计,不能预测艾滋病的流行趋势,而AEM模型、EPP模型、Spectrum模型则充分利用艾滋病监测资料进行患病率的曲线拟合,能较为完整的反映疾病的转归情况,并且Spectrum软件与AEM模型、EPP模型相结合,功能上不断完善,适用流行区域水平更为广泛,已逐渐成为UNAIDS向各国推荐使用的疫情估计方法。
由于艾滋病疫情资料来源的多样性及HIV流行趋势的变化,艾滋病疫情估计与预测在不同地区、不同人群中的应用存在差异,且易受到艾滋病监测数据质量、疾病发展规律以及社会学因素的影响。因此,需要不断完善艾滋病疫情监测系统,提高艾滋病监测数据质量。同时,不同疫情估计方法之间应该相互结合、相互印证,才能够更好地对艾滋病疫情进行客观、科学的评估。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Shokoohi M, Karamouzian M, Osooli M, et al. Low HIV testing rate and its correlates among men who inject drugs in Iran[J]. Int J Drug Policy, 2016, 32: 64-69. DOI:10.1016/j.drugpo.2016.03.009 |
| [2] |
Liao MZ, Wang M, Shen XJ, et al. Bisexual behaviors,HIV knowledge,and stigmatizing/discriminatory attitudes among men who have sex with men[J]. PLoS One, 2015, 10(6): e0130866. DOI:10.1371/journal.pone.0130866 |
| [3] |
Joulaei H, Shooshtarian S, Dianatinasab M. Is UNAIDS 90-90-90 target a dream or a reality for middle East and North Africa region on ending the AIDS Epidemic? A review study[J]. AIDS Rev, 2018, 20(2): 83-93. DOI:10.24875/AIDSRev.M18000020 |
| [4] |
Jenniskens F, Tiendrebeogo G, Coolen A, et al. How countries cope with competing demands and expectations:perspectives of different stakeholders on priority setting and resource allocation for health in the era of HIV and AIDS[J]. BMC Public Health, 2012, 12: 1071. DOI:10.1186/1471-2458-12-1071 |
| [5] |
Box G, Jenkins G. Time series analysis forecasting and control[J]. J Time, 2010, 31(4): 303. DOI:10.1111/j.1467-9892.2009.00643.x |
| [6] |
Petukhova T, Ojkic D, McEwen B, et al. Assessment of autoregressive integrated moving average (ARIMA),generalized linear autoregressive moving average (GLARMA),and random forest (RF) time series regression models for predicting influenza A virus frequency in swine in Ontario,Canada[J]. PLoS One, 2018, 13(6): e0198313. DOI:10.1371/journal.pone.0198313 |
| [7] |
Wang YW, Shen ZZ, Jiang Y. Comparison of ARIMA and GM(1,1) models for prediction of hepatitis B in China[J]. PLoS One, 2018, 13(9): e0201987. DOI:10.1371/journal.pone.0201987 |
| [8] |
He ZR, Tao HB. Epidemiology and ARIMA model of positive- rate of influenza viruses among children in Wuhan,China:a nine-year retrospective study[J]. Int J Infect Dis, 2018, 74: 61-70. DOI:10.1016/j.ijid.2018.07.003 |
| [9] |
Rosel J, Oliver JC, Jara P, et al. A multilevel time-series model for the incidence of AIDS cases in Spain[J]. Health Place, 2000, 6(4): 309-317. DOI:10.1016/S1353-8292(00)00012-5 |
| [10] |
刘英, 唐玮, 赵天霄, 等. ARIMA乘积季节模型在湖南省HIV感染的应用研究[J]. 实用预防医学, 2018, 25(6): 760-763. Liu Y, Tang W, Zhao TX, et al. Application of ARIMA product season model in HIV infection in Hunan province[J]. Prat Prev Med, 2018, 25(6): 760-763. DOI:10.3969/j.issn.1006-3110.2018.06.035 |
| [11] |
Yu HK, Kim NY, Kim SS, et al. Forecasting the number of human immunodeficiency virus infections in the Korean population using the autoregressive integrated moving average model[J]. Osong Public Health Res Perspect, 2013, 4(6): 358-362. DOI:10.1016/j.phrp.2013.10.009 |
| [12] |
张曼, 王云霞, 王凯, 等. ARIMA模型预测乌鲁木齐市吸毒人群艾滋病病毒感染状况[J]. 实用预防医学, 2018(3): 310-312. Zhang M, Wang YX, Wang K, et al. Prediction on the prevalence of HIV/AIDS among drug addicts in Urumchi city with ARIMA model[J]. Prat Prev Med, 2018(3): 310-312. DOI:10.3969/j.issn.1006-3110.2018.03.016 |
| [13] |
Yu LJ, Zhou LL, Tan L, et al. Application of a new hybrid model with seasonal auto-regressive integrated moving average (ARIMA) and nonlinear auto-regressive neural network (NARNN) in forecasting incidence cases of HFMD in Shenzhen,China[J]. PLoS One, 2014, 9(6): e98241. DOI:10.1371/journal.pone.0098241 |
| [14] |
Yang XB, Zou JJ, Kong DG, et al. The analysis of GM (1,1) grey model to predict the incidence trend of typhoid and paratyphoid fevers in Wuhan city,China[J]. Medicine, 2018, 97(34): e11787. DOI:10.1097/MD.0000000000011787 |
| [15] |
Wang YN, Wei FF, Sun CQ, et al. The research of improved grey GM (1,1) model to predict the postprandial glucose in type 2 diabetes[J]. Biomed Res Int, 2016, 2016: 6837052. DOI:10.1155/2016/6837052 |
| [16] |
刘文东, 吴莹, 梁祁, 等. 新陈代谢GM(1,1)模型在中国HIV/AIDS流行趋势预测中的应用[J]. 中国卫生统计, 2013, 30(6): 821-823. Liu WD, Wu Y, Liang Q, et al. Application of metabolic GM(1,1) model on forecasting the epidemic tendency of HIV/AIDS in China[J]. Chin J Health Stat, 2013, 30(6): 821-823. |
| [17] |
林建潮, 徐乐, 应鉴林, 等. 灰色模型方法在艾滋病发病率预测中的应用[J]. 中国医院统计, 2016, 23(5): 349-350. Lin JC, Xu L, Ying JL, et al. Application of grey model method in the prediction of AIDS incidence[J]. Chin J Hospital Stat, 2016, 23(5): 349-350. DOI:10.3969/j.issn.1006-5253.2016.05.009 |
| [18] |
颜康康, 林雪君, 鲍红红, 等. 灰色GM(1,1)模型在艾滋病、淋病、梅毒发病率预测研究中的应用[J]. 实用预防医学, 2015, 23(3): 371-374. Yan KK, Lin XJ, Bao HH, et al. Application of GM(1,1) gray model in predicting the incidence of AIDS,gonorrhea and syphilis[J]. Prat Pre Med, 2015, 23(3): 371-374. DOI:10.3969/j.issn.1006-3110.2015.03.040 |
| [19] |
夏宏丽, 周小毅, 马平, 等. 南通市50岁以上人群艾滋病流行与趋势研究[J]. 实用预防医学, 2016, 23(6): 737-739. Xia HL, Zhou XY, Ma P, et al. AIDS epidemic and trend in people over 50 years old in Nantong city[J]. Prat Prev Med, 2016, 23(6): 737-739. DOI:10.3969/j.issn.1006-3110.2016.06.031 |
| [20] |
Wong NS, Wong KH, Lee MP, et al. Estimation of the undiagnosed intervals of HIV-infected individuals by a modified back-calculation method for reconstructing the epidemic curves[J]. PLoS One, 2016, 11(7): e0159021. DOI:10.1371/journal.pone.0159021 |
| [21] |
Song R, Hall HI, Green TA, et al. Using CD4 data to estimate HIV incidence,prevalence,and percent of undiagnosed infections in the United States[J]. J Acquir Immune Defic Syndr, 2017, 74(1): 3-9. DOI:10.1097/QAI.0000000000001151 |
| [22] |
Fellows IE, Morris M, Birnbaum JK, et al. A new method for estimating the number of undiagnosed HIV infected based on HIV testing history,with an application to men who have sex with men in seattle/King County,WA[J]. PLoS One, 2015, 10(7): e0129551. DOI:10.1371/journal.pone.0129551 |
| [23] |
Salomon JA, Murray CJ. Modelling HIV/AIDS epidemics in sub-Saharan Africa using seroprevalence data from antenatal clinics[J]. Bull World Health Organ, 2001, 79(10): 596-607. |
| [24] |
Hethcote HW. The mathematics of infectious diseases[J]. SIAM Rev, 2000, 42(4): 599-653. DOI:10.1137/S0036144500371907 |
| [25] |
Akpa OM, Oyejola BA. Modeling the transmission dynamics of HIV/AIDS epidemics:an introduction and a review[J]. J Infect Dev Ctries, 2010, 4(10): 597-608. DOI:10.3855/jidc.542 |
| [26] |
Sun QL, Min LQ. Dynamics analysis and simulation of a modified HIV infection model with a saturated infection rate[J]. Comput Math Methods Med, 2014, 2014: 145162. DOI:10.1155/2014/145162 |
| [27] |
Kühnert D, Stadler T, Vaughan TG, et al. Simultaneous reconstruction of evolutionary history and epidemiological dynamics from viral sequences with the birth-death SIR model[J]. J R Soc Interface, 2014, 11(94): 20131106. DOI:10.1098/rsif.2013.1106 |
| [28] |
Luo ST, Han LT, Lu HY, et al. Evaluating the impact of test-and-treat on the HIV epidemic among MSM in China using a mathematical model[J]. PLoS One, 2015, 10(6): e0126893. DOI:10.1371/journal.pone.0126893 |
| [29] |
徐勇, 张磊, 凌莉. 应用传染病动力学模型估计我国吸毒人群HIV年发病率[J]. 中华疾病控制杂志, 2016, 20(3): 215-219. Xu Y, Zhang L, Ling L. Using a transmission dynamic model to estimate annual HIV incidence rate among drug users in China[J]. Chin J Dis Control Prev, 2016, 20(3): 215-219. DOI:10.16462/j.cnki.zhjbkz.2016.03.001 |
| [30] |
Zhang L, Chow EPF, Jing J, et al. HIV prevalence in China:integration of surveillance data and a systematic review[J]. Lancet Infect Dis, 2013, 13(11): 955-963. DOI:10.1016/S1473-3099(13)70245-7 |
| [31] |
Wang JJ, Reilly KH, Luo J, et al. Dynamic mathematical models of HIV/AIDS transmission in China[J]. Chin Med J (Engl), 2010, 123(15): 2120-2127. DOI:10.3760/cma.j.issn.0366-6999.2010.15.030 |
| [32] |
刘世安, 李晓松, 苏茜, 等. MARKOV模型对具有波动性特征传染病发病趋势短期预测的初步探讨[J]. 现代预防医学, 2010, 37(10): 1815-1817. Liu SA, Li XS, Su X, et al. Study on the Markov model on short-term prediction for the trends of infectious diseases with volatility characteristics by[J]. Mod Prev Med, 2010, 37(10): 1815-1817. |
| [33] |
Lu Y, Fang JQ, Tian L, et al. Advanced Medical Statistics(2nd Edition)[M]. Beijing: World Scientific Publishing,August, 2015.
|
| [34] |
康殿民, 王洁贞, 薛付忠, 等. Markov模型在山东省肾综合征出血热流行趋势预测中的应用[J]. 现代预防医学, 2006, 33(9): 1665-1666. Kang DM, Wang JZ, Xue FZ, et al. Application of Markov model in prediction on epidemic trend of HFRS in Shandong province[J]. Mod Prev Med, 2006, 33(9): 1665-1666. DOI:10.3969/j.issn.1003-8507.2006.09.069 |
| [35] |
Nunez O, Hernando V, Diaz A. Estimating the number of people living with HIV and the undiagnosed fraction in Spain in 2013[J]. AIDS, 2018, 32(17): 2573-2581. DOI:10.1097/QAD.0000000000001989 |
| [36] |
Palombi L, Bernava GM, Nucita A, et al. Predicting trends in HIV-1 sexual transmission in sub-Saharan Africa through the drug resource enhancement against AIDS and Malnutrition model:antiretrovirals for 5 reduction of population infectivity,incidence and prevalence at the district level[J]. Clin Infect Dis, 2012, 55(2): 268-275. DOI:10.1093/cid/cis380 |
| [37] |
Mangal TD. Joint estimation of CD4+ cell progression and survival in untreated individuals with HIV-1 infection[J]. AIDS, 2017, 31(8): 1073-1082. DOI:10.1097/QAD.0000000000001437 |
| [38] |
Birrell PJ, Chadborn TR, Gill ON, et al. Estimating trends in incidence,time-to-diagnosis and undiagnosed prevalence using a CD4-based bayesian back-calculation[J]. Statist Commun Infect Dis, 2012, 4(1): 6. DOI:10.1515/1948-4690.1055 |
| [39] |
韩明. 贝叶斯统计学及其应用[M]. 上海: 同济大学出版社, 2015. Han M. Bayesian statistics and its application[M]. Shanghai: Tongji University Press, 2015. |
| [40] |
Rosinska M, Gwiazda P, de Angelis D, et al. Bayesian evidence synthesis to estimate HIV prevalence in men who have sex with men in Poland at the end of 2009[J]. Epidemiol Infect, 2016, 144(6): 1175-1191. DOI:10.1017/S0950268815002538 |
| [41] |
李爱华, 江震, 段松, 等. 基于CD4+T淋巴细胞水平反推法估计云南省德宏傣族景颇族自治州HIV诊断发现率[J]. 中华预防医学杂志, 2018, 52(8): 833-836. Li AH, Jiang Z, Duan S, et al. Estimation of HIV diagnosis rate with CD4+ T-lymphocyte level and infected-time model in Dehong prefecture,Yunnan province[J]. Chin J Prev Med, 2018, 52(8): 833-836. DOI:10.3760/cma.j.issn.0253-9624.2018.08.011 |
| [42] |
Dale R, Guo BB. Estimating epidemiological parameters of a stochastic differential model of HIV dynamics using hierarchical Bayesian statistics[J]. PLoS One, 2018, 13(7): e0200126. DOI:10.1371/journal.pone.0200126 |
| [43] |
Apenteng OO, Ismail NA. A markov chain monte carlo approach to estimate AIDS after HIV infection[J]. PLoS One, 2015, 10(7): e0131950. DOI:10.1371/journal.pone.0131950 |
| [44] |
Flanagan W, Boswell-Purdy J, Le Petit C, et al. Estimating summary measures of health:a structured Workbook approach[J]. Popul Health Metr, 2005, 3: 5. DOI:10.1186/1478-7954-3-5 |
| [45] |
李京新, 李朝晖. 应用工作簿法对邵阳市2017年艾滋病疫情估计[J]. 实用预防医学, 2017, 24(10): 1219-1221. Li JX, Li ZH. Estimation of AIDS epidemic situation in Shaoyang city by applying Workbook method[J]. Prat Prev Med, 2017, 24(10): 1219-1221. DOI:10.3969/j.issn.1006-3110.2017.10.018 |
| [46] |
van Veen MG, Presanis AM, Conti S, et al. National estimate of HIV prevalence in the Netherlands:comparison and applicability of different estimation tools[J]. AIDS, 2011, 25(2): 229-237. DOI:10.1097/QAD.0b013e32834171bc |
| [47] |
Wang N, Wang L, Wu ZY, et al. Estimating the number of people living with HIV/AIDS in China:2003-09[J]. Int J Epidemiol, 2010, 39 Suppl 2: ii21-28. DOI:10.1093/ije/dyq209 |
| [48] |
中华人民共和国卫生部, 联合国艾滋病规划署, 世界卫生组织. 2011年中国艾滋病疫情估计[J]. 中国艾滋病性病, 2012, 18(1): 1-5. Ministry of Health of the People's Republic of China, UNAIDS, World Health Organization. Estimation of AIDS epidemic in China in 2011[J]. Chin J AIDS STD, 2012, 18(1): 1-5. DOI:10.13419/j.cnki.aids.2012.01.005 |
| [49] |
罗超, 刘岩琳, 刘婷, 等. 试用Workbook模型估计哈尔滨市HIV新发感染人数[J]. 中国艾滋病性病, 2015, 21(1): 24-27. Luo C, Liu YL, Liu T, et al. Workbook model used to estimate the number of recent infections of HIV in Harbin[J]. Chin J AIDS STD, 2015, 21(1): 24-27. DOI:10.13419/j.cnki.aids.2015.01.008 |
| [50] |
Brown T, Peerapatanapokin W. The Asian epidemic model:a process model for exploring HIV policy and programme alternatives in Asia[J]. Sex Transm Infect, 2004, ,80 Suppl 1: i19-24. DOI:10.1136/sti.2004.010165 |
| [51] |
Thisyakorn U. Elimination of mother-to-child transmission of HIV:lessons learned from success in Thailand[J]. Paediatr Int Child Health, 2017, 37(2): 99-108. DOI:10.1080/20469047.2017.1281873 |
| [52] |
Mishra RM, Dube M, Sahu D, et al. Changing epidemiology of HIV in Mumbai:an application of the Asian epidemic model[J]. Glob J Health Sci, 2012, 4(5): 100-112. DOI:10.5539/gjhs.v4n5p100 |
| [53] |
Tao LL, Liu M, Li SM, et al. Impact of antiretroviral therapy on the spread of human immunodeficiency virus in Chaoyang district,Beijing,China:using the Asian epidemic model[J]. Chin Med J (Engl), 2017, 130(1): 32-38. DOI:10.4103/0366-6999.196571 |
| [54] |
Ghys PD, Brown T, Grassly NC, et al. The UNAIDS estimation and projection package:a software package to estimate and project national HIV epidemics[J]. Sex Transm Infect, 2004, 80 Suppl 1: i5-9. DOI:10.1136/sti.2004.010199 |
| [55] |
Brown T, Salomon JA, Alkema L, et al. Progress and challenges in modelling country-level HIV/AIDS epidemics:the UNAIDS Estimation and Projection Package 2007[J]. Sex Transm Infect, 2008, 84 Suppl 1: i5-10. DOI:10.1136/sti.2008.030437 |
| [56] |
Brown T, Bao L, Raftery AE, et al. Modelling HIV epidemics in the antiretroviral era:the UNAIDS Estimation and Projection package 2009[J]. Sex Transm Infect, 2010, 86 Suppl 2: ii3-10. DOI:10.1136/sti.2010.044784 |
| [57] |
Stover J, Brown T, Marston M. Updates to the spectrum/estimation and projection package (EPP) model to estimate HIV trends for adults and children[J]. Sex Transm Infect, 2012, 88 Suppl 2: i11-16. DOI:10.1136/sextrans-2012-050640 |
| [58] |
Brown T, Grassly NC, Garnett G, et al. Improving projections at the country level:the UNAIDS Estimation and Projection Package 2005[J]. Sex Transm Infect, 2006, 82 Suppl 3: iii34-40. DOI:10.1136/sti.2006.020230 |
| [59] |
Melesse DY, Shafer LA, Emmanuel F, et al. Heterogeneity in geographical trends of HIV epidemics among key populations in Pakistan:a mathematical modeling study of survey data[J]. J Glob Health, 2018, 8(1): 010412. DOI:10.7189/jogh.08.010412 |
| [60] |
杨介者, 蒋均, 潘晓红, 等. 基于EPP-Spectrum模型的浙江省艾滋病疫情评估[J]. 预防医学, 2018, 30(7): 649-652. Yang JZ, Jiang J, Pan XH, et al. Estimating HIV/AIDS epidemic in Zhejiang province with estimation and projection package- spectrum model[J]. J Prev Med, 2018, 30(7): 649-652. DOI:10.19485/j.cnki.issn2096-5087.2018.07.001 |
| [61] |
Mahy M, Brown T, Stover J, et al. Producing HIV estimates:from global advocacy to country planning and impact measurement[J]. Glob Health Action, 2017, 10 Suppl 1: 1291169. DOI:10.1080/16549716.2017.1291169 |
| [62] |
Stover J. Projecting the demographic consequences of adult HIV prevalence trends:the Spectrum Projection Package[J]. Sex Transm Infect, 2004, 80 Suppl 1: i14-18. DOI:10.1136/sti.2004.010157 |
| [63] |
Stover J, Walker N, Grassly NC, et al. Projecting the demographic impact of AIDS and the number of people in need of treatment:updates to the Spectrum projection package[J]. Sex Transm Infect, 2006, 82 Suppl 3: iii45-50. DOI:10.1136/sti.2006.020172 |
| [64] |
Stover J, Johnson P, Zaba B, et al. The Spectrum projection package:improvements in estimating mortality,ART needs,PMTCT impact and uncertainty bounds[J]. Sex Transm Infect, 2008, 84 Suppl 1: i24-30. DOI:10.1136/sti.2008.029868 |
| [65] |
Stover J, Brown T, Puckett R, et al. Updates to the Spectrum/Estimations and Projections Package model for estimating trends and current values for key HIV indicators[J]. AIDS, 2017, 31 Suppl 1: S5-11. DOI:10.1097/qad.0000000000001322 |
| [66] |
Raj Y, Sahu D, Pandey A, et al. Modelling and estimation of HIV prevalence and number of people living with HIV in India,2010-2011[J]. Int J STD AIDS, 2016, 27(14): 1257-1266. DOI:10.1177/0956462415612650 |
| [67] |
Pegurri E, Konings E, Crandall B, et al. The missed HIV-positive children of Ethiopia[J]. PLoS One, 2015, 10(4): e0124041. DOI:10.1371/journal.pone.0124041 |
| [68] |
Duncan J, Jarrett SB, Harvey K. Using estimation and projection package and Spectrum for Jamaica's national HIV estimates and targets[J]. Sex Transm Infect, 2010, 86 Suppl 2: ii43-47. DOI:10.1136/sti.2010.044511 |
| [69] |
卢飞豹, 廖清华, 胡国良, 等. Spectrum模型在江西省艾滋病疫情估计与预测中的应用[J]. 中国艾滋病性病, 2015, 21(3): 220-222. Lu FB, Liao QH, Hu GL, et al. Application of Spectrum model in estimation,prediction and analysis on the HIV/AIDS epidemic of Jiangxi province[J]. Chin J AIDS STD, 2015, 21(3): 220-222. DOI:10.13419/j.cnki.aids.2015.03.14 |
| [70] |
Stover J, Johnson P, Hallett T, et al. The Spectrum projection package:improvements in estimating incidence by age and sex,mother-to-child transmission,HIV progression in children and double orphans[J]. Sex Transm Infect, 2010, 86 Suppl 2: ii16-21. DOI:10.1136/sti.2010.044222 |
 2019, Vol. 40
2019, Vol. 40


