文章信息
- 张良, 冯伟, 陆蓓蓓, 李宁, 李辉, 谷少华, 葛挺, 许国章.
- Zhang Liang, Feng Wei, Lu Beibei, Li Ning, Li Hui, Gu Shaohua, Ge Ting, Xu Guozhang.
- 宁波市大气PM2.5污染对城区居民慢性阻塞性肺疾病门诊量影响研究
- The impact of ambient PM2.5 on daily outpatient visits due to chronic obstructive pulmonary disease, among the urban residents of Ningbo city
- 中华流行病学杂志, 2019, 40(6): 686-691
- Chinese Journal of Epidemiology, 2019, 40(6): 686-691
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.06.016
-
文章历史
收稿日期: 2018-12-28
2. 奉化区疾病预防控制中心慢性病与社区卫生服务科, 宁波 315500;
3. 宁波市医疗中心李惠利医院呼吸内科 315010
2. Department of Chronic Diseases and Community Health Service, Fenghua District Center for Disease Control and Prevention, Ningbo 315500, China;
3. Respiratory Department, Ningbo City Medical Treatment Center Lihuili Hospital, Ningbo 315010, China
全球范围内,COPD具有较高的患病率和病死率,主要发生在>40岁人群[1-3],仅2013年就造成290万人死亡[2]。COPD也已成为我国的重要公共卫生问题。2012年全球疾病负担研究认为,我国大气细颗粒物污染是仅次于高血压、吸烟、不良饮食习惯的健康危害因素[4]。研究表明大气颗粒物进入肺后,会产生粘附因子及细胞因子,使各种炎症细胞聚集,从而导致炎症发生[5],引起呼吸系统疾病包括哮喘、肺功能下降、COPD、肺炎等。流行病学研究表明,PM2.5大气污染与COPD急诊就诊、住院和死亡密切相关[6-13]。近年来,我国的城市空气污染水平有所降低,即使在低于现行空气质量标准的条件下,空气污染仍然会对儿童、老年人、心肺疾病患者等敏感人群的呼吸系统健康造成损害[11-13]。死亡病例、住院患者和门诊量是反映空气污染对人群健康影响的3大指标。我国患者就诊与接诊医生不实行事先预约制,因而门诊量相比其他资料覆盖人群更广且更为敏感。但由于门诊资料难以收集,因而过往研究多采用PM2.5暴露讨论其对COPD患者死亡或入院的影响[7-9]。
宁波市以居民电子健康档案和病历为基础建设了宁波市全民健康信息平台,实现了市、县两级辖区内医疗机构信息的互联互通[14],通过对健康医疗大数据的深入挖掘和利用,可以对慢性病的预测提供更有价值的帮助[15],多家医院门诊资料收集得以实现。本研究借助宁波市全民健康信息平台进行数据采集,采用时间序列的泊松回归的广义相加模型(generalized additive model,GAM)定量评价宁波市大气PM2.5污染对COPD门诊量的影响。
资料与方法1.资料来源:宁波市全民健康信息平台收集的宁波市城区4家市级三级甲等综合医院2014年1月1日至2016年12月31日期间就诊的COPD门诊患者资料。根据国际疾病伤害及死因分类标准(ICD-10)编码对资料进行整理,收集ICD编码为J44就诊患者资料,包括性别、年龄、就诊日期等。患者资料均根据身份识别,筛选出身份证号为本地户籍人群纳入最终分析。
同期气象资料由宁波市气象台提供,包括全市日均气温、日均相对湿度和日均气压。
同期空气污染物日均浓度资料由宁波市环境监测中心提供,包括细颗粒物(PM2.5)、可吸入颗粒物(PM10)、二氧化硫(SO2)和二氧化氮(NO2),对覆盖宁波市城区8个固定监测站点的数据求得算术平均值,作为人群污染物平均暴露量。
2.分析方法:
(1)建立GAM的单污染物模型:采用GAM分析大气PM2.5浓度对COPD逐日就诊量的影响。考虑到每日的COPD发病为小概率事件,并可能存在过度离散化,采用广义泊松回归(Quasi-Poisson)模型的平滑样条函数(smoothing spline function)拟合非线性混杂因素,包括长期时间趋势、季节性和气象因素,采用哑变量控制“星期几效应”。建立核心模型,根据模型残差图和延迟1~30 d的偏自相关(PACF)值和最小绝对值选择时间样条函数的自由度,最终确定自由度。引入星期哑元变量控制星期几效应。核心模型建立后,考察残差序列是否呈随机平稳白噪分布,若不满足残差独立的要求,则对模型进行进一步调整。在核心模型的基础上,将PM2.5浓度作为直线变量引入模型,同时考虑到滞后效应,将污染物当天(Lag0)、1 d前至7 d前浓度(Lag1,Lag2,…,Lag7)逐一引入模型,最终选择效应最强时间浓度,分析PM2.5浓度对研究结局的影响

式中,Yi为第i日门诊人次,E(Yi)为第i日门诊人次的期望值,Xi为第i日大气污染物的浓度,β为回归系数,s为平滑样条函数,week为星期哑元变量,time为时间变量,Zi为第i日气象因素变量,df为自由度,α为残差。
PM2.5浓度的短期效应采用相对危险度(relative risk,RR)和超额危险度(excess risk,ER)指标。ER表示为PM2.5浓度每升高10 μg/m3造成的门诊量增加百分比,计算方法为ER=(RR-1)×100%=[exp(β)-1]×100%。
COPD日门诊量、PM2.5日均浓度与其他污染物及各气象指标之间的相关性分析采用Spearman相关,GAM运用R 3.3.1软件中的“mgcv”工具包进行GAM分析;以P<0.05为差异有统计学意义。
(2)双污染物模型:分别将PM10、SO2和NO2变量在模型中进行线性拟合,再同时纳入PM2.5浓度同一滞后天数的最优拟合模型,检验PM2.5浓度对居民每日COPD门诊量的效应是否受到PM10、SO2和NO2浓度影响。
3.质量控制:COPD就诊数据来源于宁波市全民健康信息平台,为核实其数据的准确性,随机抽取一家医院,从医院HIS系统导出ICD编码为J44就诊患者资料,并由宁波市CDC大数据研究所专业技术人员进行复核整理,确保研究资料真实可靠。大气污染物浓度和气象因素数据均来源于官方资料。
结果1.一般特征:宁波市2014-2016年共监测到COPD门诊就诊人次数33 214例,日均30.34例,<65岁者13 418例(40.40%),≥65岁者19 796例(59.60%)。研究期间日平均气温为17.80 ℃,日平均相对湿度为77.05%RH,日平均气压1 015.68 hPa。PM2.5平均浓度为43.15 μg/m3,超过GB 3095-2012环境空气质量标准中的二级浓度标准限值[16]。见表 1。
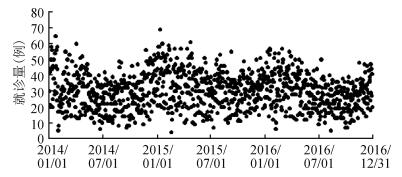
2. COPD日门诊量时间趋势分布:COPD门诊量时序图显示,每日COPD门诊量呈现一致的季节性波动,每年COPD发病人数均呈现春冬季高,夏秋季低的分布趋势(图 1)。
|
| 图 1 2014-2016年宁波市每日COPD门诊量时间趋势 |
3. COPD日门诊量、大气PM2.5浓度与其他因素的相关性分析:研究期间大气PM2.5日均浓度与COPD日门诊量呈正相关(r=0.164,P<0.01),日均气温、日均相对湿度与COPD日门诊量呈负相关(r=-0.258,P<0.01;r=-0.154,P=0.01),日均气压与COPD日门诊量呈正相关(r=0.227,P<0.01)。PM2.5浓度和各空气污染因子的相关性较弱,且均为正相关,其中与PM10的相关性最强,相关系数为0.959;PM2.5浓度和各气象因子的相关系数均有统计学意义(P<0.01),见表 2。
4.单污染物模型效应分析:单污染物模型中,PM2.5浓度对COPD门诊就诊人次当天和滞后第4、5天影响效应均有统计学意义,其中滞后效应在第4天最强,此时PM2.5浓度每增加10 μg/m3,COPD日门诊量增加1.87%(95%CI:0.98%~2.76%)。见图 2。

|
| 图 2 不同滞后天数PM2.5浓度每升高10 μg/m3总人群门诊量超额危险度(%) |
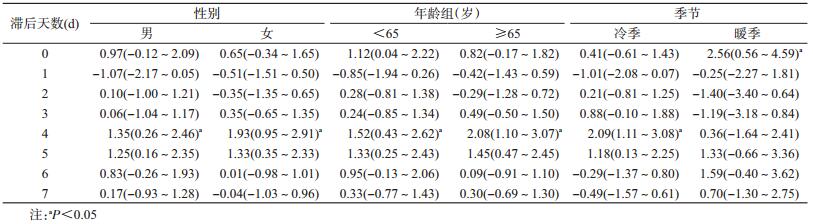
PM2.5浓度对不同人群COPD门诊量的影响有滞后效应,滞后第4天对男性、女性、<65岁和≥65岁人群的COPD门诊量影响最大,PM2.5浓度每升高10 μg/m3 COPD日门诊量分别增加1.35%(95%CI:0.26%~2.46%)、1.93%(95%CI:0.95%~2.49%)、1.52%(95%CI:0.43%~2.62%)和2.08%(95%CI:1.10%~3.07%)。将全年分为冷季(11月至次年4月)和暖季(5-10月)发现,冷季存在滞后效应,在第4天达到最强,此时PM2.5浓度每升高10 μg/m3,COPD日门诊量增加2.09%(95%CI:1.11%~3.08%);暖季未见滞后效应,当天PM2.5浓度每升高10 μg/m3,COPD日门诊量增加2.56%(95%CI:0.56%~4.59%)。见表 3。
5.双污染物模型效应分析:由于大气PM2.5浓度对滞后4 d的COPD门诊量效应值最大,分别将PM10、SO2和NO2浓度以线性纳入PM2.5浓度当天和滞后第4天的模型。控制时间长期趋势、季节效应、气象因素和“星期几效应”,引入PM10、SO2和NO2浓度后,效应ER值差异有统计学意义(P<0.05),但PM2.5浓度对当天的COPD门诊量效应ER值的影响差异无统计学意义(P<0.05),对滞后第4天的COPD门诊量效应强度略有变化。见表 4。
本研究基于宁波市全民健康信息平台2014年1月1日至2016年12月31日期间宁波市城区居民COPD日就诊资料与大气PM2.5浓度之间的GAM模型分析,发现宁波市大气PM2.5浓度升高与居民COPD门诊量增加相关,且效应值高于PM2.5浓度对该市居民COPD死亡效应[9],与Meta分析结论基本一致[17]。本研究期间宁波市城区PM2.5平均浓度超过GB 3095-2012环境空气质量标准中的二级浓度标准限值,但效应均低于有关文献报道结果[10, 17-18],除研究方法、分析模型、各地人口构成及人群对大气污染的易感性不同外,可能还与各地大气PM2.5污染水平及其成分差异有关。
GAM模型单污染物分析显示,宁波市PM2.5浓度与COPD日门诊量不仅存在正相关,同时具有一定的滞后效应,且效应在第4天最强。既往文献研究结果显示[9, 12],PM2.5浓度变化对居民的呼吸系统疾病影响存在正相关且具有滞后性,滞后天数效应最强多集中在4~6 d,与本研究结果一致。本研究分析发现滞后1 d的效应接近保护效应,可能由于污染暴露到发病存在一定的时间间隔,而暴露当天发病人群初诊后,通常会在2~7 d后有≥1次复诊[18];且本次研究数据均来自市级三甲医院,一些在基层医疗机构就诊的人群通常在症状加重后再前往大医院就诊[19],因而也可能与就诊模式有关。但在滞后第4天,PM2.5浓度对COPD门诊量的影响还是相对稳定的,与Li等[9]结果一致。而由于污染物之间存在共线性,导致PM2.5对COPD死亡的效应较单污染物模型时明显减少[20],但大气颗粒物是复合污染物,不同区域的来源不同使其成分差异较大,仍需要更多的研究证据支持。
与我国台湾地区的研究结果类似[21],本研究亦发现暖季时PM2.5浓度对COPD门诊量的影响效应强度大于冷季,且暖季时当天效应最强,出现收获效应。目前高温对COPD的影响机制尚不清楚[22],可能暖季时人们开窗通风和户外活动增多,增加了暴露机会,使患者更易受到污染物的影响[23]。而低温可直接激活细胞因子引起呼吸道炎症变化,引起外周血管收缩,血液分流,使肺有效通气容积减少[24],可导致COPD病程的持续恶化[20-21];且由于冷季存在一定的滞后效应,低温期间要对患有COPD等呼吸系统疾病的人群采取持续保护措施。
目前,大气PM2.5污染对不同人群COPD的影响特征各不相同。本研究发现,PM2.5对女性和≥65岁人群的影响效应更明显。女性受到的影响高可能由于不同性别生理机制差异,导致女性更易形成气道受限引发COPD[25];此外,在我国80%的家庭使用燃料,而女性是家务劳动的主体,燃料在燃烧过程中易产生大量的颗粒物,增加了暴露风险。≥65岁人群效应值高可能与老年人生理功能的衰退,对PM2.5细颗粒物清除能力降低有关;此外,≥65岁人群中COPD具有较高的患病率、多为合并有其他慢性病的老年人,因而对大气污染更为敏感。
本研究采用门诊日就诊资料作为健康结局更能灵敏地反映大气PM2.5污染的急性效应,但本研究也存在局限性。单纯采用室外固定监测点的数据很可能出现对研究对象PM2.5真实暴露水平的估算误差。另外,由于时间序列分析是生态学研究,是基于人群而不是个体,可能存在生态学谬误。
综上所述,本研究提示大气PM2.5污染会显著增加脆弱人群的发病风险,应建立适宜COPD等呼吸系统疾病的预警系统,加强健康宣教,制定相应的防护策略。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Adeloye D, Chua S, Lee C, et al. Global and regional estimates of COPD prevalence:systematic review and Meta-analysis[J]. J Glob Health, 2015, 5(2): 0204215. DOI:10.7189/jogh.05-020415 |
| [2] |
GBD 2013 Mortality and Causes of Death Collaborators. Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013:a systematic analysis for the Global Burden of Disease Study 2013[J]. Lancet, 2015, 385(9963): 117-171. DOI:10.1016/S0140-6736(14)61682-2 |
| [3] |
包鹤龄, 方利文, 王临虹. 1990-2014年中国40岁及以上人群慢性阻塞性肺疾病患病率Meta分析[J]. 中华流行病学杂志, 2016, 37(1): 119-124. Bao HL, Fang LW, Wang LH. Prevalence of chronic obstructive pulmonary disease among community population aged ≥ 40 in China:a Meta-analysis on studies published between 1990 and 2014[J]. Chin J Epidemiol, 2016, 37(1): 119-124. DOI:10.3760/cma.j.issn.0254-6450.2016.01.026 |
| [4] |
Vos T, Flaxman AD, Naghavi M, et al. Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and injuries 1990-2010:a systematic analysis for the Global Burden of disease study 2010[J]. Lancet, 2012, 380(9859): 2163-2196. DOI:10.1016/S0140-6736(12)61729-2 |
| [5] |
Pozzi R, de Berardis B, Paoletti L, et al. Inflammatory mediators induced by coarse (PM2.5-10) and fine (PM2.5) urban air particles in RAW 264.7 cells[J]. Toxicology, 2003, 183(1/3): 243-254. DOI:10.1016/S0300-483X(02)00545-0 |
| [6] |
Neuberger M, Moshammer H, Rabczenko D. Acute and subacute effects of urban air pollution on cardiopulmonary emergencies and mortality:time series studies in Austrian cities[J]. Int J Environ Res Public Health, 2013, 10(10): 4728-4751. DOI:10.3390/ijerph10104728 |
| [7] |
Meng X, Wang CC, Cao DC, et al. Short-term effect of ambient air pollution on COPD mortality in four Chinese cities[J]. Atmos Environ, 2013, 77: 149-154. DOI:10.1016/j.atmosenv.2013.05.001 |
| [8] |
Lo WC, Shie RH, Chan CC, et al. Burden of disease attributable to ambient fine particulate matter exposure in Taiwan[J]. J Formos Med Assoc, 2017, 116(1): 32-40. DOI:10.1016/j.jfma.2015.12.007 |
| [9] |
Li GX, Huang J, Xu GZ, et al. The short term burden of ambient fine particulate matter on chronic obstructive pulmonary disease in Ningbo, China[J]. Environ Health, 2017, 16: 54. DOI:10.1186/s12940-017-0253-1 |
| [10] |
de Vries R, Kriebel D, Sama S. Outdoor air pollution and COPD-related emergency department visits, hospital admissions, and mortality:a Meta-analysis[J]. COPD, 2017, 14(1): 113-121. DOI:10.1080/15412555.2016.1216956 |
| [11] |
Rage E, Siroux V, Künzli N, et al. Air pollution and asthma severity in adults[J]. Occup Environ Med, 2009, 66(3): 182-188. DOI:10.1136/oem.2007.038349 |
| [12] |
de Vries R, Kriebel D, Sama S. Low level air pollution and exacerbation of existing COPD:a case crossover analysis[J]. Environ Health, 2016, 15: 98. DOI:10.1186/s12940-016-0179-z |
| [13] |
Lagorio S, Forastiere F, Pistelli R, et al. Air pollution and lung function among susceptible adult subjects:a panel study[J]. Environ Health, 2006, 5: 11. DOI:10.1186/1476-069X-5-11 |
| [14] |
张良, 纪威, 李辉, 等. 慢性病智能平台直报模式探索与实践[J]. 中国卫生信息管理杂志, 2017, 14(2): 179-183. Zhang L, Ji W, Li H, et al. Ningbo intelligent practice mode of platform direct reporting of infectious diseases[J]. Chin J Health Inf Manag, 2017, 14(2): 179-183. DOI:10.3969/j.issn.1672-5166.2017.02.015 |
| [15] |
Cohen J, Dolan B, Dunlap M, et al. MAD skills:new analysis practices for big data[J]. Proc VLDB Enow, 2009, 2(2): 1481-1492. DOI:10.14778/1687553.1687576 |
| [16] |
生态环境部. GB 3095-2012环境空气质量标准[S].中国环境科学出版社, 2012. Ministry of Ecology and Environment. GB 3095-2012 Ambient Air Quality Standards[S]. China Environmental Science Press, 2012. |
| [17] |
Li MH, Fan LC, Mao B, et al. Short-term exposure to ambient fine particulate matter increases hospitalizations and mortality in COPD:a systematic review and Meta-analysis[J]. Chest, 2016, 149(2): 447-458. DOI:10.1378/chest.15-0513 |
| [18] |
谷少华, 贾红英, 李萌萌, 等. 济南市空气污染对呼吸系统疾病门诊量的影响[J]. 环境与健康杂志, 2015, 32(2): 95-98. Gu SH, Jia HY, Li MM, et al. Effects of air pollution on hospital visits for respiratory diseases in Ji'nan city[J]. J Environ Health, 2015, 32(2): 95-98. DOI:10.16241/j.cnki.1001-5914.2015.02.001 |
| [19] |
姜彩霞, 朱冰, 张龙. 2013-2014年杭州市大气PM2.5与呼吸系统疾病就诊人次的时间序列研究[J]. 环境与职业医学, 2018, 35(7): 589-595. Jiang CX, Zhu B, Zhang L. Association between ambient PM2.5 and hospital visits for respiratory diseases in Hangzhou in 2013-2014:A time-series study[J]. J Environ Occup Med, 2018, 35(7): 589-595. DOI:10.13213/j.cnki.jeom.2018.17634 |
| [20] |
朱瑞霞, 陈亚红, 邓芙蓉, 等. 北京市大气污染物对慢性阻塞性肺疾病预后的影响[J]. 国际呼吸杂志, 2012, 32(9): 665-671. Zhu RX, Chen YH, Deng FR, et al. Association between particulate air pollution and the prognosis of chronic obstructive pulmonary disease in Beijing[J]. Int J Respir, 2012, 32(9): 665-671. DOI:10.3760/cma.j.issn.1673-436X.2012.009.005 |
| [21] |
Tsai SS, Chang CC, Yang CY. Fine particulate air pollution and hospital admissions for chronic obstructive pulmonary disease:a case-crossover study in Taipei[J]. Int J Environ Res Public Health, 2013, 10(11): 6015-6026. DOI:10.3390/ijerph10116015 |
| [22] |
Hansel NN, McCormack MC, Kim V. The effects of air pollution and temperature on COPD[J]. COPD, 2016, 13(3): 372-379. DOI:10.3109/15412555.2015.1089846 |
| [23] |
Atkinson RW, Carey IM, Kent AJ, et al. Long-term exposure to outdoor air pollution and the incidence of chronic obstructive pulmonary disease in a national English cohort[J]. Occup Environ Med, 2015, 72(1): 42-48. DOI:10.1136/oemed-2014-102266 |
| [24] |
谷少华, 陆蓓蓓, 边国林, 等. 大气可吸入颗粒物对心血管疾病急救人次的短期影响[J]. 环境与职业医学, 2016, 33(10): 965-969. Gu SH, Lu BB, Bian GL, et al. Short-term effect of inhalable particulate matters on emergency ambulance dispatches for cardiovascular diseases[J]. J Environ Occup Med, 2016, 33(10): 965-969. DOI:10.13213/j.cnki.jeom.2016.16140 |
| [25] |
Luoto JA, Elmståhl S, Wollmer P, et al. Incidence of airflow limitation in subjects 65-100 years of age[J]. Eur Respir J, 2016, 47(2): 461-472. DOI:10.1183/13993003.00635-2015 |
 2019, Vol. 40
2019, Vol. 40