文章信息
- 王斯悦, 王梦莹, 李文咏, 周仁, 郑鸿尘, 刘冬静, 李楠, 周治波, 朱洪平, 吴涛.
- Wang Siyue, Wang Mengying, Li Wenyong, Zhou Ren, Zheng Hongchen, Liu Dongjing, Li Nan, Zhou Zhibo, Zhu Hongping, Wu Tao.
- 中国人群WNT代谢通路与非综合征型唇腭裂的亲源效应分析
- Study regarding the parent-of-origin effect of WNT pathway genes on non-syndromic cleft lip with or without cleft palate among the Chinese population
- 中华流行病学杂志, 2019, 40(6): 670-675
- Chinese Journal of Epidemiology, 2019, 40(6): 670-675
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.06.013
-
文章历史
收稿日期: 2018-11-13
2. 北京大学口腔医院颌面外科 100081
2. Department of Oral and Maxillofacial Surgery, School of Stomatology, Peking University, Beijing 100081, China
非综合征型唇裂合并或不合并腭裂(non- syndromic cleft lip with or without cleft palate,NSCL/P)是由于胚胎发育过程中颌腭组织发育不全或发育受阻而引起的一组颌面部先天性畸形,为多基因及环境因素影响的复杂疾病[1]。尽管大量遗传流行病学研究发现了多个致病位点,但其作用总和仅能解释部分遗传度[2],而其生物学致病机制依然不明确。现有NSCL/P的遗传病因探索,往往局限在单基因位点致病效应的分析,而忽视亲源效应(parent of origin effect)对该病发生风险的影响[3-4]。亲源效应指两个亲本等位基因中一方表达,另一方沉默,依靠单亲传递遗传学性状[5]。既往研究显示,TGFB3、MSX1、PAX3和PAX7等候选基因可能通过亲源效应影响NSCL/P的发病风险[6-8]。
WNT基因家族在小鼠颅面胚胎发育中发挥重要作用[9],WNT信号通路参与小鼠颌面部的形态形成过程[10]。既往研究发现WNT代谢通路相关基因位点与NSCL/P之间存在关联,但亲源效应研究比较罕见。本研究拟基于现有全基因组关联研究(genome-wide association study,GWAS)数据中的806个中国核心家庭样本,选择WNT代谢通路中研究证据较充分的WNT3A、WNT3、WNT5A、WNT5B、WNT9A、WNT9B和WNT11基因,探索上述基因是否通过亲源效应影响NSCL/P的发生。
对象与方法1.研究对象:采用核心家系设计,即以患者及其双亲为研究对象。本研究基于“唇腭裂的基因组学国际合作组研究”项目,其研究设计和方法参考文献[11-12]。该项目在中国台湾、山东、湖北和四川省共募集806个NSCL/P核心家系(2 418人),具体人群分布情况参见文献[13]。本研究中,NSCL/P患者的诊断由各研究现场临床和医学遗传学专家完成,已排除综合征型唇腭裂患者。
2.基因型测定:使用芯片Illumina Human610- Quad v.1_B BeadChip(Illumina)进行基因型检测,在约翰霍普金斯医学院McKusick-Nathans遗传医学研究所遗传病研究中心完成。关于生物样本的采集、处理以及DNA提取详见参考文献[12]。
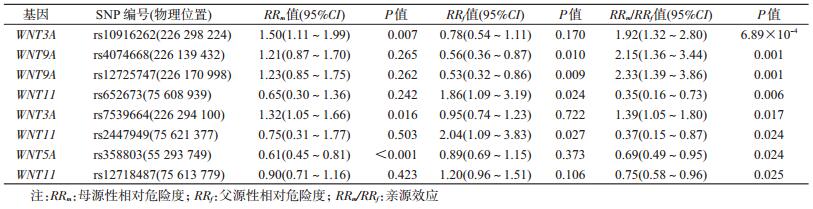
3.基因型数据质量控制:采用Plink 1.90软件[14],根据以下标准进行基因型数据质量控制:①缺失率(missing rate)≤10%;②弱势等位基因频率≥1%;③父母人群符合Hardy-Weinberg平衡(P>0.05);④孟德尔遗传错误率(Mendelian errors)≤5%。经过质量控制后,共纳入7个基因上的144个单核苷酸多态性(single nucleotide polymorphism,SNP)位点进入分析。相关基因的名称、位置和SNP位点数量信息见表 1。
4.母亲孕期环境暴露因素的收集:通过问卷调查收集母亲孕期环境暴露信息。其中,吸烟是指母亲在孕前3周及整个孕周期在家中、工作场所或者其他环境中有人在其周围吸烟(即:被动吸烟);补充复合维生素的定义为母亲在孕前3周至怀孕最初期3周内补充维生素(未区分维生素种类)。纳入研究中的环境暴露变量均为二分类变量。
5.统计学分析:采用R 3.5.0软件的Haplin 7.0.0软件包完成亲源效应分析,并绘制Q-Q图。采用对数线性模型分析亲源效应[15-16]。假设存在亲源效应,患儿中遗传自母亲某位点的相对危险度RRm值与父源性相对危险度RRf值相比差异有统计学意义,也即两者比值显著偏离1。若无效假设RRR=RRm/RRf =1成立,则认为目前尚未有足够证据支持该位点具有亲源效应。单体型亲源效应分析纳入同基因上亲源效应P<0.05的位点构建单体型[17]。假设存在某单体型的亲源效应,遗传自母亲某单体型组合的相对危险度RRm值与父源性相对危险度RRf值差异有统计学意义,即两者比值将显著偏离1。若无效假设RRR=RRm/RRf=1有统计学意义,则认为目前尚未能找到足够证据支持该单体型具有亲源效应。
亲源效应与环境的交互作用(PoO×E)分析采用Wald检验[18-19]。若存在亲源效应与环境因素的交互,则在不同环境因素的暴露状态下,亲源效应的层间效应不一致,即PoO_RRR(E=1)/PoO_RRR(E=0)显著偏离1。
采用Bonferroni进行多重检验校正,共纳入144个SNP位点进入分析,因此显著性阈值设定为0.05/144=3.47×10-4。此外,采用Q-Q图探寻可能存在亲源效应的位点信号[17, 20-21]。无亲源效应的位点其P值的负对数(-log10 P)将依照无效假设落入斜对角线上及其95%CI内。
结果1.基本信息:根据本研究采用的GWAS数据,共检测WNT家族7个基因上的159个SNP位点。经质量控制后,共纳入7个基因上的144个SNP位点进入分析,相关基因的名称、位置和SNP数量信息见表 1。
2. NSCL/P家系单位点亲源效应分析:对NSCL/P家系中的144个SNP位点进行亲源效应分析,结果显示WNT3A基因上的rs10916262亲源效应分析结果P值最小(P=6.89×10-4),但经过Bonferroni多重检验校正后,未达到统计学显著性水平(P>3.47×10-4)。位于WNT基因通路上的SNP位点其亲源效应检验结果提示:该通路上任一单个位点尚不具有确凿证据提示其在中国人群非综合征型唇腭裂发病风险上的亲源效应。见表 2。
经Bonferroni校正,除位于WNT9A的rs4074668及rs12725747外,单个SNP位点有无亲源效应及亲源效应P值分布检验的结果均无统计学意义。位于WNT9A的rs4074668及rs12725747偏离无效假设的斜对角线,并落于95%CI外,提示WNT9A及其附近区域的组合效应(单倍体效应)可能具有亲源效应。见图 1。

|
| 图 1 非综合征型唇裂合并或不合并腭裂家系亲源效应分析位点Q-Q图 |
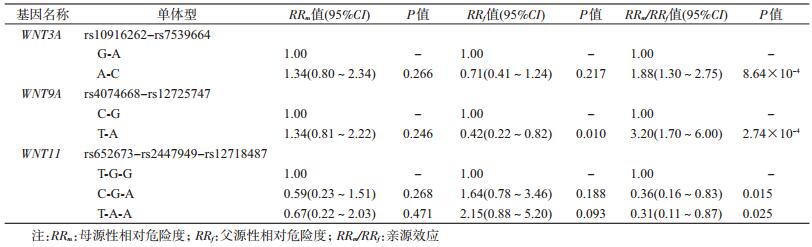
3. NSCL/P家系单体型亲源效应分析:基于本研究中8个P<0.05的SNP位点,将同基因的位点构建单体型以探索该单体型是否存在亲源效应。WNT9A基因上rs4074668-rs12725747(T-A)构成的单体型组合与C-G单体型相比,由母亲提供的T-A单体型是由父亲提供的危险度的3.20倍(95%CI:1.70~6.00),P=2.74×10-4,经Bonferroni多重检验校正后仍具有统计学意义。位于WNT3A基因上rs10916262-rs7539664(A-C)单体型相比于G-A单体型,其母方来源是父方来源危险度的1.88倍(95%CI:1.30~2.75),P=8.64×10-4,但经校正后差异无统计学意义,见表 3。
4. NSCL/P家系单体型亲源效应与环境暴露交互作用分析:为探究可能存在的亲源效应是否与母亲孕期环境暴露存在交互作用,将上述单体型进行亲缘效应与环境因素的交互检验。结果显示,尽管位于WNT9A上rs4074668-rs1275747(T-A)单体型在孕期暴露于被动吸烟和非暴露两层之间亲源效应点估计值方向相反,但其差异无统计意义,尚不能认为母亲孕期吸烟与WNT9A基因上rs4074668- rs1275747(T-A)单体型存在的亲源效应有关。此外,WNT通路上单体型与母亲孕期服用维生素在亲源效应的交互作用检验的结果无统计学意义,亦无法提示该暴露(母亲孕期维生素补充)对亲源效应的影响。见表 4。
本研究在NSCL/P中国806个核心家系中发现WNT9A基因上rs4074668-rs12725747的T-A单体型与C-G单体型相比,由母亲提供的T-A单体型是由父亲提供的危险度的3.20倍(95%CI:1.70~6.00,P=2.74×10-4),经Bonferroni多重检验校正后仍有统计学意义。WNT代谢通路基因,尤其是WNT9A基因单体型可能通过亲源效应影响NSCL/P的发生风险。
亲源效应近年来被认为是影响NSCL/P等复杂疾病发生风险的机制之一[3-5, 18-19]。本研究利用中国人群GWAS数据的SNP位点研究未发现达到GWAS显著水平的SNP位点,但纳入WNT9A单体型rs4074668-rs12725747(T-A)后,WNT9A基因单体型的亲源效应有统计学意义。目前关于亲源效应对NSCL/P的致病作用研究结果尚不一致。有研究发现,子代胱硫醚β-合酶(CBS)基因的c.844ins68母源性突变[22]、NSCL/P核心家系TGFB3基因的rs2300607和MSX1基因的rs12532位点的父源性突变可能增加子代患病风险[6-7],MSX1基因还可通过基因印迹影响NSCL/P的发病风险[7],RUNX2、TGFA、PAX3和PAX7基因也可能具有NSCL/P致病的亲源效应[8, 23-24]。但Shi等[25]纳入2 000多个NSOC核心家系探索亲源效应研究没有发现达到GWAS显著水平的SNP位点,与本研究的SNP位点研究结果一致。本研究未发现单体型亲源效应与维生素D的交互作用,与Razi等[26]的研究结论类似,即任何维生素D代谢通路上SNP位点均无统计学意义,而维生素代谢基因单体型与疾病的关联有统计学意义。可能的原因是传统SNP位点关联研究纳入分析的标签位点(tagSNP)可能与相邻的致病基因位点呈高度连锁不平衡,而单体型区域是多个tagSNP的组合结果,因而可以覆盖更宽的因连锁不平衡而共同传递的基因区域。本研究结果提示致病基因可能在WNT9A rs4074668-rs12725747(T-A)单体型所覆盖的连锁区域内,一定程度上提示了NSCL/P病因线索。
WNT信号通路参与调节多种细胞活动,与正常生长发育和疾病发生关系密切,尤其在颌面部形态形成中发挥重要作用[27-28]。WNT基因及其下游区域基因突变与NSCL/P等多种颌面部畸形有关[29-30]。在胚胎发育过程中,上唇和上腭的形成是包括一系列相互协调步骤的复杂过程,这一过程受基因网络的精确调控。多项研究发现WNT信号通路在唇腭的形态形成中发挥重要作用,并于转基因老鼠模型等动物模型证实[10, 30-31]。WNT9A在咽外胚层中表达,在上腭和下颚发育中发挥重要作用:由WNT9A、WNT5B和FRZB等基因协同,促进面部突起的融合并介导腭扩展,WNT9A失调可能与口面裂隙发病机制有关[27, 32]。
亲源效应的产生机制可能与表观遗传学有关,即影响疾病发生风险的基因最终是否能产生疾病表型取决于其来自于母方或父方,可能由于母源或父源基因上受到了基因印记修饰[32],也有研究提示精子和卵子存在不同突变机制[33]。此外,亲源效应的既往研究提示,亲源效应的表达可能在不同环境暴露中存在差异,即在存在单方亲本的基因修饰下,其表达可能在不同暴露状态下具有差异[20, 34]。本研究探索了WNT代谢通路亲源效应与母亲孕期被动吸烟与多维生素补充之间的交互作用,发现WNT9A rs4074668-rs127425单体型具有亲源效应,并且亲源效应的点效应值在母亲孕期被动吸烟暴露与否的不同层间方向相反,但差异无统计学意义。
本研究创新拓展了NSCL/P传统基因关联研究的范畴,采用对数线性探寻NSCL/P致病机制中的亲本来源差异信息,并探索亲源效应在不同环境因素暴露间是否存在差异。本研究发现的WNT单体型对中国人群唇腭裂的发病风险存在亲源效应,然其作用如何受到表观遗传修饰的作用机制仍需不同研究设计进一步探索。基于所发现的WNT9A单体型具有亲源效应,本研究进一步探索了中国人群中该单体型的亲源效应是否与母亲孕期吸烟及补充维生素的暴露存在交互作用,但未得到有统计学意义的结果。由于本研究中环境暴露收集过程中面临母亲孕期吸烟和饮酒的暴露率很低(<3%),而被动吸烟与前2种暴露相比,对疾病发生风险作用相对较低,严格的多重检验校正标准以及对亲源效应、亲源效应-环境交互作用更大的样本量需求[20],使本研究的把握度较低,这可能是未发现有统计学意义的亲源效应-环境交互作用的重要原因。此外,本研究仅纳入了GWAS研究实际获得的基因分型信息,并未进行数据填补(imputation),未来可开展相关工作进一步开展关联分析。
本研究采用核心家系设计,该方法可以较好地控制人群分层对研究造成的混杂。且基于代谢通路为基础的候选基因策略选择基因开展亲源效应分析,研究效率较高。本次研究观察到的亲源效应仍需其他人群样本的验证及生物学机制的探索。亲源效应作为表观遗传的可能表现形式之一[4],本研究所采纳的单位点、组合单体型的亲源效应分析及其与环境交互作用探索或将为NSCL/P的致病机制提供新线索。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Leslie EJ, Marazita ML. Genetics of cleft lip and cleft palate[J]. Am J Med Genet C Semin Med Genet, 2013, 163(4): 246-258. DOI:10.1002/ajmg.c.31381 |
| [2] |
Basha M, Demeer B, Revencu N, et al. Whole exome sequencing identifies mutations in 10% of patients with familial non-syndromic cleft lip and/or palate in genes mutated in well-known syndromes[J]. J Med Genet, 2018, 55(7): 449-458. DOI:10.1136/jmedgenet-2017-105110 |
| [3] |
Skare Ø, Lie RT, Haaland ØA, et al. Analysis of parent-of-origin effects on the X chromosome in Asian and European Orofacial cleft triads identifies associations with DMD, FGF13, EGFL6, and additional loci at Xp22.2[J]. Front Genet, 2018, 9: 25. DOI:10.3389/fgene.2018.00025 |
| [4] |
Lawson HA, Cheverud JM, Wolf JB. Genomic imprinting and parent-of-origin effects on complex traits[J]. Nat Rev Genet, 2013, 14(9): 609-617. DOI:10.1038/nrg3543 |
| [5] |
Guilmatre A, Sharp AJ. Parent of origin effects[J]. Clin Genet, 2012, 81(3): 201-209. DOI:10.1111/j.1399-0004.2011.01790.x |
| [6] |
Reutter H, Birnbaum S, Mende M, et al. TGFB3 displays parent-of-origin effects among central Europeans with nonsyndromic cleft lip and palate[J]. J Hum Genet, 2008, 53(7): 656-661. DOI:10.1007/s10038-008-0296-9 |
| [7] |
Suazo J, Santos JL, Jara L, et al. Parent-of-origin effects for MSX1 in a Chilean population with nonsyndromic cleft lip/palate[J]. Am J Med Genet A, 2010, 152A(8): 2011-2016. DOI:10.1002/ajmg.a.33528 |
| [8] |
Sull JW, Liang KY, Hetmanski JB, et al. Maternal transmission effects of the PAX genes among cleft case-parent trios from four populations[J]. Eur J Hum Genet, 2009, 17(6): 831-839. DOI:10.1038/ejhg.2008.250 |
| [9] |
Brugmann SA, Goodnough LH, Gregorieff A, et al. Wnt signaling mediates regional specification in the vertebrate face[J]. Development, 2007, 134(18): 3283-3295. DOI:10.1242/dev.005132 |
| [10] |
Mani P, Jarrell A, Myers J, et al. Visualizing canonical WNT signaling during mouse craniofacial development[J]. Dev Dyn, 2010, 239(1): 354-363. DOI:10.1002/dvdy.22072 |
| [11] |
Beaty TH, Ruczinski I, Murray JC, et al. Evidence for gene-environment interaction in a genome wide study of isolated, non-syndromic cleft palate[J]. Genet Epidemiol, 2011, 35(6): 469-478. DOI:10.1002/gepi.20595 |
| [12] |
Beaty TH, Murray JC, Marazita ML, et al. A genome-wide association study of cleft lip with and without cleft palate identifies risk variants near MAFB and ABCA4[J]. Nat Genet, 2010, 42(6): 525-529. DOI:10.1038/ng.580 |
| [13] |
王竹青, 王苹, 吴雅慧, 等. 中国人群转化生长因子β信号通路上的基因多态性与非综合征型唇腭裂的关联研究[J]. 北京大学学报:医学版, 2015, 47(3): 384-389. Wang ZQ, Wang P, Wu YH, et al. Association study between candidate genes on transforming growth factor-β signaling pathway and the risk of non-syndromic cleft lip with or without cleft palate in Chinese populations[J]. J Peking Univ:Health Sci, 2015, 47(3): 384-389. DOI:10.3969/j.issn.1671-167X.2015.03.004 |
| [14] |
Chang CC, Chow CC, Tellier LCAM, et al. Second-generation PLINK:rising to the challenge of larger and richer datasets[J]. Giga Science, 2015, 4: 7. DOI:10.1186/s13742-015-0047-8 |
| [15] |
Gjessing HK, Lie RT. Case-parent triads:estimating single-and double-dose effects of fetal and maternal disease gene haplotypes[J]. Ann Hum Genet, 2006, 70(Pt 3): 382-396. DOI:10.1111/j.1529-8817.2005.00218.x |
| [16] |
Connolly S, Heron EA. Review of statistical methodologies for the detection of parent-of-origin effects in family trio genome-wide association data with binary disease traits[J]. Brief Bioinform, 2015, 16(3): 429-448. DOI:10.1093/bib/bbu017 |
| [17] |
Haaland ØA, Lie RT, Romanowska J, et al. A genome-wide search for gene-environment effects in isolated cleft lip with or without cleft palate triads points to an interaction between maternal periconceptional vitamin use and variants in ESRRG[J]. Front Genet, 2018, 9(3): 116. DOI:10.3389/fgene.2018.00060 |
| [18] |
Witsø E, Cinek O, Tapia G, et al. Genetic determinants of enterovirus infections:polymorphisms in type 1 diabetes and innate immune genes in the MIDIA study[J]. Viral Immunol, 2015, 28(10): 556-563. DOI:10.1089/vim.2015.0067 |
| [19] |
Myking S, Myhre R, Gjessing HK, et al. Candidate gene analysis of spontaneous preterm delivery:new insights from re-analysis of a case-control study using case-parent triads and control-mother dyads[J]. BMC Med Genet, 2011, 12: 174. DOI:10.1186/1471-2350-12-174 |
| [20] |
Gjerdevik M, Haaland ØA, Romanowska J, et al. Parent-of-origin-environment interactions in case-parent triads with or without independent controls[J]. Ann Hum Genet, 2018, 82(2): 60-73. DOI:10.1111/ahg.12224 |
| [21] |
Haaland ØA, Jugessur A, Gjerdevik M, et al. Genome-wide analysis of parent-of-origin interaction effects with environmental exposure (PoOxE):An application to European and Asian cleft palate trios[J]. PLoS One, 2017, 12(9): e0184358. DOI:10.1371/journal.pone.0184358 |
| [22] |
Rubini M, Brusati R, Garattini G, et al. Cystathionine beta-synthase c.844ins68 gene variant and non-syndromic cleft lip and palate[J]. Am J Med Genet A, 2005, 136A(4): 368-372. DOI:10.1002/ajmg.a.30812 |
| [23] |
Sull JW, Liang KY, Hetmanski JB, et al. Differential parental transmission of markers in RUNX2 among cleft case-parent trios from four populations[J]. Genet Epidemiol, 2008, 32(6): 505-512. DOI:10.1002/gepi.20323 |
| [24] |
Sull JW, Liang KY, Hetmanski JB, et al. Evidence that TGFA influences risk to cleft lip with/without cleft palate through unconventional genetic mechanisms[J]. Hum Genet, 2009, 126(3): 385-394. DOI:10.1007/s00439-009-0680-3 |
| [25] |
Shi M, Murray JC, Marazita ML, et al. Genome wide study of maternal and parent-of-origin effects on the etiology of orofacial clefts[J]. Am J Med Genet A, 2012, 158A(4): 784-794. DOI:10.1002/ajmg.a.35257 |
| [26] |
Razi F, Meshkani MA, Zarrabi F, et al. Haplotypes in vitamin D receptor gene encode risk in diabetic nephropathy[J]. Gene, 2019, 683: 149-152. DOI:10.1016/j.gene.2018.10.017 |
| [27] |
Rochard L, Monica SD, Ling ITC, et al. Roles of WNT pathway genes wls, wnt9a, wnt5b, frzb and gpc4 in regulating convergent-extension during zebrafish palate morphogenesis[J]. Development, 2016, 143(14): 2541-2547. DOI:10.1242/dev.137000 |
| [28] |
Kamel G, Hoyos T, Rochard L, et al. Requirement for frzb and fzd7a in cranial neural crest convergence and extension mechanisms during zebrafish palate and jaw morphogenesis[J]. Dev Biol, 2013, 381(2): 423-433. DOI:10.1016/j.ydbio.2013.06.012 |
| [29] |
Chiquet BT, Blanton SH, Burt A, et al. Variation in WNT genes is associated with non-syndromic cleft lip with or without cleft palate[J]. Hum Mol Genet, 2008, 17(14): 2212-2218. DOI:10.1093/hmg/ddn121 |
| [30] |
Menezes R, Letra A, Kim AH, et al. Studies with WNT genes and nonsyndromic cleft lip and palate[J]. Birth Defects Res A Clin Mol Teratol, 2010, 88(11): 995-1000. DOI:10.1002/bdra.20720 |
| [31] |
Lan Y, Ryan RC, Zhang ZY, et al. Expression of WNT9B and activation of canonical WNT signaling during midfacial morphogenesis in mice[J]. Dev Dyn, 2006, 235(5): 1448-1454. DOI:10.1002/dvdy.20723 |
| [32] |
Ching W, Hang HC, Nusse R. Lipid-independent secretion of a Drosophila WNT protein[J]. J Biol Chem, 2008, 283(25): 17092-17098. DOI:10.1074/jbc.M802059200 |
| [33] |
Goldman JM, Wong WSW, Pinelli M, et al. Parent-of-origin-specific signatures of de novo mutations[J]. Nat Genet, 2016, 48(8): 935-939. DOI:10.1038/ng.3597 |
| [34] |
Wang S, Yu Z, Miller RL, et al. Methods for detecting interactions between imprinted genes and environmental exposures using birth cohort designs with mother-offspring pairs[J]. Human Hered, 2011, 71(3): 196-208. DOI:10.1159/000328006 |
 2019, Vol. 40
2019, Vol. 40