文章信息
- 黄晓春, 仇小强, 曾小云, 刘顺, 韦芳练, 黎燕宁, 刘韬, 武亚楠, 冯宝莹, 蒋群姣, 黄东萍.
- Huang Xiaochun, Qiu Xiaoqiang, Zeng Xiaoyun, Liu Shun, Wei Fanglian, Li Yanning, Liu Tao, Wu Yanan, Feng Baoying, Jiang Qunjiao, Huang Dongping.
- 父母地中海贫血与早产及低出生体重的关系研究
- Associations of parental thalassemia with preterm birth and low birth weight
- 中华流行病学杂志, 2019, 40(5): 596-600
- Chinese Journal of Epidemiology, 2019, 40(5): 596-600
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.05.020
-
文章历史
收稿日期: 2018-10-27
2. 广西医科大学公共卫生学院流行病与卫生统计学教研室, 南宁 530021;
3. 广西德保县妇幼保健院产科门诊 531400
2. Department of Epidemiology and Health Statistics, School of Public Health, Guangxi Medical University, Nanning 530021, China;
3. Dpartment of Obstetrics, Guangxi Debao County of Maternal and Child Health Hospital, Debao 531400, China
地中海贫血(地贫)又称为海洋性贫血,是由于一种或者多种珠蛋白基因的异常,引起珠蛋白链合成减少或缺乏,从而导致珠蛋白链比例失衡的常染色体隐性单遗传性溶血性疾病。临床上主要分为α-地贫和β-地贫,主要有溶血、无效红细胞生成及小细胞低色素性贫血等,均可表现为血红蛋白水平降低[1]。地贫的全球发病率为2.5%~25.0%,地贫基因携带率为1.7%,多见于地中海、非洲、亚洲、南太平洋地区。该病最多见于我国广东省、广西壮族自治区、云南省等地,其中广西壮族自治区是地贫高发地,发病率高达17.55%~23.16%,α-地贫、β-地贫基因携带率分别为17.6%、6.4%[2-3]。目前尚无有效根治地贫的方法,因此育龄父母实行产前地贫筛查及基因诊断是预防重度地贫儿出生的有效手段。目前已有不少关于母亲罹患地贫对妊娠结局影响的研究[4-5],而关于父亲携带地贫基因对妊娠结局是否有影响的研究较少。本研究收集广西壮族自治区西南地区育龄父母的地贫筛查和基因诊断结果,分析父母一方或双方携带地贫基因对妊娠结局的影响,以期为预防不良的妊娠结局、提高人口出生质量提供科学依据。
对象与方法1.研究对象:数据主要来源于桂妇儿健康服务信息管理系统。样本人群为2017年1-12月在广西壮族自治区靖西市、德保县人民医院或妇幼保健院进行地贫筛查的13 247对父母,在经过系统产前检查并地贫基因诊断的2 424对父母中选择任意一方或双方诊断为地贫且有妊娠结局的758对父母作为地贫组;选择同期到院产前检查并地贫基因诊断为正常或地贫筛查、血红蛋白电泳检测均为阴性且有妊娠结局的健康父母共758对作为非地贫组。在地贫组中根据父母是否罹患地贫的情况分为以下3个亚组:母亲地贫组、父亲地贫组以及父母双方地贫组,分析各地贫亚组新生儿早产和低出生体重的发生风险,研究人群筛选标准及分组流程见图 1。本研究通过广西医科大学医学伦理委员会批准,所有研究对象均知情同意并签署知情同意书。

|
| 图 1 研究人群筛选标准及分组方法流程 |
2.观察指标及标准:地贫患者一般无明显的症状,血常规提示平均红细胞体积<82 fl或者红细胞平均血红蛋白<27 pg,血红蛋白正常或者轻度下降,并根据HbA2和抗碱血红蛋白提示地贫类型的特征,采用gap-PCR及反向斑点杂交技术确诊地贫患者的地贫类型。收集研究对象人口学资料:母亲户籍、分娩年龄、母亲BMI、父亲年龄、父亲BMI、产次、流产次数(包括人工流产或自然流产次数)、初检孕周、产检次数、胎数、产期血红蛋白(最后一次产检的血红蛋白)、孕期感染性疾病、妊娠期高血压以及妊娠期糖尿病;不良妊娠结局指标及标准:早产(在妊娠满28周至不足37周间分娩的新生儿)、低出生体重(新生儿出生后1 h内出生体重<2 500 g,包括早产低出生体重和足月低出生体重)。
3.统计学分析:采用SAS 9.4以及SPSS 20.0软件整理和分析数据。计量资料用x±s表示,组间比较采用独立样本t检验,计数资料用频数表示。采用χ2检验进行组间比较,多因素分析以是否出现不良妊娠结局作为因变量,以有统计学意义或可能影响因变量的因素作为自变量进行Cox回归分析,自变量筛选采用向后Wald法,计算各地贫亚组与新生儿早产和低出生体重的RR值和95%CI。按分娩年龄(18~34岁和<18岁或≥35岁)、母亲BMI(18.50~23.90和<18.5或≥24 kg/m2)、产次(初产和经产)、流产次数(≥2次和<2次)和产检次数(<8次和≥8次)进行分层,计算各层地贫与妊娠结局的RR值和95%CI,用异质性检验分析分层因素是否为混杂因素。所有分析采用双侧检验,以P<0.05为差异有统计学意义。
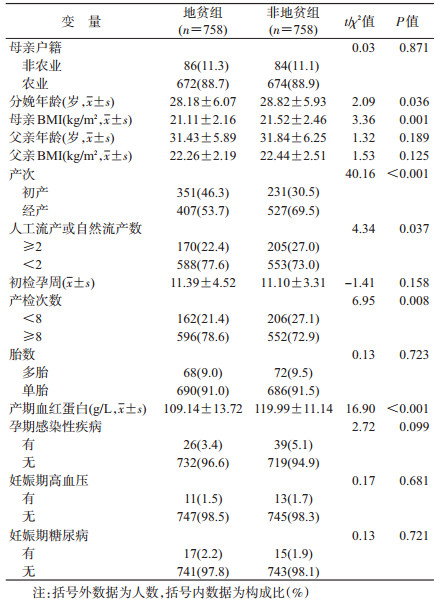
结果1.一般情况:地贫组和非地贫组共1 516名母亲,其中户籍为农业占88.78%,非农业占11.22%;分娩年龄(28.50±6.00)岁,范围为14~50岁;孕周为(38.77±1.56)周,范围为28~42周;初检孕周为(11.24±3.96)周;初产和经产妇分别占38.39%、61.61%;流产次数≥2次占24.73%;产检次数<8次占24.27%;单胎和多胎分别占90.77%、9.23%;丈夫年龄为(31.63±6.08)岁。母亲的分娩年龄、BMI以及产期血红蛋白在地贫组与非地贫组间的差异有统计学意义(P<0.05);在地贫组中,初产妇所占的比例(46.3%)高于非地贫组(30.5%),两组间差异有统计学意义(χ2=40.16,P<0.001),产检次数≥8次所占的比例(78.6%)高于非地贫组(72.9%),两组间差异有统计学意义(χ2=6.95,P=0.008),而流产次数≥2次所占的比例(22.4%)低于非地贫组(27.0%),两组间差异有统计学意义(χ2=4.34,P=0.037)。见表 1。
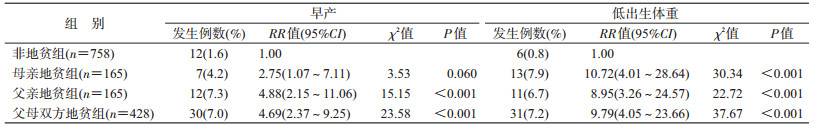
2.各地贫亚组和非地贫组早产和低出生体重的单因素分析:早产率在父亲地贫组、父母双方地贫组与非地贫组间的差异有统计学意义(χ2=15.15,χ2=23.58,P<0.001),而早产在母亲地贫组与非地贫组间的差异无统计学意义(P>0.05);母亲地贫组、父亲地贫组、父母双方地贫组和非地贫组新生儿出生体重分别为(3 043.85±459.47)、(3 054.24±408.28)、(3 037.41±481.49)和(3 295.79±311.46)g,低出生体重在母亲地贫组、父亲地贫组及父母双方地贫组与非地贫组间的差异均有统计学意义(χ2=30.34,χ2=22.72,χ2=37.67,均P<0.001)。见表 2。
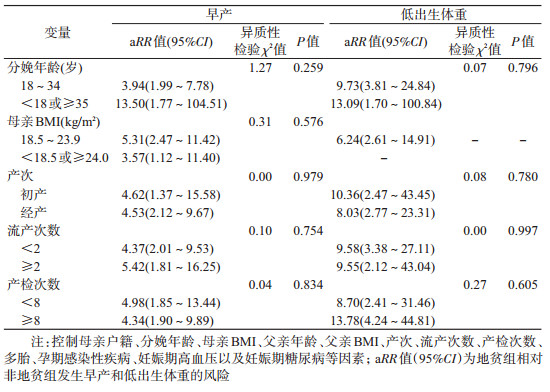
3.地贫组与非地贫组的分层分析:地贫与新生儿早产、低出生体重的aRR值在母亲分娩年龄、产次、流产次数及产检次数的各层间差异无统计学意义(P>0.05);地贫与早产的aRR值在母亲不同BMI层间的差异无统计学意义(异质性检验χ2=0.31,P=0.576);而低出生体重在母亲BMI<18.5或≥24.0 kg/m2组中无发生例数,尚不能判断地贫与低出生体重的aRR值在母亲BMI的层间差异是否存在异质性。见表 3。
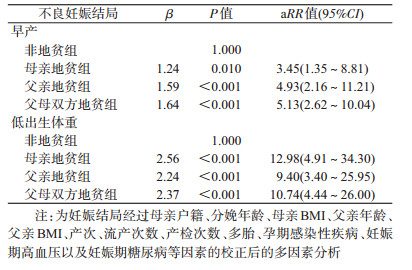
4.各地贫亚组和非地贫组早产和低出生体重的Cox回归分析:通过对母亲户籍、分娩年龄、母亲BMI、父亲年龄、父亲BMI、产次、流产次数、产检次数、多胎、孕期感染性疾病、妊娠期高血压以及妊娠期糖尿病等因素校正后,Cox回归分析结果显示,新生儿出现早产的危险因素是母亲地贫组(aRR=3.45,95%CI:1.35~8.81,P=0.010)、父亲地贫组(aRR=4.93,95%CI:2.16~11.21,P<0.001)及父母双方地贫组(aRR=5.13,95%CI:2.62~10.04,P<0.001);新生儿出现低出生体重的危险因素是母亲地贫组(aRR=12.98,95%CI:4.91~34.30,P<0.001)、父亲地贫组(aRR=9.40,95%CI:3.40~25.95,P<0.001)及父母双方地贫组(aRR=10.74,95%CI:4.44~26.00,P<0.001)。见表 4。
5.各组间的趋势性检验:将母亲地贫组和父亲地贫组合并为父母单方地贫组,与非地贫组以及父母双方地贫组作趋势性检验。父母双方地贫组比父母单方地贫组发生早产(趋势检验χ2=22.72,P<0.001)及低出生体重(趋势检验χ2=34.03,P<0.001)的风险更高。
讨论目前大部分研究结果显示母亲单方罹患地贫对新生儿早产、低出生体重的不良影响[6-8],而对于父亲是否罹患地贫对不良妊娠结局影响的研究较少。本研究结果显示,母亲地贫、父亲地贫以及父母双方地贫均可增加新生儿早产、低出生体重的风险,且父母双方地贫相对于父母单方地贫发生新生儿早产与低出生体重的风险更高。
母亲作为胎儿的营养供给体,若合并地贫,当其在孕期长期处于慢性溶血性贫血或者铁元素消耗量过大或摄入不足时易加重已存在的小细胞低色素贫血状态[2],血液被稀释,血红蛋白和红细胞计数显著下降,为胎儿提供的营养物质亦会减少[9],故可能会导致胎儿出现体重偏低。若贫血严重程度增加,机体易缺血缺氧,子宫胎盘的有效循环血量降低造成胎儿缺血缺氧,从而导致流产、早产的发生。
父亲单方罹患地贫对妊娠结局产生不良影响的原因可能是父亲携带的地贫基因是地贫胎儿的遗传来源之一,以及与胎儿血红蛋白水平调控地贫基因而产生相关基因的多态性有关[10-11],从而导致携带地贫基因的胎儿在临床上表现多样性。还有研究报道携带地贫基因患儿常患有生长激素缺乏症、甲状旁腺功能减低症、糖耐量受损和原发性甲状腺功能减低等[12],这些内分泌并发症易导致地贫患儿生长发育迟缓,地贫患儿出现早产、低出生体重的风险更高。
父母双方均罹患地贫,若父母地贫基因同型则有更大的风险怀上重型地贫胎儿,而重型地贫胎儿若长期处在慢性贫血的状态时机体组织易缺血缺氧,进而引起心脏、骨骼等器官发育异常[13],从而导致胎儿生长发育障碍,易出现早产、低出生体重的风险;而对于地贫父母双方合并不同型的地贫对不良妊娠结局的影响,有研究表明β-地贫表型严重的程度受α-地贫共遗传的调控,β-地贫等位基因可明显改善α-地贫的严重程度[14],由此可推测其影响可能没有妊娠合并同型地贫的父母严重,但仍不可忽视。
本研究分层分析结果显示,母亲分娩年龄、产次、流产次数以及产检次数对地贫与早产、低出生体重相关的影响较小,母亲BMI对地贫与早产相关的影响较小,而在母亲BMI<18.5或≥24.0 kg/m2的人群中无新生儿低出生体重发生例数,导致在母亲BMI为18.5~24.0 kg/m2的人群中地贫与低出生体重相关的结果更好,故尚不能认为母亲BMI影响地贫与低出生体重相关的结论。
本研究存在局限性。各地贫亚组样本量仍偏小,部分父亲资料不全,携带地贫基因的夫妇对妊娠结局影响的差异仍需进一步探讨。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
何文, 王晓东, 余海燕. 妊娠合并地中海贫血研究现状[J]. 中华妇幼临床医学杂志:电子版, 2017, 13(1): 14-19. He W, Wang XD, Yu HY. Research status of pregnancy combined with thalassemia[J]. Chin J Obstet Gynecol Pediatr Electr Ed, 2017, 13(1): 14-19. DOI:10.3877/cma.j.issn.1673-5250.2017.01.003 |
| [2] |
熊盈, 余艳红, 杨芳, 等. 妊娠合并地中海贫血的研究进展[J]. 现代妇产科进展, 2014, 23(6): 495-497. Xiong Y, Yu YH, Yang F, et al. Progress in the study of pregnancy combined with thalassemia[J]. Mod Obstetr Gynecol Progr, 2014, 23(6): 495-497. DOI:10.13283/j.cnki.xdfckjz.2014.06.022.ckjz.2014.06.022 |
| [3] |
杨阳, 张杰. 中国南方地区地中海贫血研究进展[J]. 中国实验血液学杂志, 2017, 25(1): 276-280. Yang Y, Zhang J. Rresearch progress on thalassemia in southern China-Review[J]. J Exper Hematol, 2017, 25(1): 276-280. DOI:10.7534/j.issn.1009-2137.2017.01.050 |
| [4] |
Charoenboon C, Jatavan P, Traisrisilp K, et al. Pregnancy outcomes among women with beta-Thalassemia trait[J]. Archiv Gynecol Obstet, 2016, 293(4): 771-774. DOI:10.1007/s00404-015-3908-6 |
| [5] |
Traisrisilp K, Luewan S, Tongsong T. Pregnancy outcomes in women complicated by thalassemia syndrome at Maharaj Nakorn Chiang Mai hospital[J]. Arch Gynecol Obstet, 2009, 279: 685-689. DOI:10.1007/s00404-008-0804-3 |
| [6] |
庞婷, 郭雪峰, 周月红, 等. 广西壮族自治区平果县孕妇妊娠合并轻型α-地中海贫血对妊娠结局的回顾性分析[J]. 中华流行病学杂志, 2017, 38(12): 1328-1331. Pang T, Guo XF, Zhou YH, et al. Outcomes of pregnancy among women with alpha-thalassemia minor:A Retrospective study of Pingguo County in Guangxi Zhuang Autonomous Region[J]. Chin J Epidemiol, 2017, 38(12): 1328-1331. DOI:10.3760/cma.j.issn.0254-6450.2017.12.007 |
| [7] |
兰李想, 李敏清, 谢丹尼, 等. 不同类型α地中海贫血孕妇妊娠期血红蛋白、铁蛋白水平变化及妊娠结局分析[J]. 中国妇幼保健, 2018, 31(16): 3212-3214. Lan LX, Li MQ, Xie DN, et al. Analysis on the changes of hemoglobin and ferritin levels and pregnancy outcomes of pregnant women with α-thalassemia[J]. Mate Child Health Care Chin, 2018, 31(16): 3212-3214. DOI:10.7620/zgfybj.j.issn.1001-4411.2016.16.05 |
| [8] |
王玉廷, 徐雨晨. 地中海贫血对孕妇妊娠结局影响的系统评价[J]. 重庆医科大学学报, 2015, 40(4): 569-575. Wang YT, Xu YC. Effects of thalassemia on pregnancy outcome:a systematic analysis[J]. J Chongqing Med Univ, 2015, 40(4): 569-575. DOI:10.13406/j.cnki.cyxb.000564 |
| [9] |
张晶莹, 张燕燕, 贾瑾, 等. 地中海贫血妇女妊娠结局分析[J]. 现代预防医学, 2013, 40(1): 29-31. Zhang JY, Zhang YY, Jia J, et al. Outcomes of pregnant women with thalassemia[J]. Mod Prev Med, 2013, 40(1): 29-31. |
| [10] |
Yu LH, Liu D, Cai R, et al. Changes in hematological parameters in α-thalassemia individuals co-inherited with erythroid Krüppel-like factor mutations[J]. Clin Genet, 2015, 88(1): 56-61. DOI:10.1111/cge.12443 |
| [11] |
Rujito L, Basalamah M, Siswandari W, et al. Modifying effect of XmnI, BCL11A, and HBS1L-MYB on clinical appearances:A study on β-thalassemia and hemoglobin E/β-thalassemia patients in Indonesia[J]. Hematol Oncol Stem Cell Ther, 2016, 9(2): 55-63. DOI:10.1016/j.hemonc.2016.02.003 |
| [12] |
Belhoul KM, Bakir ML, Saned MS, et al. Serum ferritin levels and endocrinopathy in medically treated patients with β thalassemia major[J]. Ann Hematol, 2012, 91(7): 1107-1114. DOI:10.1007/s00277-012-1412-7 |
| [13] |
Skordis N, Kyriakou A. The multifactorial origin of growth failure in thalassaemia[J]. Pediatr Endocrinol Rev, 2011, 8 Suppl 2: 271-277. |
| [14] |
Musallam KM, Rivella S, Vichinsky E, et al. Non-transfusion-dependent thalassemias[J]. Haematologica, 2013, 98(6): 833-844. DOI:10.3324/haematol.2012.066845 |
 2019, Vol. 40
2019, Vol. 40