文章信息
- 黄卓英, 孙晓冬, 刘捷宸, 李智, 任佳, 吴琳琳, 胡家瑜, 张军楠.
- Huang Zhuoying, Sun Xiaodong, Liu Jiechen, Li Zhi, Ren Jia, Wu Linlin, Hu Jiayu, Zhang Junnan.
- 不同毒株脊髓灰质炎灭活疫苗开展序贯免疫程序接种的安全性观察
- Observation on safety of sequential vaccination schedule of different strain inactivated poliovirus vaccines
- 中华流行病学杂志, 2019, 40(5): 565-570
- Chinese Journal of Epidemiology, 2019, 40(5): 565-570
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.05.014
-
文章历史
收稿日期: 2018-11-06
2. 北京市朝阳区疾病预防控制中心生物制品科 100021
2. Department of Biological Product, Chaoyang District Center for Disease Control and Prevention, Beijing 100021, China
脊髓灰质炎俗称小儿麻痹症,严重危害儿童健康[1-2]。脊髓灰质炎灭活疫苗(inactivated poliovirus vaccines,IPV)免疫接种是消灭脊髓灰质炎最有效的措施。为响应WHO《2013-2018年全球消灭脊髓灰质炎终结计划》[3],我国从2016年起将1剂IPV引入儿童免疫规划,2016年5月上海市率先在全市范围内将2剂IPV纳入儿童免疫规划。国产与进口的IPV所用毒株不同,国内外尚缺乏大规模人群使用不同毒株IPV疫苗序贯免疫程序的安全性研究。本研究通过观察不同毒株IPV开展序贯免疫后的不良反应,为进一步完善IPV免疫策略提供参考。
材料与方法1.疫苗:①Sabin株IPV(inactivated poliomyelitis vaccine made from sabin strains,sIPV)由中国医学科学院医学生物学研究所生产。②野毒株IPV(wild strains IPV,wIPV)由法国赛诺菲巴斯德生物制品有限公司生产。③Ⅰ+Ⅲ型脊髓灰质炎减毒活疫苗(Bivalent Types Ⅰ and Ⅲ Oral Poliomyelitis Vaccine,bOPV)由北京天坛生物制品股份有限公司生产。疫苗在有效期内使用。运输保存温度、接种途径和注射方法遵照《预防接种工作规范(2016年版)》[4]和说明书[5-7]。
2.研究对象:
(1)入组标准:在首次研究访视当天满2月龄;获得父母或其他法定监护人的书面知情同意书;根据工作人员的意见,遵守研究方案的要求;符合疫苗说明书要求。排除标准:之前接种过IPV,或在IPV接种前7 d内接种其他疫苗;已知对该疫苗所含任何成分过敏者;患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者;存在其他禁忌证不宜接种IPV者;根据工作人员的判断,有可能影响评估的任何情况。
(2)试验分组:分为4组:①sIPV+sIPV+bOPV;②sIPV+wIPV+bOPV;③wIPV+sIPV+ bOPV;④wIPV+wIPV+bOPV。
(3)样本量估算:本研究为等效性试验[8],采用公式n=2P×(100-P)×f(α,β)/d2。其中α=0.05,β=0.1,d代表可接受的差异(取10%),P代表不良反应率,f是根据一类和二类错误值所确定的常数,按上海市既往研究,取26%,各组分配比例按1:1:1:1,计算所得各组需404人,按最高15%失访率计算,每组至少需入组476人。
3.研究方法:本研究为一项开放、多组、观察性研究。研究对象在2、3月龄时接种IPV,4月龄时接种bOPV,在每次接种后现场观察30 min,记录所有的不良事件。研究对象为每名受种者,在接种每剂IPV后另需接受4次电话访视和1次现场访视,了解研究对象接种疫苗后不良事件的发生情况。
现场访视:第1次,体格检查,接种第1剂IPV,现场留置观察至少30 min,研究对象的父母或其他监护人在接种后连续8 d测量研究对象的腋下体温和局部反应,在日记卡上记录接种疫苗后30 d内发生的事件信息(包括接种后0~7 d的不良事件,以及30 d内的非征集性不良事件);第2、3次,检查、核对、回收上次发放的日记卡,体格检查,接种IPV;第4次,检查、核对、回收上次发放的日记卡。
电话访视:每次接种后的24 h、第3天、第7天、第14天进行电话随访,提醒研究对象父母或其他监护人将不良事件信息记录到日记卡上。若电话失访,则研究人员继续联系至接通电话为止。
本研究中使用的日记卡、数字体温计和尺由研究者统一提供,有第三方的质检报告,并在发放前指导使用方法。
研究方案及相关文件通过上海市CDC伦理委员会的审查和批准(编号:2016-24)。所有受试者的父母或其他监护人签署书面知情同意书。
4.收集信息的定义和分类:不良事件指临床研究受试者在接种疫苗后发生的任何不利的医学事件,不一定与接种疫苗有因果关系,分为征集性和非征集性不良事件。征集性不良事件是在日记卡上预先列出的反应,包括注射部位反应(疼痛、硬结、红、肿)和全身反应(发热、呕吐、异常哭闹、嗜睡、食欲下降、易激惹、腹泻、咳嗽)。非征集性不良事件指在日记卡上未预先列出的不良事件。严重不良事件指死亡、威胁生命状况、住院、永久性或显著的残疾或功能丧失、重要的医疗事件。不良事件的严重程度分级评估标准参见《预防用疫苗临床试验不良反应严重程度标准指导原则》[9]。
5.统计学分析:采用SPSS 20.0软件统计。收集的信息均登记在病例报告表(Case Report Form,CRF)上,经复核后录入数据库,并通过计算机的逻辑和一致性检验进行质量控制。描述每次注射后至30 d发生注射部位或者全身不良事件的观察对象数量、构成比(%)及95%CI按Clopper-Pearson法计算。报告发生率的比较采用Pearson χ2检验法或Fisher确切概率法。计量资料组间比较采用多样本均数方差分析法。双侧检验,以P<0.05为差异有统计学意义。
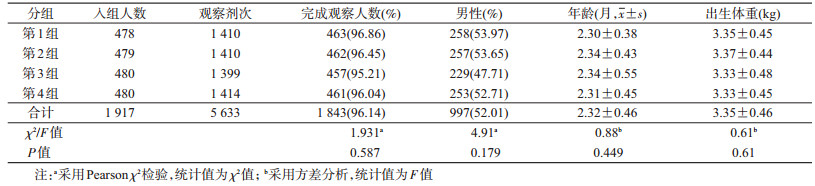
结果1.基本情况:2017年3月至2018年5月共筛选2 473人,经体检、询问符合入组标准并签署知情同意的有1 917人,应答率77.52%(1 917/2 473)。1 843人完成全程研究,依从率96.14%(1 843/1 917),失访者均与不良事件无关,各组间依从率差异无统计学意义。入组对象中,男性占52.01%(997/1 917),汉族占98.17%(1 882/1 917),各组性别、入组月龄、出生体重等方面均衡可比。于2018年9月完成全部访视工作。见表 1。
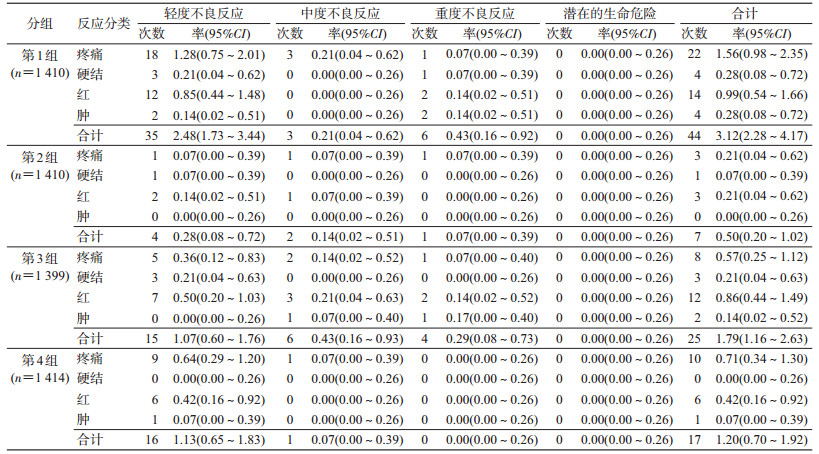
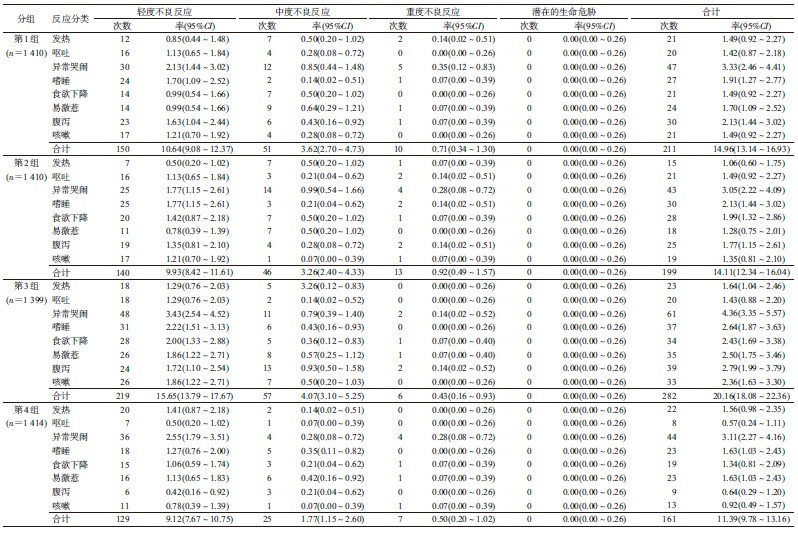
2.接种后0~30 d征集性不良事件报告情况:本研究共随访接种5 633剂次后的不良事件。4组完成3剂基础免疫接种后,总的不良事件发生率为16.79%(946/5 633)。所有不良事件均痊愈。在整个观察期间无严重不良事件报告。
接种后30 min内,共报告24例不良事件,各组均有报告。16例发生在接种第1剂后。3例轻度发热,1例全身皮疹,1例轻度异常哭闹,其余19例均为注射部位轻度或中度反应。
接种后0~30 d,局部反应率为1.65%(93/5 633),其中重度反应率为0.20%(11/5 633)。局部反应主要症状依次为注射部位疼痛、红、硬结和肿。局部的重度反应出现在:第1、2、3组各1例疼痛(持续1~2 d,均未接受治疗、未用药);第1组和第3组各2例红(最大直径35~65 mm,持续0~1 d,1例自用药治疗);第1组2例和第3组1例肿(最大直径30~60 mm,持续1 d,1例自用药治疗);第1组1例硬结(最大直径35 mm,持续1 d,自用药治疗),其余均为轻度或中度反应。各组局部反应率第1组最高,各组间差异有统计学意义(χ2=32.242,P<0.01);中度反应率差异无统计学意义(χ2=4.749,P=0.191);重度反应率第1组最高,各组间差异有统计学意义(χ2=8.311,P=0.024)。
接种后0~30 d,全身反应率为15.14%(853/5 633),其中重度反应率为0.64%(36/5 633)。全身反应主要症状依次为异常哭闹、嗜睡、腹泻、食欲下降、易激惹、咳嗽、发热和呕吐。全身的重度反应出现在:第1组报告10例(其中异常哭闹5例,发热2例,嗜睡、易激惹和腹泻各1例),第2组13例(其中异常哭闹4例,嗜睡、腹泻和呕吐各2例,发热、食欲下降和咳嗽各1例),第3组6例(异常哭闹和腹泻各2例,食欲下降、易激惹各1例),第4组7例(异常哭闹4例,食欲下降、易激惹和咳嗽各1例),其余均为中度或轻度反应。各组全身反应率第3组最高,各组间差异有统计学意义(χ2=44.103,P<0.01);中度反应率差异无统计学意义(χ2=13.706,P=0.003);重度反应率差异无统计学意义(χ2=3.322,P=0.345)。第1剂全身反应率报告最高。
全身不良事件报告发生率较注射部位不良事件高。各组间征集性不良事件的重度反应率差异无统计学意义(χ2=4.175,P=0.243)。见表 2,3。
3.接种后0~30 d非征集性不良事件报告情况:接种后0~30 d报告非征集性不良事件27例,均为1级或2级。未报告与接种有关的反应。接种后30 min留置观察时间内无非征集性不良事件报告。报告较多的非征集性不良事件是偶合上呼吸道感染(11例,占40.74%),其余为偶合湿疹、鹅口疮等。
讨论上海市率先将2剂IPV纳入儿童免疫规划,而且供应的IPV生产工艺不同,使用不同毒株生产。本研究对使用不同毒株IPV开展序贯免疫接种的安全性进行了评价。1 917名儿童在2、3、4月龄开展了不良反应主动观察,其中96.14%完成了全程基础免疫接种,观察对象依从性良好。
2017年上海市接种IPV 74.5万剂,报告疑似预防接种不良反应1 007例,不良事件发生率为534.1/10万;本研究总的不良事件发生率为16.79%,报告敏感性高于本市同期开展的被动观察(P<0.01)。本研究中使用的sIPV为国产新疫苗,不良事件发生率相似或不同于部分国内外对于wIPV开展的研究[10-13]。石晓娟[10]的序贯免疫程序研究结果中接种1剂sIPV后不良事件发生率低于本研究,但该研究对调查对象在接种后的电话随访时间与本研究不同;本研究除电话随访外,还将不良事件信息登记于日记卡,增加了报告敏感性。叶慧等[11]的研究结果高于本研究,对于全程免疫28 d后发生的不良事件继续采取定期随访和主动报告相结合方式纳入收集范围;而本研究主动收集接种后0~30 d内的不良事件,之后开展被动观察;两项研究的对象纳入标准、收集事件的种类亦不同。
本研究报告接种后1个月内发生的27例非征集性反应均为婴儿常见疾病或症状。在主动观察期外的其他时间,对研究对象开展常规被动观察,截至2018年12月31日无严重异常反应报告。
本研究各组研究对象全身和局部反应率均以轻度反应为主,未观察到严重局部或全身反应发生。虽然局部重度反应率各组不尽相同,但各组间局部和全身反应合计的重度反应率差异无统计学意义。同时或交替使用不同毒株IPV开展序贯免疫程序对于适龄儿童均具有良好的预防接种安全性。
1988年世界卫生大会确定全球消灭脊髓灰质炎的目标[14],推动免疫策略转换是今后维持无脊髓灰质炎重点工作。本研究评价使用2剂IPV序贯免疫程序的安全性,注射部位和全身不良事件发生率均处于较低水平,且均多为轻度;第2剂IPV局部和全身反应的发生率均低于第1剂IPV。显示“2剂IPV+2剂bOPV”序贯免疫程序具有良好的安全性。
本研究存在不足。观察持续时间短暂,一些反应可能无法在短期的主动观察中得到报告;本研究仅为小样本的观察。建议采取被动观察的方式继续开展监测工作,并加强监测的规范性和敏感性,以提供更为详尽的安全性数据。
综上所述,不同毒株IPV开展序贯免疫程序接种的相关不良事件以全身和注射部位的轻度反应为主,所有反应均痊愈,未观察到严重不良事件。同时或交替使用sIPV和wIPV开展序贯免疫程序具有良好的安全性。
利益冲突 所有作者均声明不存在利益冲突
志谢 上海市各区CDC有关工作人员在本研究中给予积极配合和协助
| [1] |
顾方舟. 脊髓灰质炎[M]. 上海: 上海科学技术出版社, 1984: 1. Gu FZ. Poliomyelitis[M]. Shanghai: Shanghai Scientific and Technical Publishes, 1984: 1. |
| [2] |
WHO. Poliomyelitis: fact sheets[EB/OL]. (2018-01-03)[2018-10-01].https://www.who.int/news-room/fact-sheets/detail/poliomyelitis.
|
| [3] |
Polio eradication and endgame strategic plan 2013-2018[EB/OL]. (2013-02-01)[2018-10-01]. http://polioeradication.org/who-we-are/strategy/.
|
| [4] |
中华人民共和国卫生和计划生育委员会.预防接种工作规范(2016年版)[EB/OL]. (2016-12-06)[2018-10-01]. http://www.chinacdc.cn/yw_9324/201702/t20170208_137929.html. National Health and Family Planning Commission of the People's Republic of China. Guideline of immunization technique(2016)[EB/OL]. (2016-12-06)[2018-10-01]. http://www.chinacdc.cn/yw_9324/201702/t20170208_137929.html. |
| [5] |
中国医学科学院医学生物学研究所. Sabin株脊髓灰质炎灭活疫苗(Vero细胞)说明书[Z].国家食品药品监督管理总局核准, 2015. Institute of Medical Biology, Chinese Academy of Medical Sciences. Prescribing infomation of inactivated poliomyelitis vaccine made from Sabin strains (Vero cells)[Z]. Approved by CFDA, 2015. |
| [6] |
赛诺菲巴斯德生物制品有限公司.脊髓灰质炎灭活疫苗说明书[Z].国家食品药品监督管理总局核准, 2014. Sanofi Pasteur SA Co. Ltd. Prescribing infomation of poliomyelitis vaccine (Inactivated)[Z]. Approved by CFDA, 2014. |
| [7] |
北京天坛生物制品股份有限公司.口服Ⅰ型Ⅲ型脊髓灰质炎减毒活疫苗(人二倍体细胞)说明书[Z].国家食品药品监督管理总局核准, 2015. Beijing Tiantan Biological Products Co. Ltd. Prescribing infomation of poliomyelitis (Live) vaccine type Ⅰ type Ⅲ(Human Diploid Cell), Oral[Z]. Approved by CFDA, 2015. |
| [8] |
刘建平. 临床试验样本含量的计算[J]. 中国中西医结合杂志, 2003, 23(7): 536-538. Liu JP. Calculation of sample contents in clinical trials[J]. Chin J Integr Tradit West Med, 2003, 23(7): 536-538. DOI:10.3321/j.issn:1003-5370.2003.07.017 |
| [9] |
国家食品药品监督管理总局.预防用疫苗临床试验不良反应分级标准指导原则[EB/OL]. (2005-10-14). http://samr.cfda.gov.cn/WS01/CL1616/83435.html. China Food and Drug Administration. Guideline for rating scales of adverse reaction of clinical trials of preventive vaccines[EB/OL]. (2005-10-14). http://samr.cfda.gov.cn/WS01/CL1616/83435.html. |
| [10] |
石晓娟.国产脊髓灰质炎疫苗序贯接种基础免疫效果及安全性评价[D].银川: 宁夏医科大学, 2017: 29-31. Shi XJ. The evaluation on the efficacy and safety of sequential immunization with domestic polio vaccine[D]. Yinchuan: Ningxia Medical University, 2017: 29-31. http://cdmd.cnki.com.cn/Article/CDMD-10752-1017839170.htm |
| [11] |
叶慧, 黄腾, 英志芳, 等. Sabin株脊髓灰质炎灭活疫苗与不同剂型Ⅰ+Ⅲ型脊髓灰质炎减毒活疫苗序贯接种的免疫原性和安全性比较[J]. 中华预防医学杂志, 2018, 52(1): 43-49. Ye H, Huang T, Ying ZF, et al. Comparing the immunogenicity and safety of sequential inoculation of sIPV followed by bOPV (Ⅰ+Ⅲ) in different dosage forms[J]. Chin J Prev Med, 2018, 52(1): 43-49. DOI:10.3760/cma.j.issn.0253-9624.2018.01.009 |
| [12] |
张朱佳子, 李娟, 王海红, 等. 脊髓灰质炎灭活疫苗和减毒活疫苗不同序贯免疫程序基础免疫安全性观察[J]. 中华预防医学杂志, 2013, 47(10): 910-915. Zhang ZJZ, Li J, Wang HH, et al. Safety of different sequential immunization schedules of inactivated poliovirus vaccine and oral poliovirus vaccine primary vaccination[J]. Chin J Prev Med, 2013, 47(10): 910-915. DOI:10.3760/cma.j.issn.0253-9624.2013.10.019 |
| [13] |
WHO. Polio vaccines: WHO position paper[EB/OL]. (2016-03-25)[2018-09-01]. https://www.who.int/immunization/documents/positionpapers/en/.
|
| [14] |
WHO. Global eradication of poliomyelitis by the year 2000[R]. Geneva: World Health Assembly, 1988.
|
 2019, Vol. 40
2019, Vol. 40