文章信息
- 李敏敏, 李超, 张彬艳, 武文涛, 高翔宇, 吴晨璐, 党少农, 颜虹.
- Li Minmin, Li Chao, Zhang Binyan, Wu Wentao, Gao Xiangyu, Wu Chenlu, Dang Shaonong, Yan Hong.
- 陕西省育龄妇女围孕期用药与新生儿早产关系的研究
- Relationship between preterm birth of infant and medication during pregnancy in women of childbearing age in Shaanxi
- 中华流行病学杂志, 2019, 40(5): 554-558
- Chinese Journal of Epidemiology, 2019, 40(5): 554-558
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.05.012
-
文章历史
收稿日期: 2018-10-22
早产是指从末次月经周期算起,孕龄<37周或259 d的分娩[1]。早产是引起围产儿死亡、近远期并发症的主要原因之一,并且给家庭和社会都会带来巨大的经济负担[2-5]。从长远来看,早产对整个生命过程的医疗、心理、行为等社会活动有着长期的影响[6-10]。WHO数据显示,2016年全世界至少有1 500万早产儿出生[11],且近年来早产发生率有上升趋势。药物使用一方面可以改变或查明机体的生理功能及病理状态,用以预防、诊断和治疗疾病,另一方面若使用不当又会对机体产生毒害作用,损害人体健康。目前,国内外的研究主要集中在药物预防新生儿早产的发生方面[12-14],而妊娠期药物使用与新生儿早产关系的相关研究较少。本研究通过对2010-2013年陕西省曾经妊娠的育龄妇女进行调查,分析妊娠期用药与新生儿早产的关系,为降低新生儿早产的发生风险提供依据。
对象与方法1.研究对象:源自于2013年7-12月开展的陕西省出生缺陷危险因素横断面调查中2010-2013年曾经怀孕且妊娠结局明确的18~49岁当地常住(当地户籍或在当地居住时间>12个月)育龄妇女及其子女。
2.调查方法:本研究为分层多阶段随机抽样的横断面调查研究。
(1)抽样方法:即根据城乡比例,同时考虑人口密集度和生育水平,采用完全随机抽样法,先从陕西省随机抽取10个城区和20个县,再从抽样县中抽取6个乡,从被抽中的城区抽取3个街道办;之后,从被抽中的乡镇或街道中抽取6个村或社区;从被抽中的村抽取30名符合条件的育龄妇女,当抽取村符合条件的育龄妇女不足30名时,则全部纳入调查,再从邻村(距离最近的非抽样村)抽取育龄妇女补足;从被抽中的社区抽取60名符合条件的育龄妇女,当被抽中社区符合条件的育龄妇女不足时,则全部纳入调查,再从相邻社区(距离最近的非抽样社区)抽取育龄妇女补足。
(2)样本含量:本次调查根据目前中国出生缺陷发生率100/万估计,并考虑到10%的失访率,估计样本量为30 000人。实际调查过程中共发放问卷30 027份。根据研究目的将家庭基本情况信息、药敏史、围孕期患病和用药情况不详者、新生儿出生孕周不明确者排除后,共纳入28 841份有效问卷,问卷有效回收率为96.1%。
(3)纳入标准:为在2010-2013年曾怀孕且末次怀孕结局明确为单胎、活产的18~49岁当地常住育龄妇女及其子女;无重大疾患;愿意参加本项研究;在调查员的指导下能够独立完成问卷填写者。本次研究中排除了:①家庭基本信息情况填写不完整者;②育龄妇女药物过敏史、围孕期患病和药物使用情况不明确者;③新生儿出生信息不明确者。
(4)质量控制:本次调查采用面对面问卷调查的方式收集育龄妇女的社会人口学信息、生活行为与心理状况、围孕期疾病与用药情况、生育史及孕产期保健等资料。选择西安交通大学公共卫生学院的硕士研究生及本科生为调查员,经统一严格培训,熟练掌握询问技巧及调查表各项的填写要求;调查前与调查对象签订知情同意;现场调查中及时审核问卷,采取自查、交换检查、负责人全面检查的方式,发现遗漏的项目、书写错误和逻辑错误及时更正;采用双录入法对数据进行录入,核对数据并进行逻辑检查,发现有问题的数据及时检查原始记录进行校正。
3.指标定义:①早产是指从孕妇末次月经周期首日算起,孕龄<37周或259 d的分娩。②母亲围孕期用药指从孕前3个月至分娩期间服用过任意种类的药物[15]。本研究将围孕期使用药物类型分为感冒药、抗生素、激素类药物、水杨酸类药物、镇咳药、抗真菌药、抗高血压药及其他药共8类[16],其中感冒药主要包括感冒灵颗粒、双黄连口服液、板蓝根冲剂、银翘片/颗粒、小柴胡颗粒及其他名称不详的感冒药等,其他药物主要包括成分不详的中药或中成药、胃药、抗过敏药、成分不详的输液等。
4.统计学分析:采用EpiData 3.1软件进行数据双录入和逻辑纠错。采用SAS 9.4软件进行统计学分析、Stata 14.0软件进行作图,对资料进行一般描述时,计数资料的描述采用例数和百分比,计量资料采用x±s描述,以每百名活产的出生结局中早产例数计算新生儿早产患病率。采用多阶段复杂抽样logistic回归模型,在控制混杂因素后分析围孕期用药与新生儿早产的关系。检验水准α=0.05。
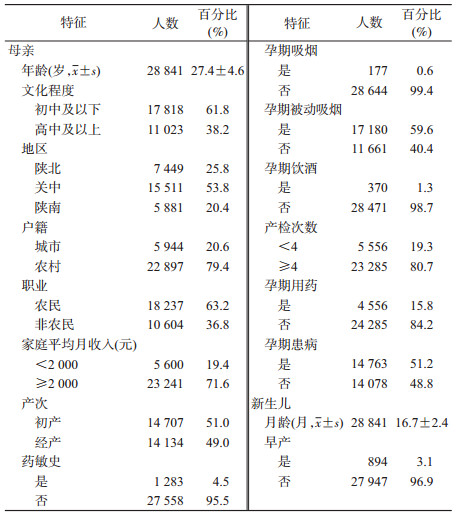
结果1.一般情况:本次研究共纳入28 841名育龄妇女及其子女。研究对象年龄为(27.4±4.6)岁,其中22 897名来自农村,围孕期用药者达15.8%。新生儿月龄为(16.7±2.4)月(表 1),陕西省2010-2013年育龄妇女末次妊娠所生子女早产发生比例为2.7%,历年早产发生比例分别为2.7%、2.9%、2.8%和2.6%。
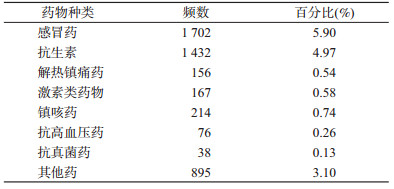
2.围孕期用药情况:在28 841例研究对象中,妊娠期曾使用过药物的母亲共4 556例(15.8%),未使用药物者24 285例。其中妊娠期使用感冒药者最多为1 702例、其次为抗生素1 432例、其他药895例、镇咳药214例、激素类药物167例、解热镇痛药156例、抗高血压药78例、抗真菌药38例。见表 2。
3.早产相关危险因素分析:应用分层多阶段抽样资料的多层logistic回归模型分析,以新生儿是否早产为因变量,以母亲生育年龄、文化程度、地区、户籍、职业、家庭平均月收入、产次、药物过敏史、产检次数、围孕期吸烟、被动吸烟、饮酒、用药、患病和新生儿性别等为自变量进行多因素logistic回归分析。结果显示:进入该模型的研究对象为28 841例,模型拟合效果较好(拟合优度检验:χ2=74.8,P>0.05,AIC=7 995.2)。相比陕北地区居住的孕妇居住在陕南地区(OR=1.50,95%CI:1.22~1.85)的孕妇是发生早产的危险因素。与无药物过敏史者比有药物过敏史者(OR=1.37,95%CI:1.02~1.84)、与围孕期未用药者相比围孕期用药者(OR=1.56,95%CI:1.29~1.87)是发生早产的危险因素。
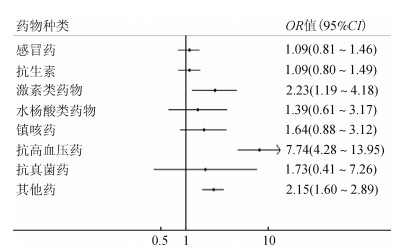
在控制了研究对象基本人口学特征、孕期吸烟、被动吸烟、饮酒、患病及新生儿性别后母亲围孕期使用药物种类与新生儿早产的多因素回归结果显示:母亲围孕期使用激素类药物者生育早产儿的风险是未使用者的2.23倍(OR=2.23,95%CI:1.19~4.18)、使用抗高血压药物者生育早产儿的风险是未使用者的7.74倍(OR=7.74,95%CI:4.28~13.95)、使用其他药物者生育早产儿的风险是未使用者的2.15倍(OR=2.15,95%CI:1.60~2.89),见图 1。
|
| 图 1 围孕期使用药物种类与新生儿早产关系的logistic回归分析 |
目前国内外有关围孕期使用药物预防早产发生的研究较多,而有关围孕期使用药物种类与早产发生关系的研究较少,因此本研究对陕西地区母亲围孕期服用的各种药物与新生儿早产之间的关系进行了探索研究,旨在填补该部分研究的空白。本研究调查范围涉及陕西省10区20县,共纳入28 841例母亲及其子女作为研究对象,发现陕西省活产单胎新生儿早产发生的比例为2.7%。调查结果显示2010-2013年陕西省妊娠期曾使用过药物的孕妇为4 556例,占15.8%。本研究中母亲围孕期药物的使用率低于国外研究报道的19.5%[17]。可能是由于本次调查的时间距离母亲围孕期已有一定的时间间隔,存在回忆偏倚,导致药物使用率降低。
陕西省新生儿早产影响因素的logistic回归分析结果显示,母亲的所在地区、药物过敏史和围孕期用药等与新生儿早产的发生有关。这可能是由于陕南和陕北地区在地里环境饮食习惯等方面都存在明显差异,从而导致这两个地区妇女在怀孕期间的身体状况,体内孕酮含量等也存在较大差异。本次研究结果发现有药敏史的孕妇发生早产的风险较无药敏史的孕妇大,这可能是由于存在药物过敏的个体大多数都属于过敏体质,其机体对外界的刺激较为敏感,当其在孕期接触不良影响因素后易发生自发性早产。
在控制混杂因素后,多因素logistic回归分析显示,陕西地区妇女围孕期使用激素类药物是发生早产的危险因素,与过往研究发现的孕期服用小剂量孕激素可有效预防早产发生的结论不一致[18-19],而Haas和Ramsey[20]的研究发现孕期补充孕激素对预防早产的发生没有意义。这可能是由于不同剂量的激素在孕期会对孕妇的体液调节产生及其子女的发育产生截然不同的效果,甚至早产及出生缺陷等不良后果。Ahmed等[21]研究发现孕早期使用抗高血压类药物与早产的发生存在显著关联,与本研究结果相似,围孕期使用抗高血压类药物的孕妇其新生儿早产发生的风险是未使用者的7.74倍。
由于妊娠期是一个特殊的生理时期,且药物作为一种特殊的物质,一方面可以用于预防、诊断和治疗疾病;另一方面若使用不当即可成为毒物,对机体产生毒害作用,在损害母体健康的同时也会对胎儿的发育产生不良影响,甚至导致早产的发生。本研究显示母亲围孕期用药特别是使用激素类药物和抗高血压药会导致早产的发生,所以母亲围孕期服用药物应及时咨询医生,在医生的指导下服用药物。如果发生了意外服药,医生在评估药物风险时会全面考虑药物种类、药物代谢时间、使用药物的孕周,为孕妇提供更加准确的风险评估,从而避免孕妇因自行服药而造成新生儿早产。因此为降低新生儿早产的发生,孕妇在用药时,既要考虑到药物的治疗作用,同时也要考虑对胎儿的副作用,倡导合理用药,推崇优生优育。
本次研究的优势在于其是基于陕西省城乡比例并考虑人口密集度和生育水平而进行的一次大规模多阶段分层随机抽样调查,极大程度的降低了医院病历报告及检测数据结果的偏倚。但由于本次调查为回顾性调查,因此回忆偏倚难以避免。本研究中围孕期用药指从妇女孕前3个月至分娩期间服用过任意种类的药物,由于各种药物的使用人数较少,因此未对妇女围孕期用药情况进行详细分组,后续可按具体服药时间进行进一步亚组分析。本调查属于横断面调查,其结果只能进行现况分析,初步探讨早产的危险因素,无法确定因果关系。
早产的药物致病因素及机制目前仍不确定。本研究显示育龄妇女围孕期使用激素类药物、抗高血压药及其他药等均与早产的发生有关,因此应加强孕妇孕前及孕期用药宣传,提倡合理用药,避免滥用药物。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
WHO, 2016. Preterm birth[EB/OL]. (2018-02-19). http://www.who.int/mediacentre/factsheets/fs363/en/.
|
| [2] |
Goldenberg RL, Culhane JF, Iams JD, et al. Epidemiology and causes of preterm birth[J]. Lancet, 2008, 371(9606): 75-84. DOI:10.1016/S0140-6736(08)60074-4 |
| [3] |
Lawn JE, Gravett MG, Nunes TM, et al. Global report on preterm birth and stillbirth (1 of 7):definitions, description of the burden and opportunities to improve data[J]. BMC Pregnancy Childbirth, 2010, 10 Suppl 1: S1. DOI:10.1186/1471-2393-10-S1-S1 |
| [4] |
Wen SW, Smith G, Yang QY, et al. Epidemiology of preterm birth and neonatal outcome[J]. Semin Fetal Neonatal Med, 2004, 9(6): 429-435. DOI:10.1016/j.siny.2004.04.002 |
| [5] |
Soilly AL, Lejeune C, Quantin C, et al. Economic analysis of the costs associated with prematurity from a literature review[J]. Public Health, 2014, 128(1): 43-62. DOI:10.1016/j.puhe.2013.09.014 |
| [6] |
Bhutta AT, Cleves MA, Casey PH, et al. Cognitive and behavioral outcomes of school-aged children who were born preterm:A Meta-analysis[J]. JAMA, 2002, 288(6): 728-737. DOI:10.1001/jama.288.6.728 |
| [7] |
Allin M, Rooney M, Cuddy M, et al. Personality in young adults who are born preterm[J]. Pediatrics, 2006, 117(2): 309-316. DOI:10.1542/peds.2005-0539 |
| [8] |
Allin M, Rooney M, Griffiths T, et al. Neurological abnormalities in young adults born preterm[J]. J Neurol Neurosur Psych, 2006, 77(4): 495-499. DOI:10.1136/jnnp.2005.075465 |
| [9] |
Moster D, Lie RT, Markestad T. Long-term medical and social consequences of preterm birth[J]. N Engl J Med, 2008, 359(3): 262-273. DOI:10.1056/NEJMoa0706475 |
| [10] |
Yang SM, Platt RW, Kramer MS. Variation in child cognitive ability by week of gestation among healthy term births[J]. Am J Epidemiol, 2010, 171(4): 399-406. DOI:10.1093/aje/kwp413 |
| [11] |
Silver RM, Branch DW. Cervical pessary to prevent preterm birth[J]. JAMA, 2017, 318(23): 2299-2300. DOI:10.1001/jama.2017.18955 |
| [12] |
Andrikopoulou M, Purisch SE, Handal-Orefice R, et al. Low-dose aspirin is associated with reduced spontaneous preterm birth in nulliparous women[J]. Am J Obstet Gynecol, 2018, 219(4): 399. DOI:10.1016/j.ajog.2018.06.011 |
| [13] |
Krispin E, Hadar E, Chen R, et al. The association of different progesterone preparations with preterm birth prevention[J]. J Matern Fetal Neonat Meds, 2018, 26: 1-6. DOI:10.1080/14767058.2018.1465555 |
| [14] |
Cui YC, Zhu B, Zheng F. Low-dose aspirin at ≤ 16 weeks of gestation for preventing preeclampsia and its maternal and neonatal adverse outcomes:A systematic review and Meta-analysis[J]. Exp Ther Med, 2018, 15(5): 4361-4369. DOI:10.3892/etm.2018.5972 |
| [15] |
Mathews F, Yudkin P, Neil A. Folates in the periconceptional period:are women getting enough?[J]. Br J Obstet Gynaecol, 1998, 105(9): 954-959. DOI:10.1111/j.1471-0528.1998.tb10257.x |
| [16] |
戴芹. 孕期易对胎儿产生不良影响的药物[J]. 黑龙江医学, 2002, 26(12): 931-932. Dai Q. The drug that is easy to affect the fetus during pregnancy[J]. Heilongjiang Med J, 2002, 26(12): 931-932. DOI:10.3969/j.issn.1004-5775.2002.12.019 |
| [17] |
Cleary BJ, Butt H, Strawbridge JD, et al. Medication use in early pregnancy-prevalence and determinants of use in a prospective cohort of women[J]. Pharmacoepidemiol Drug Saf, 2010, 19(4): 408-417. DOI:10.1002/pds.1906 |
| [18] |
de Franco EA, O'Brien JM, Adair CD, et al. Vaginal progesterone is associated with a decrease in risk for early preterm birth and improved neonatal outcome in women with a short cervix:a secondary analysis from a randomized, double-blind, placebo-controlled trial[J]. Ultrasound Obstet Gynecol, 2007, 30(5): 697. DOI:10.1002/uog.5159 |
| [19] |
Shambhavi S, Bagga R, Bansal P, et al. A randomised trial to compare 200 mg micronised progesterone effervescent vaginal tablet daily with 250 mg intramuscular 17 alpha hydroxy progesterone caproate weekly for prevention of recurrent preterm birth[J]. J Obstet Gynaecol, 2018, 38(6): 800-806. DOI:10.1080/01443615.2018.1425380 |
| [20] |
Haas DM, Ramsey PS. Progestogen for preventing miscarriage[M]//The Cochrane Library. John Wiley & Sons, Ltd, 2003: CD003511. DOI: 10.1002/14651858.CD003511.pub2.
|
| [21] |
Ahmed B, Tran DT, Zoega H, et al. Maternal and perinatal outcomes associated with the use of renin-angiotensin system (RAS) blockers for chronic hypertension in early pregnancy[J]. Preg Hypertens, 2018, 14: 156-161. DOI:10.1016/j.preghy.2018.09.010 |
 2019, Vol. 40
2019, Vol. 40