文章信息
- 赵丹, 林海江, 魏倩, 陈潇潇, 宁晨曦, 乔晓彤, 许圆圆, 沈伟伟, 丁盈盈, 何纳.
- Zhao Dan, Lin Haijiang, Wei Qian, Chen Xiaoxiao, Ning Chenxi, Qiao Xiaotong, Xu Yuanyuan, Shen Weiwei, Ding Yingying, He Na.
- HIV感染者线粒体单倍群与神经认知障碍的关联研究
- Association between mitochondrial haplogroups and neurocognitive disorder in HIV positive individuals
- 中华流行病学杂志, 2019, 40(5): 505-509
- Chinese Journal of Epidemiology, 2019, 40(5): 505-509
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.05.003
-
文章历史
收稿日期: 2018-12-20
2. 台州市疾病预防控制中心 318000
2. Taizhou Prefectural Center for Disease Control and Prevention, Taizhou 318000, China
HIV感染者易患有神经认知障碍(neurocognitive disorders,NCD),主要表现为获得性认知功能缺损、记忆力、注意力、处理信息的速度、精细运动功能障碍[1]。自广泛开展抗病毒治疗以来,严重NCD的患病率已经明显降低,但轻度NCD的患病率依然很高[1]。浙江省、云南省和安徽省HIV感染者NCD患病率为40%,高于普通人群[2-3]。HIV侵染可直接导致感染者发生NCD,其并发症如心血管疾病和慢性免疫反应也可加剧NCD的发生[2]。
线粒体是重要的细胞器,在产能、维持活性氧稳态和调控细胞凋亡方面发挥着重要的作用,同时它与三羧酸循环和β-氧化也有着复杂的联系[4]。线粒体也是人体细胞内唯一拥有独立基因组的细胞器,其基因组为双链DNA,全长约16 500碱基对(base pairs,bp)[5],可根据其核苷酸多态性进一步分为不同的单倍群(haplogroup)。研究发现线粒体单倍群与炎症、补体和凋亡基因的表达相关,其基因在免疫调节方面发挥着重要作用[6],而持续的炎症反应被认为是导致HIV感染者大脑功能损伤的主要原因[7]。外国已有研究对线粒体单倍群与HIV感染者的中枢神经病变和周围神经病变关联进行了探索,但结果并不一致[8-11]。目前,尚未见亚洲HIV感染者线粒体单倍群与NCD的关联研究报道。因此,根据线粒体基因突变与炎症反应的相关机制,以及国外已报道的线粒体单倍群与神经退行性疾病的关联,本研究通过研究特定线粒体单倍群是否会增加/降低HIV感染者NCD的发生,初步探索在中国HIV感染者中线粒体单倍群与NCD的关联。
对象与方法1.研究对象:2017年浙江省台州市开展“HIV与衰老相关疾病前瞻性队列研究”基线调查18~80周岁的HIV感染者,其中454例参加了2014-2015年“HIV感染者线粒体基因组单倍群分型研究”,剔除数据缺失者6例,纳入448例研究对象。研究对象均签署知情同意书。本研究获得复旦大学伦理委员会的审批。
2.数据收集:从我国艾滋病综合防治信息系统下载HIV/AIDS相关数据。人口学特征来自于基线调查问卷,由接受过培训的工作人员收集研究对象身高、体重和血压。生物学样本采集全血、血浆和外周血淋巴细胞富集液,用于线粒体基因测序。HIV确认试验采用免疫印迹法。
3. NCD的定义:采用简易精神状态量表(Mini-mental State Examination,MMSE)由接受过系统培训的当地CDC医务人员对HIV感染者进行面对面的神经认知问卷的测试。MMSE包含5个部分:定向力、记忆力、注意力和计算力、回忆能力、语言能力。符合下列标准的则判为NCD:①文盲,MMSE得分≤19;②小学文化程度,MMSE得分≤22;③初中及以上文化程度,MMSE得分≤26[12]。
4.线粒体DNA提取和测序:采用QIAamp DNA blood mini Kit(德国Qiagen Hilden有限公司)从外周血淋巴细胞中提取线粒体DNA。采用PCR法对线粒体基因进行全长扩增并测序[13-15]。用LA TaqTM Version 2.0 plus dye Kits(上海生工生物工程股份有限公司)进行PCR扩增。PCR扩增反应条件:94 ℃预变性1 min,98 ℃变性10 min,67 ℃退火及延伸5 min,共进行30个循环,72 ℃后延伸10 min,4 ℃保存。PCR产物送测序公司(上海生工生物工程股份有限公司)用47条内引物进行测序[13-15]。使用Sequencher 5.4软件(美国Gene Codes有限公司)对测序结果进行拼接,与修正的剑桥序列(revised Cambriage Reference Sequence,rCRS)[16]进行比对得到变异位点并使用Mito Tools[17]软件(www.mitotool.org)根据线粒体基因16版进化树(www.phylotree.org)进行线粒体单倍群的分型。
5.统计学分析:采用SAS 9.11软件进行统计分析。对于连续性变量,采用ANOVA检验,分类变量间率或构成比的比较采用χ2检验或Fisher确切概率法。单因素和多因素logistic回归分析用于检验线粒体单倍群和NCD的关联。双侧检验,以P<0.05为差异有统计学意义。
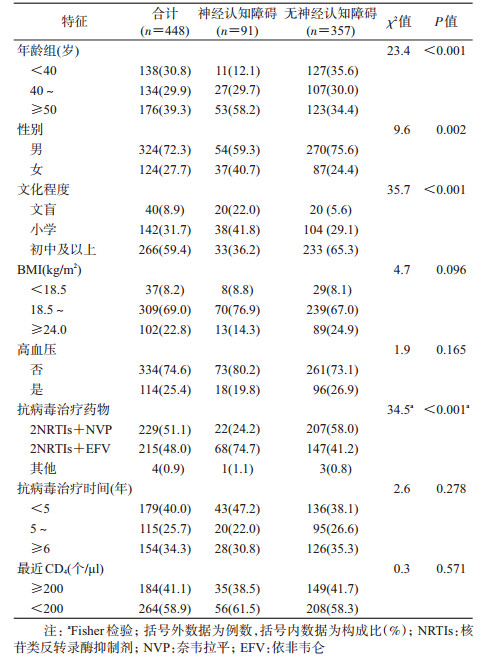
结果1.基本特征:448例研究对象中,≥50岁者占39.3%(176/448),男性占72.3%(324/448),初中及以上文化程度占59.4%(266/448)。最近CD4++T淋巴细胞计数(CD4+)<200个/μl的占58.9%(264/448),抗病毒治疗时间≥6年的占34.3%(154/448),见表 1。
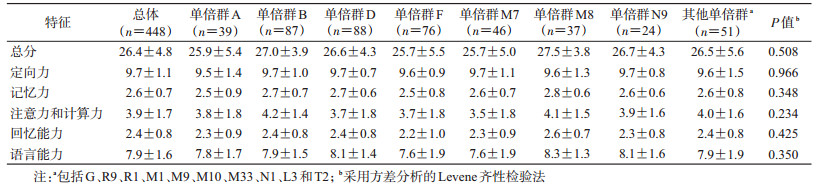
2.线粒体单倍群分布:线粒体单倍群D(19.6%)、B(19.4%)和F(17.0%)3个单倍群的人数最多。此外还包括单倍群A(8.7%)、M7(10.3%)、M8(8.3%,包括M8、亚单倍群C和Z)、N9(5.3%,包括亚单倍群N9a和Y),和“其他”单倍型群(11.4%,包括单倍群G、R9、R1、M1、M9、M10、M33、N1、L3和T2)。
3. NCD患病率及其影响因素:在448例HIV感染者中,NCD患病率为20.3%(91例)。不同年龄HIV感染者患NCD的风险不同,进行多因素logistic回归分析,调整控制潜在的混杂因素后,年龄40~49岁(aOR=2.3,95%CI:1.0~5.4,P=0.042)和≥50岁(aOR=3.4,95%CI:1.5~7.7,P=0.004)HIV感染者比<40岁的感染者更易患NCD;男性患NCD的风险低于女性(aOR=0.4,95%CI:0.2~0.7,P=0.003);初中及以上文化程度的感染者比文盲患NCD的风险低(aOR=0.3,95%CI:0.1~0.9,P=0.033);采用2NRTIs+NVP治疗方案的感染者比采用2NRTIs+EFV治疗方案的感染者患NCD的风险低(aOR=0.2,95%CI:0.1~0.4,P<0.001)。
4.线粒体单倍群与NCD关联分析:采用MMSE测量NCD,平均得分为26.4分(满分30分),其中线粒体单倍群B和M8得分最高。定向力平均得分为9.7分(满分10分),线粒体单倍群B、D、M7和N9得分较高;记忆力平均得分为2.6分(满分3分),线粒体单倍群B、D和M8得分较高;注意力和计算力平均得分为3.9分(满分5分),线粒体单倍群B和M8得分较高;回忆能力平均得分为2.4分(满分3分),线粒体单倍群M8得分较高;语言能力平均得分为7.9分(满分9分),线粒体单倍群D、M8和N9得分较高。综合总体平均分以及各项测试的平均分来看,线粒体单倍群为B和M8的HIV感染者神经认知测量结果较好。见表 2。
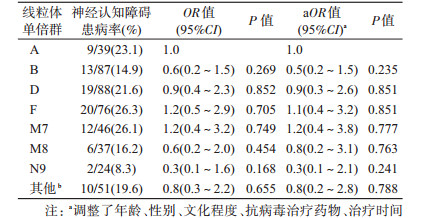
在本研究人群中,91名(20.3%)HIV感染者患NCD,其中属于线粒体单倍群A、D、F和M7的HIV感染者患NCD的比例较高,分别为23.1%、21.6%、26.3%和26.1%。调整年龄、性别、文化程度、抗病毒治疗药物、治疗时间和最低CD4+这些混杂因素后,多因素logistic回归分析结果显示,与线粒体单倍群A的感染者相比,单倍群B、D、F、M7、M8、N9及其他单倍群的HIV感染者的NCD患病率差异均无统计学意义。未发现线粒体单倍群与NCD存在关联。见表 3。
线粒体单倍群的分布有明显的地域和种族特异性,非洲人种单倍群以L3、L0、L2、L1为主,亚洲人种单倍群主要是A、B、M7、M8、D、F,欧洲人种单倍群主要是H、I、J、K、T、U、V、W[18-21]。本研究人群的线粒体单倍群分布与我国普通人群的单倍群分布一致[22]。
近年研究表明线粒体单倍群与寿命[23]、神经退行性疾病[24]、代谢性疾病和心血管疾病有关[25-26]。在HIV感染者中,仅在欧美和非洲人群中有少量研究,线粒体单倍群可能与代谢紊乱[27]、中枢和周围神经病变[8]以及AIDS疾病进程有关[28],但各研究结果并不一致。欧洲HIV感染者线粒体单倍群与脑脊液神经中枢炎性反应生物标志物表达不相关[8],但单倍群J是神经视网膜病变的保护因素[29]。本研究并未发亚洲HIV感染者现线粒体单倍群与NCD存在关联。可能原因包括本研究线粒体单倍群种类多、单一种类单倍群构成相对较少,导致统计分析效能相对不足;而不同研究中用于测量NCD的问卷有所不同,也会导致结果不同;同时,本研究为横断面研究,仅能提供线粒体单倍群与NCD之间的因果关联线索。
线粒体单倍群是人类进化后形成的独特变异位点的组合方式,因此不同单倍群间的个体在氧化磷酸化水平和细胞功能上具有差异,从而导致不同单倍群患同一疾病的风险不同。线粒体在氧化应激、炎症反应和细胞能量代谢中发挥着重要作用,脑功能的正常运转依赖于线粒体产能,且氧化应激[30]和炎症反应[31]与神经退行性病变机制密切相关,因此线粒体DNA突变可能在NCD的发展中发挥着重要的作用。线粒体单倍群与退行性疾病的关联为探索单倍群对神经认知的作用提供了重要依据[32]。在我国普通人群中,线粒体单倍群或与神经退行性疾病相关[33-34],但在HIV感染者中尚无此方面研究。
本研究发现,高年龄、女性和文化程度较低是HIV感染者患NCD的危险因素,与过往研究结果一致。最近研究发现美国的女性HIV感染者比男性更易患NCD且与人种有关[35];本课题组之前的横断面研究发现HIV感染、高年龄和文化程度较低是NCD的危险因素,而且年龄和HIV感染有交互作用[2]。国外有研究发现最近CD4+与神经认知相关[36],但本研究并未发现两者的关联。此外,本研究还发现,采用2NRTIs+EFV治疗方案的HIV感染者比采用2NRTIs+NVP的HIV感染者更易患NCD。NVP和EFV同属非核苷类反转录酶抑制剂(NNRTIs),且NVP比EFV的中枢神经系统渗透有效性高,NVP能更好地抑制脑脊液病毒复制,脑脊液病毒载量越低,神经认知受损就会得到改善[37]。抗病毒治疗显著降低了严重NCD的发生,但轻度NCD患病率仍然很高[1]。
本研究存在不足。本研究为横断面研究,故在确定因果联系时受到限制;其次,由于目前我国抗病毒治疗覆盖率已近90%且对HIV感染者实施“发现即治疗”的策略,本研究对象全部为接受抗病毒治疗的HIV感染者,缺少抗病毒治疗前HIV感染者的NCD测量,因此,无法比较HIV感染者中的抗病毒治疗者与未抗病毒治疗者的线粒体单倍群与NCD之间的关联。
综上所述,本研究初步探索了HIV感染者中线粒体单倍群与NCD之间的关联性,未发现线粒体单倍群与NCD存在关联,仍需要前瞻性队列研究进行分论证。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Heaton RK, Clifford DB, Franklin DR Jr, et al. HIV-associated neurocognitive disorders persist in the era of potent antiretroviral therapy:CHARTER study[J]. Neurology, 2010, 75(23): 2087-2096. DOI:10.1212/WNL.0b013e318200d727 |
| [2] |
Ding YY, Lin HJ, Shen WW, et al. Interaction effects between HIV and aging on selective neurocognitive impairment[J]. J Neuroimmune Pharmacol, 2017, 12(4): 661-669. DOI:10.1007/s11481-017-9748-3 |
| [3] |
Joseph J, Achim CL, Boivin MJ, et al. Global neuro AIDS roundtable[J]. J Neurovirol, 2013, 19(1): 1-9. DOI:10.1007/s13365-012-0143-9 |
| [4] |
Wallace DC. A mitochondrial paradigm of metabolic and degenerative diseases, aging, and cancer:a dawn for evolutionary medicine[J]. Annu Rev Genet, 2005, 39: 359-407. DOI:10.1146/annurev.genet.39.110304.095751 |
| [5] |
Côté HCF, Brumme ZL, Craib KJP, et al. Changes in mitochondrial DNA as a marker of nucleoside toxicity in HIV-infected patients[J]. N Engl J Med, 2002, 346(11): 811-820. DOI:10.1056/NEJMoa012035 |
| [6] |
Kenney MC, Chwa M, Atilano SR, et al. Inherited mitochondrial DNA variants can affect complement, inflammation and apoptosis pathways:insights into mitochondrial-nuclear interactions[J]. Hum Mol Genet, 2014, 23(13): 3537-3551. DOI:10.1093/hmg/ddu065 |
| [7] |
Clifford DB. HIV-associated neurocognitive disorder[J]. Curr Opin Infect Dis, 2017, 30(1): 117-122. DOI:10.1097/QCO.0000000000000328 |
| [8] |
Samuels DC, Kallianpur AR, Ellis RJ, et al. European mitochondrial DNA haplogroups are associated with cerebrospinal fluid biomarkers of inflammation in HIV infection[J]. Pathog Immun, 2016, 1(2): 330-351. DOI:10.20411/pai.v1i2.156 |
| [9] |
Azar A, Devlin K, Mell JC, et al. Mitochondrial haplogroup influences motor function in long-term HIV-1-infected individuals[J]. PLoS One, 2016, 11(10): e0163772. DOI:10.1371/journal.pone.0163772 |
| [10] |
Hulgan T, Samuels DC, Bush W, et al. Mitochondrial DNA haplogroups and neurocognitive impairment during HIV infection[J]. Clin Infect Dis, 2015, 61(9): 1476-1484. DOI:10.1093/cid/civ527 |
| [11] |
Kampira E, Kumwenda J, van Oosterhout JJ, et al. Mitochondrial DNA subhaplogroups L0a2 and L2a modify susceptibility to peripheral neuropathy in malawian adults on stavudine containing highly active antiretroviral therapy[J]. J Acquir Immune Defic Syndr, 2013, 63(5): 647-652. DOI:10.1097/QAI.0b013e3182968ea5 |
| [12] |
Zhang ZX, Zahner GEP, Román GC, et al. Socio-demographic variation of dementia subtypes in China:methodology and results of a prevalence study in Beijing, Chengdu, Shanghai, and Xian[J]. Neuroepidemiology, 2006, 27(4): 177-187. DOI:10.1159/000096131 |
| [13] |
Zhang AM, Hu QX, Liu F-L, et al. Mitochondrial DNA haplogroup a decreases the risk of drug addiction but conversely increases the risk of HIV-1 infection in Chinese addicts[J]. Mol Neurobiol, 2016, 53(6): 3873-3881. DOI:10.1007/s12035-015-9323-y |
| [14] |
Kong QP, Yao YG, Sun C, et al. Phylogeny of east asian mitochondrial DNA lineages inferred from complete sequences[J]. Am J Hum Genet, 2003, 73(3): 671-676. DOI:10.1086/377718 |
| [15] |
Wang HW, Jia XY, Ji YL, et al. Strikingly different penetrance of LHON in two Chinese families with primary mutation G11778A is independent of mtDNA haplogroup background and secondary mutation G13708A[J]. Mutat Res, 2008, 643(1/2): 48-53. DOI:10.1016/j.mrfmmm.2008.06.004 |
| [16] |
Andrews RM, Kubacka I, Chinnery PF, et al. Reanalysis and revision of the Cambridge reference sequence for human mitochondrial DNA[J]. Nat Genet, 1999, 23(2): 147. DOI:10.1038/13779 |
| [17] |
Fan L, Yao YG. An update to MitoTool:using a new scoring system for faster mtDNA haplogroup determination[J]. Mitochondrion, 2013, 13(4): 360-363. DOI:10.1016/j.mito.2013.04.011 |
| [18] |
Malhi RS, Eshleman JA, Greenberg JA, et al. The structure of diversity within new world mitochondrial DNA haplogroups:implications for the prehistory of North America[J]. Am J Hum Genet, 2002, 70(4): 905-919. DOI:10.1086/339690 |
| [19] |
Ballinger SW, Schurr TG, Torroni A, et al. Southeast Asian mitochondrial DNA analysis reveals genetic continuity of ancient mongoloid migrations[J]. Genetics, 1992, 130(1): 139-152. |
| [20] |
Torroni A, Huoponen K, Francalacci P, et al. Classification of european mtDNAs from an analysis of three european populations[J]. Genetics, 1996, 144(4): 1835-1850. |
| [21] |
Mishmar D, Ruiz-Pesini E, Golik P, et al. Natural selection shaped regional mtDNA variation in humans[J]. Proc Natl Acad Sci USA, 2003, 100(1): 171-176. DOI:10.1073/pnas.0136972100 |
| [22] |
Xue FZ, Wang Y, Xu SH, et al. A spatial analysis of genetic structure of human populations in China reveals distinct difference between maternal and paternal lineages[J]. Eur J Hum Genet, 2008, 16(6): 705-717. DOI:10.1038/sj.ejhg.5201998 |
| [23] |
Niemi AK, Hervonen A, Hurme M, et al. Mitochondrial DNA polymorphisms associated with longevity in a Finnish population[J]. Hum Genet, 2003, 112(1): 29-33. DOI:10.1007/s00439-002-0843-y |
| [24] |
van der Walt JM, Nicodemus KK, Martin ER, et al. Mitochondrial polymorphisms significantly reduce the risk of parkinson disease[J]. Am J Hum Genet, 2003, 72(4): 804-811. DOI:10.1086/373937 |
| [25] |
Lal S, Madhavan M, Heng CK. The association of mitochondrial DNA 5178 C>a polymorphism with plasma lipid levels among three ethnic groups[J]. Ann Hum Genet, 2005, 69(6): 639-644. DOI:10.1111/j.1529-8817.2005.00192.x |
| [26] |
Park KS, Chan JC, Chuang LM, et al. A mitochondrial DNA variant at position 16189 is associated with type 2 diabetes mellitus in Asians[J]. Diabetologia, 2008, 51(4): 602-608. DOI:10.1007/s00125-008-0933-z |
| [27] |
Sinxadi PZ, Dave JA, Samuels DC, et al. Mitochondrial genomics and antiretroviral therapy-associated metabolic complications in HIV-infected Black South Africans:a pilot study[J]. AIDS Res Hum Retroviruses, 2013, 29(7): 1031-1039. DOI:10.1089/aid.2012.0373 |
| [28] |
Aissani B, Shrestha S, Wiener HW, et al. Mitochondrial DNA variation and virologic and immunological HIV outcomes in African Americans[J]. AIDS, 2014, 28(13): 1871-1878. DOI:10.1097/qad.0000000000000371 |
| [29] |
Hendrickson SL, Jabs DA, van Natta M, et al. Mitochondrial haplogroups are associated with risk of neuroretinal disorder in HIV-positive patients[J]. J Acquir Immune Defic Syndr, 2010, 53(4): 451-455. DOI:10.1097/QAI.0b013e3181cb8319 |
| [30] |
龚晴丽, 李雪, 鲁严. 氧化应激相关性疾病中线粒体机制的研究进展[J]. 中国细胞生物学学报, 2013, 35(10): 1540-1545. Gong QL, Li X, Lu Y. Update of mitochondrial mechanism under the diseases related to oxidative stress[J]. Chin J Cell Biol, 2013, 35(10): 1540-1545. DOI:10.11844/cjcb.2013.10.0080 |
| [31] |
López-Armada MJ, Riveiro-Naveira RR, Vaamonde-García C, et al. Mitochondrial dysfunction and the inflammatory response[J]. Mitochondrion, 2013, 13(2): 106-118. DOI:10.1016/j.mito.2013.01.003 |
| [32] |
Mancuso M, Filosto M, Orsucci D, et al. Mitochondrial DNA sequence variation and neurodegeneration[J]. Hum Genomics, 2008, 3(1): 71-78. DOI:10.1186/1479-7364-3-1-71 |
| [33] |
Chen YF, Chen WJ, Lin XZ, et al. Mitochondrial DNA Haplogroups and the risk of sporadic Parkinson's Disease in Han Chinese[J]. Chin Med J, 2015, 128(13): 1748-1754. DOI:10.4103/0366-6999.159348 |
| [34] |
Chu QH, Luo XG, Zhan XN, et al. Female genetic distribution bias in mitochondrial genome observed in Parkinson's Disease patients in northern China[J]. Sci Rep, 2015, 5: 17170. DOI:10.1038/srep17170 |
| [35] |
Sundermann EE, Heaton RK, Pasipanodya E, et al. Sex differences in HIV-associated cognitive impairment[J]. AIDS, 2018, 32(18): 2719-2726. DOI:10.1097/QAD.0000000000002012 |
| [36] |
Heaton RK, Franklin DR, Ellis RJ, et al. HIV-associated neurocognitive disorders before and during the era of combination antiretroviral therapy:differences in rates, nature, and predictors[J]. J Neurovirol, 2011, 17(1): 3-16. DOI:10.1007/s13365-010-0006-1 |
| [37] |
Letendre S. Central nervous system complications in HIV disease:HIV-associated neurocognitive disorder[J]. Top Antivir Med, 2011, 19(4): 137-142. |
 2019, Vol. 40
2019, Vol. 40