文章信息
- 吕元婧, 丁玲, 李巧玲, 李俐, 王铭, 韩阳, 王金桃.
- Lyu Yuanjing, Ding Ling, Li Qiaoling, Li Li, Wang Ming, Han Yang, Wang Jintao.
- hnRNP E1与HPV16早期基因E2和E6在宫颈癌变中的作用及交互效应
- Effects of hnRNP E1 and both early genes E2 and E6 of HPV16 together with their interactions on cervical carcinogenesis
- 中华流行病学杂志, 2019, 40(4): 466-470
- Chinese journal of Epidemiology, 2019, 40(4): 466-470
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.04.018
-
文章历史
收稿日期: 2018-10-07
宫颈癌是世界上女性第四大恶性肿瘤,高危型HPV是宫颈癌及癌前病变的主要病因[1-2],HPV16是最常见的致癌型别,其致癌机制与HPV DNA的整合有关[3]。HPV早期基因编码的E1、E2、E4、E5、E6和E7蛋白参与病毒DNA的复制、转录、翻译以及细胞转化[4-5]。HPV与宿主细胞DNA整合可致E2基因缺失,进而引起致癌基因E6过表达,促进宫颈癌及癌前病变的发生[5-6]。核不均一核糖核蛋白(heterogeneous-nuclear ribonuncleoproteins,hnRNPs)是一类RNA结合蛋白,其中,hnRNP E1含有3个高度保守的K同源域(K homology,KH)[7],具备与RNA和DNA结合的结构基础[8-9],而HPV16基因中含有的3’端非翻译区(3’ untranslated regions,3’UTR)、启动子区等多个位点,构成了与hnRNP E1特异结合的位点和结构域[9-10]。提示HPV16在引发宫颈病变的过程中可能受到hnRNP E1的影响。本研究旨在探讨hnRNP E1与HPV16早期基因E2与E6在宫颈癌变进展中的作用及相互关系,为HPV致宫颈癌变作用机制的研究提供新思路。
对象与方法1.研究对象:从课题组在山西省介休市建立的自然人群宫颈病变队列中选取2014年6-9月间经病理学确诊的正常宫颈(NC)女性56例,低度宫颈上皮内瘤变(CINⅠ)病例58例,高度宫颈上皮内瘤变(CINⅡ/Ⅲ)病例50例,以及同期在山西省肿瘤医院确诊的宫颈鳞状细胞癌(SCC)病例40例为研究对象,所有病例均为新发病例。所有对象均为已婚至65岁且在当地居住1年以上的女性,排除妊娠期和哺乳期女性、有子宫切除术及宫颈病变治疗史者、其他恶性肿瘤病例、血液系统、消化系统疾病病例。本研究通过山西医科大学伦理委员会审查,研究对象均签署知情同意书。
2.资料及标本收集:由经过严格培训的调查员采用统一的结构式问卷对研究对象进行面对面的问卷调查,收集研究对象的一般人口学特征、生活习惯、生殖情况、既往病史及家族肿瘤史等资料。由妇科专业人员用HPV专用宫颈刷采集研究对象的宫颈脱落细胞于细胞保存液中,4 ℃保存待检。同时在阴道镜下取宫颈活检组织,于-80 ℃冰箱贮存待检。
3.实验方法:
(1)HPV16感染状态检测:采用HPV-DNA提取试剂盒及21种HPV分型检测试剂盒(潮州凯普生物化学有限公司)进行HPV分型检测。按试剂盒说明书依次进行宫颈脱落细胞样品处理、提取细胞DNA,PCR扩增,最后利用导流杂交平台,在固定好核酸探针的低密度基因芯片上杂交、显色。HPV16阳性检测结果为清晰可见的蓝紫色圆点。
(2)Western Blot检测hnRNP E1与HPV16早期基因E2和E6蛋白表达水平:从宫颈活检组织中提取蛋白,定量后,参照文献[11],检测hnRNP E1、HPV16 E2和E6蛋白表达水平。一抗分别为兔抗人hnRNP E1蛋白(1 : 1 000,英国Abcam公司)、兔抗人HPV16 E2蛋白(1 : 100,英国Abcam公司)和鼠抗人HPV16 E6蛋白(1 : 500,英国Abcam公司),设内参对照为鼠抗人β-actin抗体(1 : 300,中国武汉博士德生物工程有限公司),分别在43、42、16.5和43 kD处获得hnRNP E1、HPV16 E2、HPV16 E6和内参蛋白β-actin特异性抗体结合蛋白条带。利用Quantity One软件分析条带A值,以目的条带与内参β-actin条带A值的比值作为hnRNP E1、HPV16 E2、E6蛋白的相对表达量。
4.资料整理与分析:采用SPSS 22.0软件完成数据库的建立和数据分析。采用GraphPad Prism 5.0软件作图。定性资料采用χ2检验和趋势χ2检验,定量资料采用秩和检验进行分析;采用logistic回归模型进行相关因素分析以及关联强度(OR、aOR值及其95%CI)的计算。将hnRNP E1高水平赋值为1,低水平赋值为2;HPV16未感染赋值为0,HPV16 E2高水平赋值为1,低水平赋值为2;HPV16 E6高水平赋值为2,低水平赋值为1;宫颈病变结局将NC组赋值为0,CIN Ⅰ组、CIN Ⅱ/Ⅲ组和SCC组赋值为1,采用广义多因子降维法(GMDR)进行交互作用评价,将检验样本准确度最高且置换检验有统计学意义的模型确定为最优模型。检验水准α=0.05。
结果1.人口学特征及相关影响因素分析:NC、CIN Ⅰ、CINⅡ/Ⅲ和SCC组的年龄分别为(46.66±9.60)、(48.03±7.49)、(46.52±9.07)和(51.02±8.61)岁。各组研究对象在年龄、职业、婚姻状况、出生地、民族、文化程度、吸烟、饮酒、饮茶、月经初潮年龄、痛经、绝经、慢性病史等方面均衡可比(P>0.05),但在人工流产史(χ2=8.591,P=0.035)、阴道炎史(χ2=18.755,P<0.001)、性生活后清洗(χ2=14.185,P=0.003)、产次(χ2=45.070,P<0.001)、洗澡频率(χ2=50.680,P<0.001)、洗阴频率(χ2=28.825,P<0.001)、换洗内裤频率(χ2=107.402,P<0.001)、哺乳喂养(χ2=33.254,P<0.001)方面差异有统计学意义。
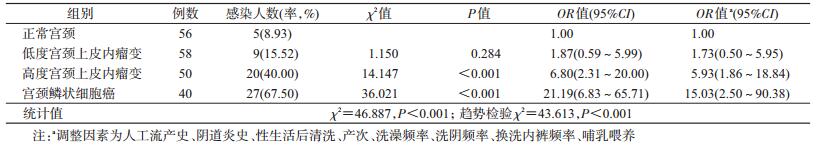
2. HPV16感染与宫颈病变的关系:HPV16感染率在CINⅠ(15.52%,9/58)、CIN Ⅱ/Ⅲ(40.00%,20/50)和SCC组(67.50%,27/40)均高于NC组(8.93%,5/56)。HPV16感染率在CIN Ⅱ/Ⅲ和SCC组均高于NC组(P<0.001),在NC和CINⅠ组间差异无统计学意义(P=0.284)。HPV16感染率在4组间的差异有统计学意义(χ2=46.887,P<0.001),且随病变程度的加重,HPV16感染率逐渐升高(趋势检验χ2=43.613,P<0.001)。见表 1。
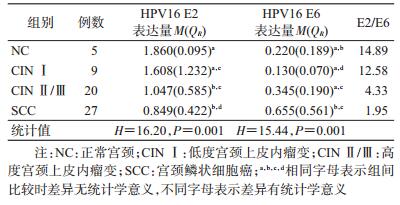
3. HPV16早期基因E2、E6与宫颈病变的关系:HPV16整合关键基因E2(H=16.20,P=0.001)和致癌基因E6(H=15.44,P=0.001)蛋白表达量在不同宫颈病变组间差异有统计学意义。经Bonferroni法两两比较,结果显示,HPV16 E2蛋白表达量在SCC组、CIN Ⅱ/Ⅲ组均低于NC组,E6高于NC组,见图 1,表 2。NC、CIN Ⅰ、CIN Ⅱ/Ⅲ组和SCC组E2/E6的比值分别为14.89、12.58、4.33和1.95,随着宫颈病变程度的加重,E2/E6比值逐渐减小,见表 2。进一步以NC组的HPV16 E2和E6蛋白表达量的P50值(1.860、0.220)作为HPV16 E2、E6蛋白低、高表达的分界点并以NC组为对照进行分析,结果显示,HPV16 E2蛋白表达量随着宫颈病变程度的加重而呈降低趋势(趋势检验χ2=9.297,P=0.002),E6则相反(趋势检验χ2=9.237,P=0.002)。
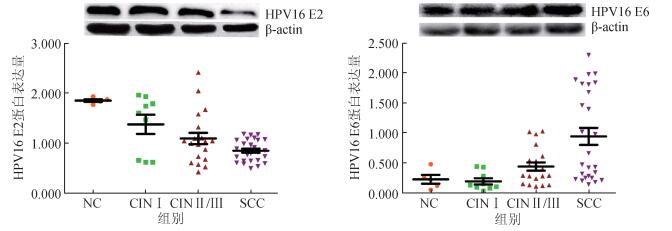
|
| 注:NC:正常宫颈;CINⅠ:低度宫颈上皮内瘤变;CINⅡ/Ⅲ:高度宫颈上皮内瘤变;SCC:宫颈鳞状细胞癌 图 1 不同宫颈病变组HPV16 E2和E6蛋白表达量 |
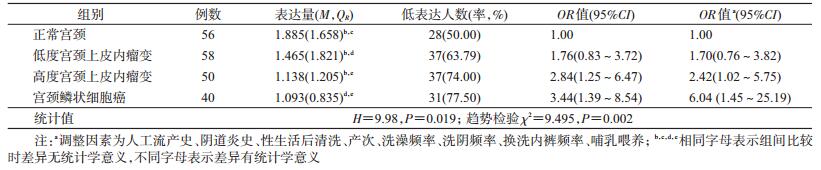
4. hnRNP E1与宫颈病变的关系:hnRNP E1表达量在不同组间差异有统计学意义(H=9.98,P=0.019),经Bonferroni法两两比较,结果显示,hnRNP E1表达量仅在SCC与NC组间差异有统计学意义。进一步以NC组hnRNP E1表达量P50值(1.885)作为hnRNP E1低水平的分界点并以NC组为对照进行分析,结果显示,hnRNP E1表达量随着宫颈病变程度的加重呈现降低趋势(趋势检验χ2=9.495,P=0.002),见图 2,表 3。

|
| 注:NC:正常宫颈;CINⅠ:低度宫颈上皮内瘤变;CINⅡ/Ⅲ:高度宫颈上皮内瘤变;SCC:宫颈鳞状细胞癌 图 2 不同宫颈病变组hnRNP E1蛋白表达量 |
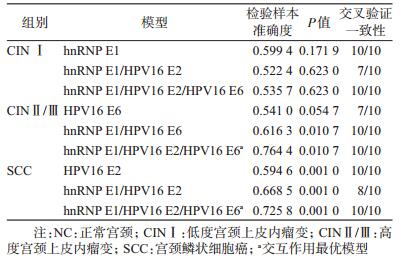
5. hnRNP E1与HPV16早期基因E2和E6在宫颈病变中的交互作用:以NC组为对照,将hnRNP E1、HPV16 E2和HPV16 E6纳入GMDR模型进行交互作用分析,结果显示,调整人工流产史、阴道炎史、性生活后清洗、产次、洗澡频率、洗阴频率、换洗内裤频率、哺乳喂养因素后,在CIN Ⅱ/Ⅲ和SCC组,交互作用最佳模型均为hnRNP E1低表达、HPV16 E2低表达与HPV16 E6高表达之间的交互作用,置换检验均有统计学意义(P<0.05);而在CIN Ⅰ组未发现交互作用存在(P>0.05),见表 4。
HPV16是HPV最常见的感染型别,与60%以上的宫颈癌有关[12]。当HPV DNA与宿主细胞DNA整合时,HPV E2的完整性遭到破坏,E2对E6负反馈调节功能缺失,导致癌基因E6过量表达,细胞周期失控,引起细胞的转化或癌变[13]。有研究提示E2基因的缺失在宫颈病变过程中发挥关键作用,可能与E2基因能诱发HPV转染和未转染细胞系的细胞凋亡有关[14-15]。本研究结果显示,随着宫颈病变程度的加重,HPV16 E2表达量逐渐降低,E6表达量增加,SCC组全部研究对象HPV16 E2的表达量均低于NC组的P50值,提示研究和检测E2基因的缺失情况对于宫颈癌变的判断具有重要意义。Cricca等[16]提出E2/E6比值可反映宫颈病变的进展情况。Saunier等[17]研究结果显示,E2/E6比值低于0.50(截止值)和HPV16的病毒载量高于22 000拷贝/103细胞时可认为病例发展为高度上皮内瘤变或更高级别的病变风险更高。本研究结果显示,E2/E6比值随着宫颈病变程度的加重逐渐减小,提示E2/E6比值的降低可作为宫颈病变的预警标志。
研究显示,正常组织中可检测到hnRNP E1,而在多种恶性肿瘤组织中未检测到或呈低表达[18-19],提示hnRNP E1可能起着抑癌基因的作用[19]。本研究结果显示,hnRNP E1的表达量随宫颈病变程度加重而逐渐降低,hnRNP E1低表达者发生CIN Ⅱ/Ⅲ和SCC的风险增加。Pillai等[20]提出hnRNP E1表达的减少有利于HPV的增殖并促进宫颈癌的进展。因此,hnRNP E1低表达可反映宫颈病变进展情况,可以作为宫颈癌前病变的临床诊断和预测依据。
本研究运用GMDR方法对hnRNP E1、HPV16 E2及HPV16 E6在宫颈病变中的交互作用进行了综合评价,结果显示,hnRNP E1低表达、HPV16 E2低表达和HPV16 E6高表达在CIN Ⅱ/Ⅲ和SCC组中存在交互作用,提示宫颈病变的发生可能受病毒与宿主基因之间交互作用的调控。hnRNP连结pre- mRNAs,在基因转录调节、pre-mRNAs剪接、mRNA输出与降解等多种生物过程中发挥着重要的作用[21-22]。HPV16基因的表达主要受转录和转录后修饰的调控,其中转录过程与启动因子的激活和效率密切相关,而转录后修饰的调控主要与mRNA的剪接代谢关系紧密。在HPV16基因中含有3’UTR、剪接位点、启动子启动位点等多个与hnRNP E1特异结合的位点和结构域,因而hnRNP E1可能通过KH域与HPV16 E2、E6基因或其转录产物mRNA结合,对HPV16基因的表达产生一系列调控作用,影响其生物学功能[10]。因此,预防和控制HPV16感染或研发以hnRNP E1为干预靶点的药物降低两者形成交互效应的机会,可降低宫颈病变发生的风险。进行hnRNP E1和HPV16 E2/E6表达量的联合检测,对于宫颈癌前病变的早期发现亦具有重要意义。当然,鉴于病毒基因转录、表达与宿主基因之间关系的复杂性,hnRNP E1对HPV16的调控及其在宫颈癌变中的作用尚待深入研究。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Ginsburg O, Bray F, Coleman MP, et al. The global burden of women's cancers:a grand challenge in global health[J]. Lancet, 2017, 389(10071): 847-860. DOI:10.1016/S0140-6736(16)31392-7 |
| [2] |
Senapati R, Nayak B, Kar SK, et al. HPV Genotypes distribution in Indian women with and without cervical carcinoma:Implication for HPV vaccination program in Odisha, Eastern India[J]. BMC Infect Dis, 2017, 17(1): 30. DOI:10.1186/s12879-016-2136-4 |
| [3] |
Depuydt CE, Thys S, Beert J, et al. Linear viral load increase of a single HPV-type in women with multiple HPV infections predicts progression to cervical cancer[J]. Int J Cancer, 2016, 139(9): 2021-2032. DOI:10.1002/ijc.30238 |
| [4] |
Hebner CM, SV Laimins LA. Human papillomaviruses:basic mechanisms of pathogenesis and oncogenicity[J]. Rev Med Virol, 2006, 16(2): 83-97. DOI:10.1002/rmv.488 |
| [5] |
Graham SV. Human papillomavirus:gene expression, regulation and prospects for novel diagnostic methods and antiviral therapies[J]. Future Microbiol, 2010, 5(10): 1493-1506. DOI:10.2217/fmb.10.107 |
| [6] |
Liu SH, Cummings DAT, Zenilman JM, et al. Characterizing the temporal dynamics of human papillomavirus DNA detectability using short-interval sampling[J]. Cancer Epidemiol Biomarkers Prev, 2014, 23(1): 200-208. DOI:10.1158/1055-9965.EPI-13-0666 |
| [7] |
Chaudhury A, Chander P, Howe PH. Heterogeneous nuclear ribonucleoproteins (hnRNPs) in cellular processes:focus on hnRNP E1's multifunctional regulatory roles[J]. RNA, 2010, 16(8): 1449-1462. DOI:10.1261/rna.2254110 |
| [8] |
霍丽蓉, 王晓民. 多种功能的Poly(C)-结合蛋白[J]. 中国生物化学与分子生物学报, 2011, 27(3): 205-211. Huo LR, Wang XM. Multifunctional Poly(C)-binding Proteins[J]. Chin J Biochem Mol Biol, 2011, 27(3): 205-211. |
| [9] |
Valverde R, Edwards L, Regan L. Structure and function of KH domains[J]. FEBS J, 2008, 275(11): 2712-2726. DOI:10.1111/j.1742-4658.2008.06411.x |
| [10] |
Walter BL, Parsley TB, Ehrenfeld E, et al. Distinct poly(rC) binding protein KH domain determinants for poliovirus translation initiation and viral RNA replication[J]. J Virol, 2002, 76(23): 12008-12022. DOI:10.1128/JVI.76.23.12008-12022.2002 |
| [11] |
王金桃, 霍晓旭, 丁玲, 等. 叶酸与DNA甲基转移酶1在宫颈癌及癌前病变中的作用[J]. 中华流行病学杂志, 2011, 32(6): 617-621. Wang JT, Huo XX, Ding L, et al. Effect of folic acid and DNA methyltransferase 1 on cervical cancer and its precancerous lesion[J]. Chin J Epidemiol, 2011, 32(6): 617-621. DOI:10.3760/cma.j.issn.0254-6450.2011.06.019 |
| [12] |
Ajiro M, Zheng ZM. E6.E7, a novel splice isoform protein of human papillomavirus 16, stabilizes viral E6 and E7 oncoproteins via HSP90 and GRP78[J]. mBio, 2015, 6(1): e02068-14. DOI:10.1128/mBio.02068-14 |
| [13] |
吴欣欣.维、汉族妇女宫颈癌及癌前病变组织中HPV16整合状态的对比研究[D].新疆: 石河子大学, 2012. Wu XX. The parallel analysis of physical state of HPV16 in cervical Neoplasia from Uygur and Han people[D]. Xinjiang: Shihezi University, 2012. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D284948 |
| [14] |
Webster K, Parish J, Pandya M, et al. The human papillomavirus (HPV) 16 E2 protein induces apoptosis in the absence of other HPV proteins and via a p53-dependent pathway[J]. J Biol Chem, 2000, 275(1): 87-94. DOI:10.1074/jbc.275.1.87 |
| [15] |
Butz K, Denk C, Ullmann A, et al. Induction of apoptosis in human papillomaviruspositive cancer cells by peptide aptamers targeting the viral E6 oncoprotein[J]. Proc Natl Acad Sci USA, 2000, 97(12): 6693-6697. DOI:10.1073/pnas.110538897 |
| [16] |
Cricca M, Morselli-Labate AM, Venturoli S, et al. Viral DNA load, physical status and E2/E6 ratio as markers to grade HPV16 positive women for high-grade cervical lesions[J]. Gynecol Oncol, 2007, 106(3): 549-557. DOI:10.1016/j.ygyno.2007.05.004 |
| [17] |
Saunier M, Monnier-Benoit S, Mauny F, et al. Analysis of human papillomavirus type 16(HPV16) DNA load and physical state for identification of HPV16-infected women with high-grade lesions or cervical carcinoma[J]. J Clin Microbiol, 2008, 46(11): 3678-3685. DOI:10.1128/JCM.01212-08 |
| [18] |
Wang HH, Vardy LA, Tan CP, et al. PCBP1 suppresses the translation of metastasis-associated PRL-3 phosphatase[J]. Cancer Cell, 2010, 18(1): 52-62. DOI:10.1016/j.ccr.2010.04.028 |
| [19] |
Zhang MP, Wang X, Tan J, et al. Poly r(C) binding protein (PCBP) 1 is a negative regulator of thyroid carcinoma[J]. Am J Trans Res, 2016, 8(8): 3567-3573. |
| [20] |
Pillai MR, Chacko P, Kesari LA, et al. Expression of folate receptors and heterogeneous nuclear ribonucleoprotein E1 in women with human papillomavirus mediated transformation of cervical tissue to cancer[J]. J Clin Pathol, 2003, 56(8): 569-574. DOI:10.1136/jcp.56.8.569 |
| [21] |
Han SP, Tang YH, Smith R. Functional diversity of the hnRNPs:past, present and perspectives[J]. Biochem J, 2010, 430(3): 379-392. DOI:10.1042/BJ20100396 |
| [22] |
Carpenter B, MacKay C, Alnabulsi A, et al. The roles of heterogeneous nuclear ribonucleoproteins in tumour development and progression[J]. Biochim Biophys Acta, 2006, 1765(2): 85-100. DOI:10.1016/j.bbcan.2005.10.002 |
 2019, Vol. 40
2019, Vol. 40