文章信息
- 马建新, 刘瑶瑶, 李倩, 葛申, 张政.
- Ma Jianxin, Liu Yaoyao, Li Qian, Ge Shen, Zhang Zheng.
- 戊型肝炎疫苗和乙型肝炎疫苗联合接种的安全性及免疫原性研究
- Study on the safety and immunogenicity of simultaneous vaccination on both hepatitis E and hepatitis B vaccines
- 中华流行病学杂志, 2019, 40(4): 451-456
- Chinese journal of Epidemiology, 2019, 40(4): 451-456
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.04.015
-
文章历史
收稿日期: 2018-10-23
戊型肝炎(戊肝)是由HEV引起的一种常见的急性病毒性肝炎,据WHO估计,全球每年约2 000万人感染HEV,其中临床型戊肝病例约330万例,2015年戊肝导致的死亡病例4.4万例,占病毒性肝炎所致死亡人数的3.3%,中国是戊肝高流行区[1-3]。戊肝通常是一种自限性的疾病,但是特殊人群如孕妇、免疫缺陷患者、慢性肝病患者的病死率高,愈后较差[4-7]。乙型肝炎(乙肝)是由HBV感染引起的以肝脏病变为主的一种传染病。2017年全国共报告病毒性肝炎发病1 283 523例,死亡573例,其中乙肝发病1 001 952例,死亡425例,戊肝的发病数29 014例低于乙肝,但是经肠道传播的肝炎中,戊肝报告发病数已远超甲型肝炎(甲肝)[8-9]。目前市场上已有安全、有效的疫苗用来预防戊肝和乙肝。这2种疫苗的接种实践中,接种者希望同时接种,但是目前尚无系统的研究证实联合接种的安全性和免疫原性。因此,本研究开展的这项随机对照临床试验,分析戊肝疫苗和乙肝疫苗联合接种(联合接种)的安全性及免疫原性,为联合接种实践提供参考依据。
对象与方法1.研究对象:2015年参与HBV血清流行病学调查人数较多的朝阳区6个街道/地区中乙肝3项(HBsAg、HBsAb和HBcAb)全部阴性的1 670名常住居民。纳入标准:①受种者接种首针疫苗时年龄18~60岁;②受种者乙型肝炎3项(HBsAg、HBsAb、HBcAb)检测全部阴性;③经询问病史及相关体检,研究者临床判定为健康、符合免疫接种要求者;④完成并签署知情同意书;⑤受种者本人能遵守临床研究方案要求;⑥腋下体温≤37 ℃者;⑦女性尿妊娠试验阴性。排除标准:①属于试验疫苗说明书禁忌范围的人群(对疫苗任何成分过敏者;有接种其他疫苗过敏史者);患血小板减少症或其他凝血障碍者;对卡那霉素或其他氨基糖甙类药物有过敏史者;患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者;未控制的癫痫和患其他进行性神经系统疾病者;②女性处于妊娠或哺乳期,或未来7个月内计划怀孕者;③正在参加其他临床研究者。本研究获得北京市朝阳区CDC伦理委员会的批准。
2.研究方法:在2015年朝阳区居民HBV血清流行病学调查基础上开展的单中心[10]、3组对照的开放性临床试验。于2015年9月至2016年12月在上述调查中人数较多的6个街道/地区招募健康受试者,依纳入排除标准筛选,根据入组顺序由随机系统分配随机编号,受试者随机分为3组:联合接种组:同时在不同手臂分别接种戊肝疫苗和乙肝疫苗;乙肝疫苗接种组:仅接种乙肝疫苗;戊肝疫苗接种组:仅接种戊肝疫苗。各组的样本量分别为300、150和150人。试验用疫苗为厦门万泰沧海生物技术有限公司生产的重组戊型肝炎疫苗(大肠埃希菌)和北京天坛生物制品股份有限公司生产的重组乙型肝炎疫苗(酵母)。接种程序均为0、1、6个月,观察每针接种后的不良反应/事件发生情况。不良反应包括:①总体不良反应:发生于每针疫苗接种后7 d内常见的局部不良反应和全身不良反应;②局部不良反应:常见的接种部位疼痛、红、肿、硬结、疹、瘙痒等;③全身不良反应:常见的发热、变态反应、头痛、疲倦乏力、恶心、呕吐、腹泻、肌肉痛、咳嗽等;④严重不良反应:是指出现导致死亡;危及生命;致癌、致畸、致出生缺陷;导致显著的或者永久的人体伤残或者器官功能的损伤;导致住院或者住院时间延长;其他与临床试验有关的有生命危险的事件。分别于接种前(0 d)、全程免疫1个月后采集受试者外周静脉血,采血当天分离血清,-20 ℃保存,待试验结束后采用ELISA法检测免疫前(0 d)和全程免疫1个月后HEV IgG、HBsAb水平。根据试剂盒说明书进行定性、定量检测,抗体定量参考品均使用WHO标准品进行标定赋值(单位WU/ml)。HEV IgG、HBsAb检测灵敏度下限分别为0.064 WU/ml、10.000 WU/ml。试验结束后对比联合接种与单独接种的安全性及全程免疫1个月后的免疫原性。
3.分析:安全分析数据集包括所有随机后至少接受过一次疫苗接种且至少有一次接种后安全性评价信息的受试者。采用不良反应发生率描述各组的不良反应发生情况,组间率的比较采用χ2检验或Fisher确切概率法。
免疫原性分析数据集包括所有全程疫苗接种、无重大方案背离、有接种前(0 d)、全程免疫1个月后抗体检测结果且免疫前相应抗体类别阴性的受试者集合;采用阳转率(95%CI)描述抗体阳转情况,几何平均浓度(geometric mean concentration,GMC)(95%CI)描述抗体水平。阳转率差值的95%CI下限值≥ -15%或GMC比值的95%CI下限值≥0.5,可验证非劣效性。采用SAS 9.4软件分析数据。双侧检验,以P<0.05为差异有统计学意义。
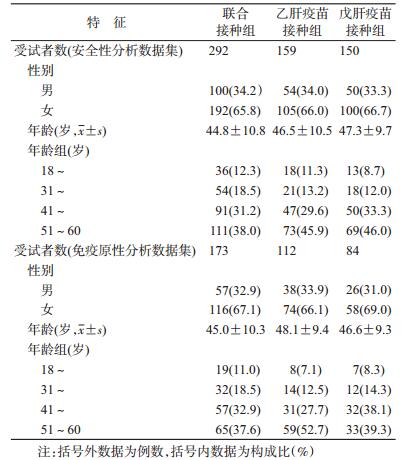
结果1.人口学特征及基线资料:共招募研究对象720人,签署知情同意书686人,体检合格605人,随机化分组603人,接种疫苗601人(戊肝疫苗接种组150人,乙肝疫苗接种组159人,联合接种组292人)。见图 1。接种前HBsAb阳性者是乙肝筛查3项检测全部阴性结果的受试者在入组之前,已接种了1针乙肝疫苗,但招募时未报告或已经自然感染。乙肝疫苗接种组、戊肝疫苗接种组和联合接种组的人口学特征见表 1。

|
| 图 1 戊肝疫苗和乙肝疫苗联合接种的安全性及免疫原性研究流程 |
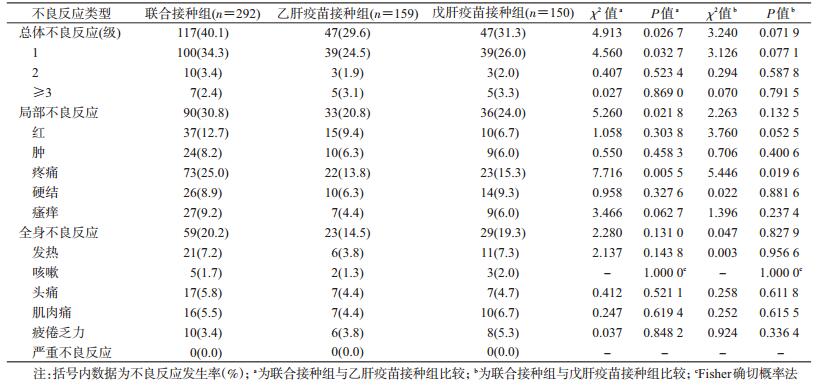
2.安全性分析:联合接种组总体不良反应发生率为40.1%(117/292);局部不良反应发生率30.8%(90/292)高于乙肝疫苗接种组20.8%(33/159),但与戊肝疫苗接种组24.0%(36/150)差异无统计学意义;全身不良反应发生率为20.2%(59/292),与单独接种组差异均无统计学意义,研究过程中未发生严重不良反应。见表 2。
3.免疫原性分析:联合接种组全程免疫1个月后,HEV IgG抗体阳转率为98.8%(171/173),非劣效于戊肝疫苗接种组,率差-1.2%(95%CI:-2.8%~0.4%);HBsAb阳转率为94.2%(163/173),非劣效于乙肝疫苗接种组,率差0.4%(95%CI:-5.2%~6.1%),见表 3。
全程免疫1个月后,联合接种组的HEV IgG抗体GMC为11.0(95%CI:9.4~12.9)WU/ml,非劣效于戊肝疫苗接种组18.0(95%CI:14.4~22.4)WU/ml,GMC比值为0.6(95%CI:0.5~0.8);HBsAb GMC为611.6(95%CI:465.9~803.0)WU/ml,非劣效于乙肝疫苗接种组745.1(95%CI:502.1~1 105.8)WU/ml,GMC比值为0.8(95%CI:0.5~1.3),见表 4。
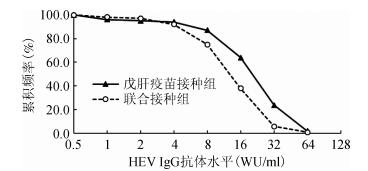
抗体水平反向累积分布曲线显示全程免疫1个月后,联合接种组在HEV IgG抗体水平1~4 WU/ml之间的累积频率略高于戊肝疫苗接种组,在HEV IgG抗体水平>4 WU/ml时,联合接种组累积频率明显低于戊肝疫苗接种组(图 2)。联合接种组与乙肝疫苗接种组HBsAb水平累积分布无明显差别(图 3)。
|
| 图 2 联合接种组与戊肝疫苗接种组全程免疫1个月后HEV IgG抗体水平对数反向累积分布 |

|
| 图 3 联合接种组与乙肝疫苗接种组全程免疫1个月后HBsAb水平对数反向累积分布 |
联合接种是指两种以上的成品疫苗在同一时间接种,但接种途径或注射部位不同,如口服和注射,或在不同部位注射不同疫苗。联合接种具有提高工作效率、降低接种的交通成本和时间成本、增加免疫机会等优势。已有的研究显示,不同疫苗同时使用可以获得良好的免疫原性和安全性,如水痘疫苗、麻疹-流行性腮腺炎-风疹五联疫苗和C群脑膜炎球菌疫苗联合接种[11],百白破-脊髓灰质炎-b型流感嗜血杆菌五联疫苗和乙肝疫苗联合接种[12]。
重组戊型肝炎疫苗(大肠埃希菌)益可宁®是全球首支戊型肝炎疫苗,超过110 000名受试者参与的Ⅲ期临床试验结果显示,该疫苗在参与全程3针接种的受试者中一年内保护率为100%,且在全程接种后4.5年内保护率为93.3%[13-14]。此疫苗的安全性数据已于2014年通过全球疫苗安全咨询委员会的评估。乙肝疫苗多年来的临床实际应用也被证实其安全有效。戊肝疫苗与乙肝疫苗均为基因工程疫苗,且具有相同的免疫程序。本次开展的研究目的是评价戊肝疫苗与乙肝疫苗同时但不同部位联合免疫后的安全性和免疫原性。研究结果表明,联合接种组除接种部位疼痛发生率高于单独接种组以外,其余不良反应与单独接种组均无明显差异,这与其他研究结果一致[15]。免疫原性分析结果显示,全程免疫1个月后,联合接种组的HBsAb阳转率、抗体GMC非劣效于乙肝疫苗接种组(94.2%比93.8%,611.6 WU/ml比745.1 WU/ml),HEV IgG抗体阳转率、抗体GMC非劣效于戊肝疫苗接种组(98.8%比100.0%,11.0 WU/ml比18.0 WU/ml)。有研究通过对抗体水平和亚临床感染风险之间的关系进行评估后,估算出0.077~1.000 WU/ml的HEV IgG边际抗体水平可以预防90%的戊肝感染风险[16]。联合接种组98%的接种者HEV IgG抗体水平>1 WU/ml,表明联合接种仍能够产生足够浓度的HEV IgG保护性抗体,起到预防病毒感染的作用。
我国传染病疫情中病毒性肝炎防治形势依然严峻,控制难度较大,报告发病数一直处于甲乙类传染病首位。乙肝是最主要的慢性病毒性肝炎,大多数乙肝患者都伴有不同程度的慢性肝功能损害,甚至发展成肝硬化,少数可发展为肝癌。我国<15岁儿童HBsAg携带率明显下降,但成年人HBsAg携带率仍然很高,要降低乙肝的疾病负担,成年人乙肝疫苗的免疫接种将成为今后工作的重点[17]。戊肝是一种主要通过消化道传播的急性病毒性肝炎,我国是戊型肝炎高流行区,近年来戊肝发病、死亡人数已远超甲肝,成为急性病毒性肝炎的主要原因,在成年人急性散发性病毒性肝炎中,多数地区戊肝占首位[18]。因此,成年人联合接种对预防HEV和HBV感染、降低疾病负担有非常大的现实意义。
本研究存在不足。局部不良反应联合接种组(2针次)与乙/戊肝疫苗接种组(1针次)相比,可比性较差;免疫后未检测乙肝抗-HBc,可能会高估乙肝疫苗的免疫效果,但是接种乙肝疫苗过程中因感染获得免疫的机会极小,对抗-HBs结果判定影响较小。
综上所述,联合接种具有良好的安全性和免疫原性。疫苗生产企业今后也可考虑研制戊肝和乙肝联合疫苗,从而达到接种1针同时预防2种病毒性肝炎的效果。
利益冲突 所有作者均声明不存在利益冲突
志谢 感谢厦门万泰沧海生物技术有限公司于晓姗、张秋芬、林淑贞、潘晖榕在研究设计、实施和质控方面给予的大力支持
| [1] |
World Health Organization. Hepatitis E[EB/OL]. (2018-09-19)[2018-10-10]. https://www.who.int/news-room/fact-sheets/detail/hepatitis-e.
|
| [2] |
Kamar N, Bendall R, Legrand-Abravanel F, et al. Hepatitis E[J]. Lancet, 2012, 379(9835): 2477-2488. DOI:10.1016/S0140-6736(11)61849-7 |
| [3] |
Jia ZY, Yi Y, Liu JH, et al. Epidemiology of hepatitis E virus in China:results from the third national viral hepatitis prevalence survey, 2005-2006[J]. PLoS One, 2014, 9(10): e110837. DOI:10.1371/journal.pone.0110837 |
| [4] |
Shalimar, Acharya SK. Hepatitis E and acute liver failure in pregnancy[J]. J Clin Exp Hepatol, 2013, 3(3): 213-224. DOI:10.1016/j.jceh.2013.08.009 |
| [5] |
Hoofnagle JH, Nelson KE, Purcell RH. Hepatitis E[J]. N Engl J Med, 2012, 367(13): 1237-1244. DOI:10.1056/NEJMra1204512 |
| [6] |
Dalton HR, Hunter JG, Bendall R. Autochthonous hepatitis E in developed countries and HEV/HIV confection[J]. Semin Liver Dis, 2013, 33(1): 50-61. DOI:10.1055/s-0033-1338114 |
| [7] |
Kumar M, Sharma BC, Sarin SK. Hepatitis E virus as an etiology of acute exacerbation of previously unrecognized asymptomatic patients with hepatitis B virus-related chronic liver disease[J]. J Gastroenterol Hepatol, 2008, 23(6): 883-887. DOI:10.1111/j.1440-1746.2007.05243.x |
| [8] |
国家卫生健康委员会疾病预防控制局. 2017年全国法定传染病疫情概况[EB/OL].(2018-02-26)[2018-10-10]. http://www.nhfpc.gov.cn/jkj/s3578/201802/de926bdb046749abb7b0a8e23d929104.shtml. Bureau of Disease Control and Prevention, National Health Commission of the People's Republic of China. Overview of the epidemic on the notifiable infectious disease in China, 2017[EB/OL].(2018-02-26)[2018-10-10]. http://www.nhfpc.gov.cn/jkj/s3578/201802/de926bdb046749abb7b0a8e23d929104.shtml. |
| [9] |
孙校金, 王富珍, 郑徽, 等. 中国2004-2015年不同预防接种阶段甲型肝炎和戊型肝炎流行病学特征比较[J]. 中华流行病学杂志, 2018, 39(10): 1351-1355. Sun XJ, Wang FZ, Zheng H, et al. Epidemiological characteristics of hepatitis A and hepatitis E in different periods of vaccination in China, 2004-2015[J]. Chin J Epidemiol, 2018, 39(10): 1351-1355. DOI:10.3760/cma.j.issn.0254-6450.2018.10.012 |
| [10] |
李倩, 刘瑶瑶, 马建新, 等. 2015年北京市朝阳区居民乙型病毒性肝炎病毒血清流行病学调查结果分析[J]. 疾病监测, 2017, 32(5): 372-376. Li Q, Liu YY, Ma JX, et al. Sero-epidemiological survey of hepatitis B virus in Chaoyang district of Beijing, 2015[J]. Dis Surveill, 2017, 32(5): 372-376. DOI:10.3784/j.issn.1003-9961.2017.05.006 |
| [11] |
Durando P, Esposito S, Bona G, et al. The immunogenicity and safety of a tetravalent measles-mumps-rubella-varicella vaccine when co-administered with conjugated meningococcal C vaccine to healthy children:A phase Ⅲb, randomized, multi-center study in Italy[J]. Vaccine, 2016, 34(36): 4278-4284. DOI:10.1016/j.vaccine.2016.07.009 |
| [12] |
Avdicová M, Prikazsky V, Hudecková H, et al. Immunogenicity and reactogenicity of a novel hexavalent DTPa-HBV-IPV/Hib vaccine compared to separate concomitant injections of DTPa-IPV/Hib and HBV vaccines, when administered according to a 3, 5 and 11 month vaccination schedule[J]. Eur J Pediatr, 2002, 161(11): 581-587. DOI:10.1007/s00431-002-1079-5 |
| [13] |
Zhu FC, Zhang J, Zhang XF, et al. Efficacy and safety of a recombinant hepatitis E vaccine in healthy adults:a large-scale, randomised, double-blind placebo-controlled, phase 3 trial[J]. Lancet, 2010, 376(9744): 895-902. DOI:10.1016/S0140-6736(10)61030-6 |
| [14] |
Zhang J, Zhang XF, Huang SJ, et al. Long-term efficacy of a hepatitis E vaccine[J]. N Engl J Med, 2015, 372(10): 914-922. DOI:10.1056/NEJMoa1406011 |
| [15] |
陈剑惠, 张宏, 翁美榕. 戊型肝炎疫苗与乙型肝炎疫苗联合接种的安全性[J]. 解放军预防医学杂志, 2016, 34(3): 447. Chen JH, Zhang H, Weng MR. Safety of hepatitis E vaccine in combination with hepatitis B vaccine[J]. J Prev Med Chin People's Liberat Army, 2016, 34(3): 447. DOI:10.13704/j.cnki.jyyx.2016.03.055 |
| [16] |
Zhang J, Zhang XF, Zhou C, et al. Protection against hepatitis E virus infection by naturally acquired and vaccine-induced immunity[J]. Clin Microbiol Infect, 2014, 20(6): O397-405. DOI:10.1111/1469-0691.12419 |
| [17] |
中华预防医学会, 中国疾病预防控制中心免疫规划中心. 中国成人乙型肝炎免疫预防技术指南[J]. 中华流行病学杂志, 2011, 32(12): 1199-1203. Chinese Preventive Medicine Association, National Immunization Program Chinese Center for Disease Control and Prevention. Technical guide for adult hepatitis B immunization in China[J]. Chin J Epidemiol, 2011, 32(12): 1199-1203. DOI:10.3760/cma.j.issn.0254-6450.2011.12.004 |
| [18] |
周乙华, 庄辉. 中国戊型肝炎流行病学研究进展[J]. 中华流行病学杂志, 2010, 31(12): 1414-1416. Zhou YH, Zhuang H. Recent advances in the epidemiological research on hepatitis E in China[J]. Chin J Epidemiol, 2010, 31(12): 1414-1416. DOI:10.3760/cma.j.issn.0254-6450.2010.12.021 |
 2019, Vol. 40
2019, Vol. 40