文章信息
- 甘凤夏, 高文静, 吕筠, 余灿清, 王胜锋, 逄增昌, 丛黎明, 董忠, 吴凡, 汪华, 吴先萍, 江国虹, 王晓节, 王滨有, 畅征, Ralf Kuja-Halkola, 曹卫华, 李立明.
- Gan Fengxia, Gao Wenjing, Lyu Jun, Yu Canqing, Wang Shengfeng, Pang Zengchang, Cong Liming, Dong Zhong, Wu Fan, Wang Hua, Wu Xianping, Jiang Guohong, Wang Xiaojie, Wang Binyou, Chang Zheng, Ralf Kuja-Halkola, Cao Weihua, Li Liming.
- 中国成年双生子人群的糖尿病遗传度研究
- Analysis on the heritability of diabetes, based on data from the Chinese adult twins
- 中华流行病学杂志, 2019, 40(4): 389-393
- Chinese Journal of Epidemiology, 2019, 40(4): 389-393
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.04.004
-
文章历史
收稿日期: 2018-09-14
2. 青岛市疾病预防控制中心 266033;
3. 浙江省疾病预防控制中心, 杭州 310051;
4. 北京市疾病预防控制中心 100013;
5. 上海市疾病预防控制中心 200336;
6. 江苏省疾病预防控制中心, 南京 210008;
7. 四川省疾病预防控制中心, 成都 610041;
8. 天津市疾病预防控制中心 300011;
9. 青海省疾病预防控制中心, 西宁 810007;
10. 哈尔滨医科大学 150001;
11. 瑞典卡罗林斯卡医学院流行病学与生物统计学系, 斯德哥尔摩 17177
2. Qingdao Center for Disease Control and Prevention, Qingdao 266033, China;
3. Zhejiang Center for Disease Control and Prevention, Hangzhou 310051, China;
4. Beijing Center for Disease Control and Prevention, Beijing 100013, China;
5. Shanghai Center for Disease Control and Prevention, Shanghai 200336, China;
6. Jiangsu Center for Disease Control and Prevention, Nanjing 210008, China;
7. Sichuan Center for Disease Control and Prevention, Chengdu 610041, China;
8. Tianjin Center for Disease Control and Prevention, Tianjin 300011, China;
9. Qinghai Center for Disease Control and Prevention, Xining 810007, China;
10. Harbin Medical University, Harbin 150001, China;
11. Department of Medical Epidemiology and Biostatistics, Karolinska Institutet, Stockholm 17177, Sweden
糖尿病是当前威胁人类健康严重的慢性非传染性疾病之一。WHO数据显示[1],近几十年,糖尿病在全世界范围内患病率持续增加,自1980年以来增加了近一倍,在成年人中从4.7%上升到8.5%,且在中低收入的国家增长速度较快[1]。2013年中国糖尿病患病率为10.4%[2]。糖尿病同时受到遗传因素和环境因素的影响,既往研究表明高血糖具有明显家族聚集性,有糖尿病家族史者患糖尿病的风险更高[3-7]。遗传度(heritability)指群体表型变异中,遗传效应所占的比例,表示遗传因素对表型的作用大小[8]。国外家系及双生子研究显示糖尿病的遗传度范围在26%~78%[9-11],国内研究多为家系研究,遗传度范围为36.2%~73.8%[12-16]。
双生子人群可分为同卵双生子(Monozygotic twin,MZ)和异卵双生子(Dizygotic twin,DZ),通常认为,MZ具有将近100%相同的遗传物质;DZ则共同享有50%的遗传基础,且双生子具有共同的成长环境(如宫内环境、抚养环境等)[8, 17]。因此,双生子人群被广泛应用于人类表型的遗传度研究。目前,国内糖尿病的遗传度研究多采用家系研究,双生子研究较为罕见。本研究采用双生子研究设计,定量计算糖尿病的遗传度。
对象与方法1.研究对象:来自中国双生子登记系统(Chinese National Twin Registry,CNTR)于2012-2013年在9省市(包括山东省、浙江省、江苏省、四川省、北京市、上海市、天津市、青海省、黑龙江省)进行深入登记调查的≥25岁双生子,剔除多胞胎、异性别双生子对,以及卵型、性别和糖尿病信息缺失的双生子,最终纳入同性别双生子10 253对。
2.研究方法及内容:
(1)问卷调查:采用CNTR统一的调查问卷对研究对象进行面访式问卷调查,调查信息由研究对象自报获得,其中糖尿病患病情况根据问题“你是否曾被县/区级或以上医院诊断患有糖尿病?”判断为是/否患有糖尿病,回答必须根据县/区级或以上医院医生的明确诊断为准,不能仅根据本人主诉或症状做出判断。
(2)卵型鉴定:同性别双生子根据年龄、性别及问卷问题“您觉得您这对双生子长的像不像?(请根据目前或近期的情况进行回答)”构建模型进行卵型鉴定。经验证,该模型判断卵型的准确性为0.88(95%CI:0.82~0.92),适合大型流行病学人群研究[18]。
3.统计学分析:采用Stata/SE 12.0软件进行描述性分析,采用R 3.4.0软件的OpenMx 2.9.9程序包拟合结构方程模型,以P<0.05为差异有统计学意义。
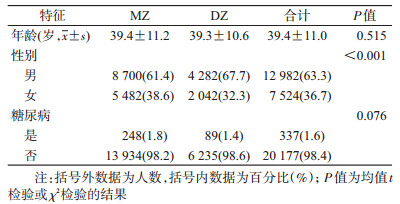
(1)描述性分析:对研究对象的年龄、性别、卵型和糖尿病患病情况等进行描述。连续型变量采用x±s描述,分类变量则采用频数和构成比。采用均值t检验或χ2检验进行组间差异的统计学检验。
(2)拟合结构方程模型计算遗传度:由于糖尿病患病为二分类变量,采用阈值模型(liability model)的结构方程模型计算糖尿病患病的遗传度[19-20]。结构方程模型把表型总的变异分解为遗传效应和环境效应,其中遗传效应包括加性遗传变异(additive genetic effect,A)、非加性遗传变异(non-additive genetic effect,D),A指等位基因的累加效应,D指等位基因间相互作用引起的效应;环境效应分解为共同环境变异(common environment effect,C)和特殊环境变异(special environment effect,E),C指双生子两成员共同经历的环境因素的效应,E指双生子各自经历的特殊环境效应,包括随机误差[21-22]。以上4种效应在MZ、DZ中的相关程度分别为A:1.00,0.50;D:1.00,0.25;C:均为1.00;E:均为0.00[21]。计算遗传变异在总变异中的占比,即为遗传度。一般认为,遗传度>70%为高度遗传,遗传度<30%为低度遗传。由于本研究数据资料未纳入分开抚养的双生子,不能区分C和D,故需要在ACE和ADE模型中进行选择,如果表型相关系数rMZ<2rDZ,拟合ACE模型,否则拟合ADE模型[22],采用四分相关系数(Tetrachoric Correlation)计算二分类变量的相关系数。糖尿病患病具有年龄、性别差异,因此在ACE模型及其嵌套模型拟合时调整年龄(连续变量)、性别(二分类变量)。进一步将研究对象按年龄、性别进行亚组分析。模型采用最大似然法估计参数,根据-2倍对数似然比(-2 log likelihood,-2LL)的差异进行χ2检验的结果确定参数是否对模型有贡献,并根据AIC(Akaike’s Information Criterion)进行模型选择,AIC越小,模型拟合优度与俭省度越好。
结果1.一般情况:本研究最终纳入≥25岁同性别双生子10 253对,年龄(39.4±11.0)岁,其中MZ 7 091对(69.2%),男性6 491对(63.3%);糖尿病患者337人,患病率为1.6%;不同卵型双生子的性别分布差异有统计学意义(P<0.001)(表 1)。按性别、年龄分组后,男性糖尿病患病率(1.8%)高于女性(1.3%),≥45岁组患病率(4.3%)高于<45岁组(0.6%),两组差异均有统计学意义(P<0.05)。
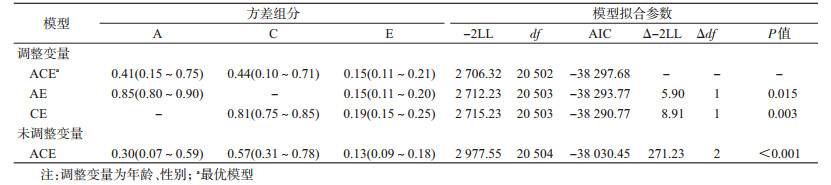
2.结构方程的拟合及遗传度估计:按照性别、年龄分组后,各组糖尿病患病的相关系数均为MZ>DZ,提示存在遗传因素的影响;rMZ<2rDZ,故拟合结构方程模型时选择ACE模型(表 2)。
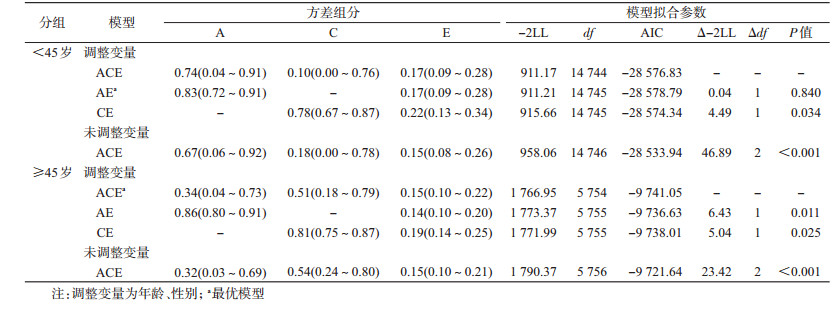
各组调整变量的模型均优于未调整变量。成年双生子总体、男性及≥45岁组的最优模型均为ACE模型,糖尿病的遗传度分别为0.41(0.15~0.75)、0.37(0.05~0.78)、0.34(0.04~0.73);成年女性、<45岁组双生子的最优模型均为AE模型,糖尿病的遗传度分别为0.88(0.79~0.94)、0.83(0.72~0.91)。女性双生子糖尿病的遗传度高于男性,<45岁组双生子的遗传度高于≥45岁组。各组模型拟合结果分别见表 3~5。
本研究利用CNTR分析了中国≥25岁成年人糖尿病的遗传度,通过模型拟合得到糖尿病的遗传度为0.41(0.15~0.75),属于中度遗传。女性患糖尿病的遗传效应比男性高,且年龄越大,遗传效应越小。目前中国利用双生子分析糖尿病患病的遗传度研究较少,本研究可为中国人群糖尿病患病的遗传度提供双生子研究的证据。
既往研究显示糖尿病的遗传度不尽相同。中国江苏省和河南省郑州市的糖尿病患者一级亲属的患病情况研究发现的遗传度分别为36.2%和39.10%[12, 16],与本研究结果相近。丹麦双生子研究发现糖尿病的遗传度为26%,低于本研究结果,但发现了与本研究类似的共同环境作用[23]。一项由欧洲地区及澳大利亚共9个双生子队列组成的不一致双生子联盟研究发现糖尿病的遗传度为中高度遗传,合并遗传度为72%[11],高于本研究结果,可能因为研究对象的种族不同。国内其他研究分别对哈尔滨市、天津市及山东省医院的糖尿病患者进行家系研究[13-15],得到的糖尿病遗传度范围为46.8%~73.8%,高于本研究,可能的原因:一是目前的家系研究样本多限于某个特定地区医院的家系,而本研究人群来源于9省市,覆盖范围较广;二是目前的家系研究采用Faloconer公式计算亲属的遗传度,该公式利用患者及对照组间亲属的患病差异及亲缘系数计算遗传度,无法区分共同的家庭环境的作用,因而有可能高估遗传度。
本研究发现糖尿病遗传度存在性别及年龄差异。瑞典、丹麦和芬兰的双生子研究均发现男性糖尿病的遗传度略高于女性[6-7];我国江苏省一项糖尿病患者的家系研究同样发现糖尿病遗传度男性高于女性,与本研究中女性高于男性不一致[12]。郭琴琴等[13]和季红斌[24]进行的糖尿病患者家系研究均发现随着年龄的增加,遗传度降低,与本研究结果一致。一项全基因组关联研究的Meta分析发现某些糖尿病相关基因具有性别特异性[25]。另外,糖尿病的环境因素、血糖和胰岛素代谢等具有性别差异[26-27],一定程度上可能会造成遗传因素的相对效应的性别差异。随着年龄增大,生活方式会发生变化,肥胖和体力活动减少等环境因素的影响越大,相对的遗传因素的作用会减少。
本研究存在局限性。第一,糖尿病患病情况是由研究对象自报,可能存在报告偏倚;第二,遗传度是指遗传因素所引起的变异占总的表型变异的比例,是与环境的相对作用,本研究中女性和年龄<45岁组最优模型是AE模型,这时候可能存在的共同环境效应C会合并到A中,相比于ACE模型会造成遗传度的高估[28-29]。
综上所述,糖尿病同时受到遗传、共同环境及特异环境的作用,相比男性,女性受到的遗传作用更强,年龄越大,遗传作用越小,环境作用越大。因此,糖尿病防治既要关注遗传背景,也要关注影响糖尿病的环境因素,特别是在男性及年龄大的人群中。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
WHO. Global report on diabetes[R]. World Health Organization, 2016.
|
| [2] |
中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2017年版)[J]. 中华糖尿病杂志, 2018, 10(1): 4-67. Chinese Diabetes Society. Chinese guideline for the prevention and treatment of type 2 diabetes mellitus(2017 edition)[J]. Chin J Diabetes Mellitus, 2018, 10(1): 4-67. DOI:10.3760/cma.j.issn.1674-5809.2018.01.003 |
| [3] |
张素华, 余路, 邱鸿鑫, 等. 家族性非胰岛素依赖型糖尿病患者的家系调查[J]. 中华医学杂志, 1996, 76(6): 435-439. Zhang SH, Yu L, Qiu HX, et al. Pedigree investigation of familial non-insulin dependent diabetes mellitus[J]. Natl Med J China, 1996, 76(06): 435-439. |
| [4] |
郝超, 姜维平, 王亚龙, 等. Ⅱ型糖尿病家族聚集性的流行病学研究[J]. 中华流行病学杂志, 1999, 20(6): 360-363. Hao C, Jiang WP, Wang YL, et al. An epidemiologic study on familial aggregation in non-insulin-dependent diabetes mellitus (NIDDM)[J]. Chin J Epidemiol, 1999, 20(6): 360-363. DOI:10.3760/j.issn:0254-6450.1999.06.012 |
| [5] |
娄能俊, 杜书玉, 辛颖, 等. 糖尿病家族史对糖尿病发病及相关危险因素的影响[J]. 山东大学学报:医学版, 2010, 48(2): 4-7. Lou NJ, Du SY, Xin Y, et al. Contribution of diabetes family history to the morbidity rate of diabetes and other risk factors[J]. J Shandong Univ Health Sci, 2010, 48(2): 4-7. |
| [6] |
Lehtovirta M, Pietiläinen KH, Levälahti E, et al. Evidence that BMI and type 2 diabetes share only a minor fraction of genetic variance:a follow-up study of 23585 monozygotic and dizygotic twins from the Finnish Twin Cohort Study[J]. Diabetologia, 2010, 53(7): 1314-1321. DOI:10.1007/s00125-010-1746-4 |
| [7] |
Kan C, Pedersen NL, Christensen K, et al. Genetic overlap between type 2 diabetes and depression in Swedish and Danish twin registries[J]. Mol Psychiatry, 2016, 21(7): 903-909. DOI:10.1038/mp.2016.28 |
| [8] |
黄爱群, 胡永华. 双生子方法在遗传流行病学研究中的应用及进展[J]. 国际遗传学杂志, 2006, 29(5): 346-351. Huang AQ, Hu YH. Applications and trends of twins study in genetic epidemiology[J]. Int J Genet, 2006, 29(5): 346-351. DOI:10.3760/cma.j.issn.1673-4386.2006.05.006 |
| [9] |
Poulsen P, Kyvik KO, Vaag A, et al. Heritability of type Ⅱ (non-insulin-dependent) diabetes mellitus and abnormal glucose tolerance-a population-based twin study[J]. Diabetologia, 1999, 42(2): 139-145. DOI:10.1007/s001250051131 |
| [10] |
Almgren P, Lehtovirta M, Isomaa B, et al. Heritability and familiality of type 2 diabetes and related quantitative traits in the Botnia study[J]. Diabetologia, 2011, 54(11): 2811-2819. DOI:10.1007/s00125-011-2267-5 |
| [11] |
Willemsen G, Ward KJ, Bell CG, et al. The concordance and heritability of type 2 diabetes in 34, 166 twin pairs from international twin registers:the discordant twin (DISCOTWIN) consortium[J]. Twin Res Hum Genet, 2015, 18(6): 762-771. DOI:10.1017/thg.2015.83 |
| [12] |
沈洪兵, 徐耀初, 喻荣彬, 等. 2型糖尿病的遗传和环境病因及其相互关系的流行病学研究[J]. 南京医科大学学报, 1998, 18(6): 491-494. Shen HB, Xu YC, Yu RB, et al. An epidemiological study on the relationship between genetic and environmental risk factors in type 2 diabetes mellitus[J]. J Nanjing Med Univ, 1998, 18(6): 491-494. |
| [13] |
郭琴琴, 邱绍婕, 蔡和金. 糖尿病遗传度的研究[J]. 黑龙江医学, 1998(9): 35-36. Guo QQ, Qiu SJ, Cai HJ. Analysis on the heritability of diabetes[J]. Heilongjiang Med J, 1998(9): 35-36. |
| [14] |
俞鸣, 焦振山, 巨韩芳, 等. 2型糖尿病的遗传流行病学研究[J]. 中国慢性病预防与控制, 2006, 14(1): 12-14. Yu M, Jiao ZS, Ju HF, et al. Genetic epidemiological study on type 2 diabetes mellitus[J]. Chin J Prevent Control Chronic Dis., 2006, 14(1): 12-14. DOI:10.3969/j.issn.1004-6194.2006.01.004 |
| [15] |
丁守华, 刘东, 杨志寅, 等. 2型糖尿病与行为和遗传因素的相关性研究[J]. 中国行为医学科学, 2008, 17(5): 407-409. Ding SH, Liu D, Yang ZY, et al. The correlation study between behavioral and genetic factors and type 2 diabetes mellitus[J]. Chin J Behavioral Med Sci, 2008, 17(5): 407-409. DOI:10.3760/cma.j.issn.1674-6554.2008.05.009 |
| [16] |
赵景志, 李琳琳, 庞超, 等. 郑州地区2型糖尿病患者一级亲属遗传度分析[J]. 郑州大学学报:医学版, 2012, 47(2): 185-187. Zhao JZ, Li LL, Pang C, et al. Analysis of heritability in the first degree relatives of type 2 diabetes mellitus patients from Zhengzhou[J]. J Zhengzhou Univ Med Sci, 2012, 47(2): 185-187. DOI:10.3969/j.issn.1671-6825.2012.02.014 |
| [17] |
李立明, 高文静, 胡永华, 等. 方兴未艾的双生子研究[J]. 北京大学学报:医学版, 2012, 44(3): 331-333. Li LM, Gao WJ, Hu YH, et al. The ascendant twin study[J]. J Peking Univ Health Sci, 2012, 44(3): 331-333. DOI:10.3969/j.issn.1671-167X.2012.03.002 |
| [18] |
Wang B, Gao WJ, Yu CQ, et al. Determination of Zygosity in adult Chinese twins using the 450 k methylation array versus questionnaire data[J]. PLoS One, 2015, 10(4): e123992. DOI:10.1371/journal.pone.0123992 |
| [19] |
Posthuma D, Beem AL, de Geus EJC, et al. Theory and practice in quantitative genetics[J]. Twin Res, 2003, 6(5): 361-376. DOI:10.1375/136905203770326367 |
| [20] |
Benchek PH, Morris NJ. How meaningful are heritability estimates of liability?[J]. Hum Genet, 2013, 132(12): 1351-1360. DOI:10.1007/s00439-013-1334-z |
| [21] |
Evans DM, Gillespie NA, Martin NG. Biometrical genetics[J]. Biol Psychol, 2002, 61(1/2): 33-51. DOI:10.1016/S0301-0511(02)00051-0 |
| [22] |
Neale MC, Maes HHM. Methodology for genetic studies of twins and families[M]. Dordrecht, The Netherlands: Kluwer Academic Publishers B.V., 2003.
|
| [23] |
Poulsen P, Kyvik KO, Vaag A, et al. Heritability of type Ⅱ(non-insulin-dependent) diabetes mellitus and abnormal glucose tolerance-a population-based twin study[J]. Diabetologia, 1999, 42(2): 139-145. DOI:10.1007/s001250051131 |
| [24] |
季洪斌. 老年性糖尿病遗传度的研究[J]. 现代预防医学, 2011, 38(22): 4746. Ji HB. Study on the inheritance degree of aged diabetes[J]. Mod Prevent Med, 2011, 38(22): 4746. |
| [25] |
Mehta NN. Large-scale association analysis provides insights into the genetic architecture and pathophysiology of type 2 diabetes mellitus[J]. Circ:Cardiovasc Gene, 2012, 5(6): 708-710. DOI:10.1161/circgenetics.112.965350 |
| [26] |
罗胜兰, 方乐, 叶真, 等. 糖尿病患者危险因素性别差异[J]. 浙江预防医学, 2013, 25(11): 1-3, 15. Luo SL, Fang L, Ye Z, et al. Gender differences in risk factors for diabetes mellitus[J]. Zhejiang Prevent Med, 2013, 25(11): 1-3, 15. |
| [27] |
Vistisen D, Witte DR, Tabák AG, et al. Sex differences in glucose and insulin trajectories prior to diabetes diagnosis:the Whitehall Ⅱstudy[J]. Acta Diabetol, 2014, 51(2): 315-319. DOI:10.1007/s00592-012-0429-7 |
| [28] |
Feng R, Zhou GF, Zhang MZ, et al. Analysis of twin data using SAS[J]. Biometrics, 2009, 65(2): 584-589. DOI:10.1111/j.1541-0420.2008.01098.x |
| [29] |
Wang XQ, Guo XB, He MG, et al. Statistical inference in mixed models and analysis of twin and family data[J]. Biometrics, 2011, 67(3): 987-995. DOI:10.1111/j.1541-0420.2010.01548.x |
 2019, Vol. 40
2019, Vol. 40