文章信息
- 苏普玉, 郝加虎, 黄锟, 黄朝辉, 陶芳标.
- Su Puyu, Hao Jiahu, Huang Kun, Huang Zhaohui, Tao Fangbiao.
- 孕20周内母体甲状腺功能与婴幼儿体格及神经精神发育剂量反应关系的前瞻性队列研究
- Dose-response relationship between maternal thyroid hormones in the first twenty weeks and physical and neuropsychological development of infants: A prospective cohort study in China
- 中华流行病学杂志, 2019, 40(2): 180-185
- Chinese Journal of Epidemiology, 2019, 40(2): 180-185
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.02.011
-
文章历史
收稿日期: 2018-05-06
孕期甲状腺激素可促进胎儿组织细胞内蛋白质、RNA、DNA以及特殊酶系的合成、钙磷代谢,促进胎儿骨骼和生殖器官的生长发育和胎儿大脑神经突触的形成、细胞迁移、胶质细胞和神经元细胞的分化等[1-3]。孕早期母体甲状腺功能异常,可导致新生儿出生体重下降和头围减小,增加低出生体重和小于胎龄儿的风险,导致后代神经精神发育异常等[4-6]。目前有关孕早、中期孕妇甲状腺功能与后代体格发育和神经精神发育相关的研究较为少见且多为定性研究,尚无法准确阐述孕期母体血清甲状腺功能相关指标与后代体格和神经精神发育指标的剂量反应关系。本研究通过队列研究描述孕期母体甲状腺功能相关激素水平与新生儿体格和后代神经精神发育水平的剂量反应关系,为进一步指导孕期保健以及开展相关研究提供依据。
对象与方法1.研究对象:来自“中国-安徽出生队列研究”(China-Anhui Birth Cohort Study,C-ABCS),选取2008年11月至2009年3月在马鞍山市妇幼保健中心进行第一次产前医学检查的1 060名单胎孕妇为研究对象,剔除拒绝参加此项研究(20人)和孕20周后(23人)的孕妇,最终对1 017名孕20周内的孕妇进行了血清学甲状腺激素检测和队列随访。
在1 017名单胎孕妇中,有15例发生自然流产,6例胎儿死亡,5例引产,共991名单胎活产儿;进一步排除46名严重孕期妊娠合并症和并发症(如甲状腺功能低下、妊高症、子痫前期、妊娠糖尿病等)以及智力低下孕妇所分娩的活产儿,共对945名单胎活产儿的出生时体格测量指标(出生体重、出生身长、出生头围和出生胸围)进行分析;其中,768例婴幼儿在18~30个月内进行了神经精神发育测量。所有研究对象均签署知情同意书。本研究通过了安徽医科大学生物医学伦理委员会的伦理学审查(编号:2008020)。
2.研究方法:队列孕妇在进行第一次产前医学检查时,采集血液标本,并进行血清分离、低温保存。同时采用自编的“孕产期母婴健康记录表”收集孕妇一般人口统计学资料。在分娩时测量新生儿的体格测量指标(包括身长、体重、头围、胸围等)。利用儿童定期健康检查(4-2-1体检)时机,测量队列活产儿18~30个月内的神经精神发育状况。
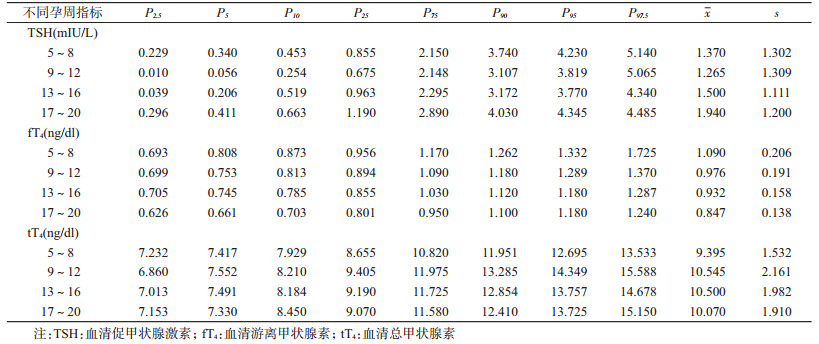
(1)血清促甲状腺激素(thyroid-stimulating hormone,TSH)、血清游离甲状腺素(free thyroxine,fT4)、血清总甲状腺素(total thyroxine,tT4)水平检测:2010年10月,在安徽医科大学第一附属医院检验科,使用电化学发光免疫测定法(electro-chemiluminescence immunoassay,ECLI),试剂由意大利DiaSorin公司提供(LIAISON Analyzer;DiaSorin SpA.,Saluggia,IT),对队列孕妇进行血清甲状腺激素(TSH、fT4和tT4)水平检测。TSH的检测范围为0.004~100.000 mIU/L,批内变异为0.7%~1.9%,批间变异为1.6%~5.2%;fT4为0.100~10.000 ng/dl,批内变异为1.1%~2.4%,批间变异为2.9%~4.8%;tT4为0.250~40.000 ng/dl,批内变异为2.5%~4.2%,批间变异为5.0%~6.0%。考虑不同孕周孕妇体内的甲状腺激素存在较大差异,甲状腺激素水平易受到种族、仪器检测方法、碘营养状况、样本人群的选择以及计算方法等因素的影响[7-8],且血清甲状腺激素还会受到冷藏、解冻、储存时间等多方面的影响[9],因此,本研究根据研究人群特点制定了不同孕周TSH、fT4和tT4的参考标准(表 1)。
(2)婴幼儿神经精神发育状况检查:采用贝利婴幼儿发展量表(Bayley scales of infant development,BSID)(中国城市修订版)测定婴儿智力发育和精神运动发育,计算精神发展指数(mental development index,MDI)和运动发展指数(psychomotor development index,PDI)。BSID于1990年由湖南医科大学精神卫生研究所主持修订[10],用于评价2~30月龄婴幼儿的心理发展状况,其中,MDI由163个条目组成,用于评估婴幼儿感知敏锐性、对外界反应、物体恒常性、学习记忆、解决问题、语言交流以及概况和分类能力等;PDI由81个条目组成,用于评估婴幼儿身体控制程度、大肌肉运动以及手指精细操作能力等。MDI和PDI参照中国不同年龄儿童常模将粗分转换成x=100,s=16的标准分。
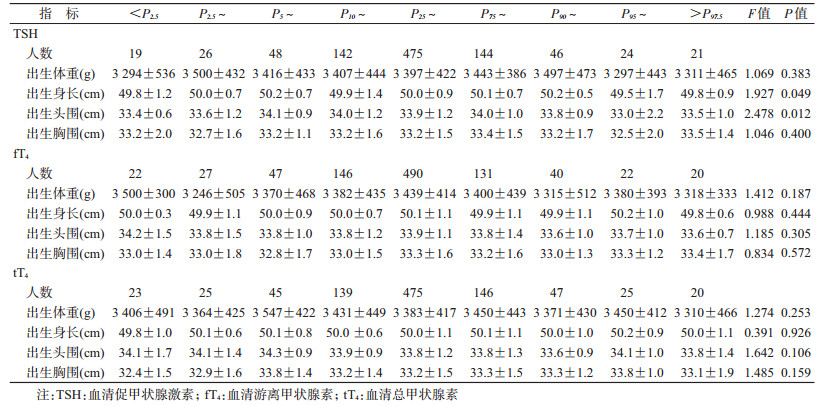
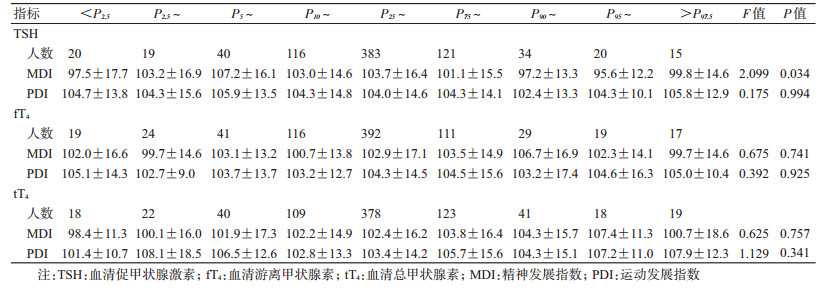
3.统计学分析:资料录入之前对调查表进行统一审核,采用EpiData 3.0软件建立数据库进行双录入,使用SPSS 21.0软件进行统计分析。采用方差分析比较孕期母亲TSH、fT4和tT4处于不同百分段(<P2.5、P2.5~、P5~、P10~、P25~、P75~、P90~、P95~、>P97.5)孕妇的活产儿出生时的体格测量指标(体重、身长、头围、胸围)和婴幼儿18~30月龄时MDI、PDI的差异。为了更为直观描述孕期母体各种甲状腺功能相关激素水平与新生儿出生时各类体格测量指标、婴儿期神经精神发育指标间的剂量反应关系,对研究队列孕妇TSH、fT4和tT4水平根据本研究不同孕周相应的参考值进行“Z”分转化[Z=(个体测量值—参考标准中位数)/不同孕周参考标准的标准差],再分别以孕期母亲TSH、fT4和tT4的“Z”分为横坐标,以各类体格测量指标和神经精神发育指标为纵坐标,绘制儿童发育指标与母体甲状腺功能相关指标间关系的散点图,在散点图中采用拟合二次方曲线的方式(根据最小二乘法,用二次方回归曲线对散点图中数据点作最佳拟合)拟合趋势线(包括x及其95%CI),以P<0.05为差异有统计学意义。
结果1.一般情况:本研究共随访了945名<孕20周的孕妇,年龄(26.9±3.2)岁。其中孕5~8周73人(7.7%),9~12周412人(43.6%),13~16周363人(38.4%),17~20周97人(10.3%)。文化程度在初中及以下212人(22.4%),高中或中专282人(29.8%),大专及以上451人(47.7%)。家庭人均年收入<2 000元的575人(60.8%),2 000~元的308人(32.6%),≥4 000元的62人(6.6%)。
945名新生儿出生时孕周为(39.0±1.3)周,其中,男童506名(53.5%),女童439名(46.5%)。新生儿出生体重为(3 408.2±427.4)g,出生身长为(50.0±1.0)cm,头围(33.9±1.2)cm,胸围(33.2±1.5)cm。768名18~30个月的婴幼儿MDI为(102.6±15.9)分,PDI为(104.2±14.3)分。
2.孕期母体甲状腺功能相关激素水平与新生儿出生时体格发育指标之间的剂量反应关系:孕期母体TSH水平处于不同百分段的孕妇所分娩的活产儿出生身长和头围的差异有统计学意义(P<0.05)。孕期母体TSH水平≥P95时新生儿出生身长比母体TSH水平位于P25~P75时的新生儿平均低0.35 cm(95%CI:0.05~0.65,P=0.020),头围平均低0.64 cm(95%CI:0.26~1.02,P=0.001);孕期母体TSH水平<P5时新生儿出生身长比母体TSH水平位于P25~P75时的新生儿平均低0.37 cm(95%CI:0.09~0.65,P=0.009),头围平均低0.39 cm(95%CI:0.04~0.74,P=0.030)。孕期母体TSH水平处于不同百分段的孕妇其后代出生体重、出生胸围差异无统计学意义(P>0.05)。见表 2。
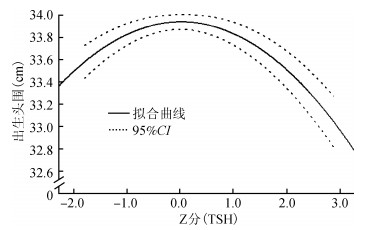
孕期母体TSH水平的Z分与新生儿出生时头围呈现出明显的倒“U”形分布模式(Y=33.940+0.003X—0.109X2,F=4.685,P=0.009),决定系数R2=0.941,曲线拟合优度良好(图 1)。而孕期母体TSH水平的Z分与新生儿出生身长、出生体重和出生胸围之间并不呈现此分布模式。孕期母体fT4和tT4水平处于不同百分段的孕妇其后代的出生体重、出生身长、出生头围、出生胸围差异无显著统计学意义(P>0.05)。
|
| 图 1 新生儿出生头围与孕期母体血清促甲状腺激素(TSH)-Z分的拟合二次方曲线 |
3.孕期母体甲状腺功能相关激素水平与婴儿神经精神发育之间的剂量反应关系:孕期母体血清TSH浓度处于不同百分位段孕妇所分娩的活产儿在出生后18~30月龄时的MDI得分差异有统计学意义(F=2.099,P=0.034)。孕期母体TSH水平<P2.5或≥P90时,其后代MDI平均得分(97.3分)比母体TSH水平位于P25~P75时的后代平均得分(103.7分)低6.39分(95%CI:2.29~10.49,P=0.002)。但孕期母体TSH浓度处于不同百分段孕妇所分娩的活产儿在出生后18~30月龄时的PDI得分差异无统计学意义(P=0.994)。孕期母体fT4、tT4浓度处于不同百分段孕妇其后代在出生后18~30月龄时的MDI、PDI得分差异无统计学意义(P>0.05)。见表 3。
孕期母体TSH水平的Z分与婴幼儿18~30月龄时的MDI得分亦呈明显的倒“U”形分布模式(Y=103.249—1.524X—0.939X2,F=6.616,P=0.001),决定系数R2=0.935,曲线拟合优度良好(图 2)。而孕期母体TSH水平的Z分与婴幼儿18~30月龄时的PDI得分并不呈现此分布模式;孕期母体fT4、tT4水平的Z分与婴儿18~30月龄时的MDI、PDI得分均不呈现此分布模式。

|
| 图 2 婴幼儿18~30月龄时的精神发展指数与孕期母体血清促甲状腺激素(TSH)-Z分的拟合二次方曲线 |
本研究显示,孕20周前孕妇血清TSH水平与新生儿出生时的身长和头围相关,出生身长和头围在孕期母体血清TSH水平处于相应孕周<P5或≥P95的孕妇中均较低,提示孕期孕妇血清TSH水平升高或降低,均会影响胎儿的发育。这可能是由于孕妇血清TSH与人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)水平呈现逆向关系[11],孕期hCG浓度偏低易导致胎儿的流失,而高浓度的hCG则是甲状腺功能亢进的危险因素[12];还可能与孕期甲状腺素在胎儿骨骼和神经系统结构和功能的发育中具有关键作用有关[13-14]。本次研究显示,孕期血清fT4和tT4水平处于不同百分段的孕妇,其所分娩的新生儿出生体重、身长、头围和胸围的差异无统计学意义,表明孕期孕妇血清TSH指标相比fT4和tT4指标对胎儿发育影响更大,可能与孕期TSH水平与hCG水平呈现显著的逆向关系[11],从而导致孕期孕妇甲状腺功能异常对胎盘和胎儿发育产生不可逆转的影响[15],与过往研究结果类似[16]。通过绘制TSH、fT4、tT4的Z分与新生儿各类出生时体格测量指标间的拟合趋势图发现,孕期母体血清TSH水平与新生儿出生头围呈现倒“U”形分布,表明孕期母体血清TSH水平偏高或偏低对胎儿发育均会产生不良的影响,提示在孕期监测孕妇血清各甲状腺素水平,尤其TSH水平,对于孕期甲状腺功能异常者给予恰当治疗对胎儿发育将具有积极的作用。
进一步探讨孕期母体甲状腺功能与婴幼儿神经精神发育的剂量反应关系发现,孕期母亲血清TSH水平与后代18~30月龄时的MDI关系密切,进一步分析显示孕期母体TSH浓度过低(<P2.5)或过高(≥P90)孕妇所分娩的活产儿在出生后18~30月龄时的MDI比孕期TSH水平处于中等水平(P25~P75之间)的孕妇平均低6.39分,与过往研究结果类似[5, 17]。对孕期各种甲状腺激素Z分与后代神经精神发展指标关系的散点图进行二次拟合后得到的趋势图显示,当孕期母亲血清TSH的Z分>1时(>参考值的P85),婴幼儿MDI得分下降的幅度较为明显;当TSH的Z分<-2时(<参考值的P2.5),婴幼儿MDI得分亦开始迅速下降,与孕期母体TSH水平与新生儿出生头围之间的关系较为一致。在怀孕中期之前,胎儿大脑发育所需甲状腺素主要来源于母体,妊娠早期甲状腺素是胎儿皮质发生所必需的[18],甲状腺素在胎儿神经系统发育中扮演着脑源性神经营养因子(rain-derived neurotrophic factor,BDNF)的角色[19],而且孕期母体轻微的甲状腺功能低下可导致后代海马BDNF基因的持续高甲基化状态[20],亦可能影响胎儿皮层、海马的CA1区域神经元树突状形态[21],并影响后代甲状腺素反应基因的表达和记忆性能的下降[22]。
本研究首次基于人群队列探讨了孕20周内母体甲状腺功能与婴幼儿体格及神经精神发育剂量反应关系,以该队列孕妇不同孕周各甲状腺功能指标的参考值为参照,将孕妇各甲状腺功能指标进行标准差分(Z分)转换,可相对准确的阐述孕妇甲状腺功能与婴幼儿体格及神经精神发育之间的关系。但本次研究仍存在不足,如孕期严重妊娠合并症和并发症的信息获得均为孕妇自我报告,样本量相对较小,且没有对孕妇甲状腺素抗体进行检测等。
综上所述,孕20周前母体TSH水平与新生儿出生时的头围和婴幼儿期的MDI水平关系密切,呈现显著倒“U”形分布模式,提示孕期轻微的甲状腺功能异常亦可能对后代神经精神发育产生一定影响,因此孕期需密切关注孕妇的甲状腺功能。近年来,关于孕期是否应该进行甲状腺功能检查或是否只在甲状腺功能异常风险较高的妇女中进行甲状腺功能检查存在大量争论,本次研究结果对孕妇孕期应该常规开展甲状腺功能检查以及对甲状腺功能异常者需及时进行适当治疗提供了科学依据。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Moog NK, Entringer S, Heim C, et al. Influence of maternal thyroid hormones during gestation on fetal brain development[J]. Neuroscience, 2017, 342: 68-100. DOI:10.1016/j.neuroscience.2015.09.070 |
| [2] |
Faustino LC, Ortiga-Carvalho TM. Thyroid hormone role on cerebellar development and maintenance:a perspective based on transgenic mouse models[J]. Front Endocrinol (Lausanne), 2014, 5: 75. DOI:10.3389/fendo.2014.00075 |
| [3] |
Nguyen CT, Sasso EB, Barton L, et al. Graves' hyperthyroidism in pregnancy:a clinical review[J]. Clin Diabetes Endocrinol, 2018, 4: 4. DOI:10.1186/s40842-018-0054-7 |
| [4] |
Medici M, Timmermans S, Visser W, et al. Maternal thyroid hormone parameters during early pregnancy and birth weight:the generation R study[J]. J Clin Endocrinol Metab, 2013, 98(1): 59-66. DOI:10.1210/jc.2012-2420 |
| [5] |
Haddow JE, Palomaki GE, Allan WC, et al. Maternal thyroid deficiency during pregnancy and subsequent neuropsychological development of the child[J]. N Engl J Med, 1999, 341(8): 549-555. DOI:10.1056/NEJM199908193410801 |
| [6] |
Bath SC, Steer CD, Golding J, et al. Effect of inadequate iodine status in UK pregnant women on cognitive outcomes in their children:results from the Avon Longitudinal Study of Parents and Children (ALSPAC)[J]. Lancet, 2013, 382(9889): 331-337. DOI:10.1016/S0140-6736(13)60436-5 |
| [7] |
Rajput R, Singh B, Goel V, et al. Trimester-specific reference interval for thyroid hormones during pregnancy at a Tertiary Care Hospital in Haryana, India[J]. Indian J Endocrinol Metab, 2016, 20(6): 810-815. DOI:10.4103/2230-8210.192903 |
| [8] |
Yan YQ, Dong ZL, Dong L, et al. Trimester-and method-specific reference intervals for thyroid tests in pregnant Chinese women:methodology, euthyroid definition and iodine status can influence the setting of reference intervals[J]. Clin Endocrinol, 2011, 74(2): 262-269. DOI:10.1111/j.1365-2265.2010.03910.x |
| [9] |
Männistö T, Surcel HM, Bloigu A, et al. The effect of freezing, thawing, and short-and long-term storage on serum thyrotropin, thyroid hormones, and thyroid autoantibodies:implications for analyzing samples stored in serum banks[J]. Clin Chem, 2007, 53(11): 1986-1987. DOI:10.1373/clinchem.2007.091371 |
| [10] |
易受蓉, 罗学荣, 杨志伟, 等. 贝利婴幼儿发展量表在我国的修订(城市版)[J]. 中国临床心理学杂志, 1993, 1(2): 71-75, 127. Yi SR, Luo XR, Yang ZW, et al. The revising of the bayley scales of infant development (BSID) in China[J]. Chin J Clinical Psychology, 1993, 1(2): 71-75, 127. DOI:10.16128/j.cnki.1005-3611.1993.02.003 |
| [11] |
Haddow JE, McClain MR, Lambert-Messerlian G, et al. Variability in thyroid-stimulating hormone suppression by human chronic gonadotropin during early pregnancy[J]. J Clin Endocrinol Metab, 2008, 93(9): 3341-3347. DOI:10.1210/jc.2008-0568 |
| [12] |
Korevaar TI, de Rijke YB, Chaker L, et al. Stimulation of thyroid function by human chorionic gonadotropin during pregnancy:A risk factor for thyroid disease and a mechanism for known risk factors[J]. Thyroid, 2017, 27(3): 440-450. DOI:10.1089/thy.2016.0527 |
| [13] |
Bassett JHD, Boyde A, Zikmund T, et al. Thyroid hormone receptor α mutation causes a severe and thyroxine-resistant skeletal dysplasia in female mice[J]. Endocrinology, 2014, 155(9): 3699-3712. DOI:10.1210/en.2013-2156 |
| [14] |
Thompson W, Russell G, Baragwanath G, et al. Maternal thyroid hormone insufficiency during pregnancy and risk of neurodevelopmental disorders in offspring:A systematic review and Meta-analysis[J]. Clin Endocrinol, 2018, 88(4): 575-584. DOI:10.1111/cen.13550 |
| [15] |
Eerdekens A, Langouche L, Güiza F, et al. Maternal and placental responses before preterm birth:adaptations to increase fetal thyroid hormone availability?[J]. J Matern Fetal Neonatal Med, 2018, 20: 1-12. DOI:10.1080/14767058.2018.1449199 |
| [16] |
Robert E, Vollset SE, Botto L, et al. Malformation surveillance and maternal drug exposure:the MADRE project[J]. Int J Risk Saf Med, 1994, 6(2): 75-118. DOI:10.3233/JRS-1994-6201 |
| [17] |
Li Y, Shan Z, Teng W, et al. Abnormalities of maternal thyroid function during pregnancy affect neuropsychological development of their children at 25-30 months[J]. Clin Endocrinol, 2010, 72(6): 825-829. DOI:10.1111/j.1365-2265.2009.03743.x |
| [18] |
Bárez-López S, Obregon MJ, Bernal J, et al. Thyroid hormone economy in the perinatal mouse brain:Implications for cerebral cortex development[J]. Cereb Cortex, 2018, 28(5): 1783-1793. DOI:10.1093/cercor/bhx088 |
| [19] |
Gilbert ME, Lasley SM. Developmental thyroid hormone insufficiency and brain development:A role for brain-derived neurotrophic factor (BDNF)?[J]. Neuroscience, 2013, 239: 253-270. DOI:10.1016/j.neuroscience.2012.11.022 |
| [20] |
Kawahori K, Hashimoto K, Yuan XM, et al. Mild maternal hypothyroxinemia during pregnancy induces persistent DNA hypermethylation in the hippocampal brain-derived neurotrophic factor gene in mouse offspring[J]. Thyroid, 2018, 28(3): 395-406. DOI:10.1089/thy.2017.0331 |
| [21] |
Min H, Wang Y, Dong J, et al. Effects of maternal marginal iodine deficiency on dendritic morphology in the hippocampal CA1 pyramidal neurons in rat offspring[J]. Neuromol Med, 2016, 18(2): 203-215. DOI:10.1007/s12017-016-8391-0 |
| [22] |
Liu DJ, Teng WP, Shan ZY, et al. The effect of maternal subclinical hypothyroidism during pregnancy on brain development in rat offspring[J]. Thyroid, 2010, 20(8): 909-915. DOI:10.1089/thy.2009.0036 |
 2019, Vol. 40
2019, Vol. 40