文章信息
- 中华预防医学会.
- Chinese Preventive Medicine Association.
- 脑膜炎球菌疫苗的有效性、安全性和成本效益研究进展
- Efficacy, safety, and cost-effectiveness of meningococcal vaccines
- 中华流行病学杂志, 2019, 40(2): 129-135
- Chinese Journal of Epidemiology, 2019, 40(2): 129-135
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.02.002
-
文章历史
收稿日期: 2018-12-29
流行性脑脊髓膜炎(流脑)是由脑膜炎奈瑟菌(Neisseria meningitidis,Nm)引起的急性化脓性脑膜炎,脑膜炎球菌疫苗的接种对于中国预防和控制流脑流行发挥了重要作用。根据制备工艺不同,脑膜炎球菌疫苗包括脑膜炎球菌多糖疫苗(meningococcal polysaccharide vaccine,MPV)、脑膜炎球菌多糖结合疫苗(Meningococcal polysaccharide conjugate vaccine,MPCV)和联合疫苗。MPV由于是胸腺非依赖性抗原,在2岁以下婴幼儿体内免疫应答很弱,并且只产生短暂的免疫反应,不具备反复接种时的免疫记忆增强作用,而MPCV是胸腺依赖性抗原,对婴幼儿能产生很好的免疫应答,重复接种能产生记忆性免疫增强作用。目前,纳入国家免疫规划的脑膜炎球菌疫苗为A群脑膜炎球菌多糖疫苗(group A meningococcal polysaccharide vaccine,MPV-A)和A群C群脑膜炎球菌多糖疫苗(group A and group C meningococcal polysaccharide vaccine,MPV-AC)。由于流脑流行病学特征显示<2岁婴幼儿是流脑发病率较高人群,而且流脑菌群构成正在向多元化发展[1],因此,有必要使用MPCV和覆盖多个血清群Nm的脑膜炎球菌疫苗来预防流脑。目前,中国上市使用的脑膜炎球菌疫苗包括MPV-A、MPV-AC、ACYW群脑膜炎球菌多糖疫苗(group A,C,Y and W meningococcal polysaccharide vaccine,MPV-ACYW),A群C群脑膜炎球菌多糖结合疫苗(group A and group C meningococcal polysaccharide conjugate vaccine,MPCV-AC),A群C群脑膜炎球菌多糖结合b型流感嗜血杆菌结合联合疫苗(group A and group C meningococcal polysaccharide conjugate and Haemophilus influenzae type b conjugate combined vaccine,MPCV-AC-Hib)。不同生产企业疫苗的适应人群和免疫程序有所差异,给实际接种工作带来困扰。本文对中国上市使用的脑膜炎球菌疫苗的有效性、安全性和成本效益进行系统综述,为脑膜炎球菌疫苗的合理使用和免疫策略调整提供依据。
一、疫苗的有效性评价脑膜炎球菌疫苗的免疫原性通常采用血清杀菌力试验检测抗脑膜炎球菌特异性血清杀菌活性(serum bactericidal activity,SBA)滴度。当以人血清作为血清杀菌力试验补体来源时,以SBA≥1:4作为杀菌抗体阳性标准[2],当以乳兔血清作为血清杀菌力试验补体来源时,以SBA≥1:128作为杀菌抗体阳性标准[3],不论使用何种补体来源,免疫后较免疫前的SBA≥4倍升高是判定抗体阳转的金标准。当免疫前SBA较高,免疫后SBA升高倍数达不到4倍时,可以通过免疫后SBA≥1:4或1:128的比例进行补充评价。由于脑膜炎球菌疾病的发病率相对较低,在颁发上市许可证前开展临床效力研究可能并不可行。MPV和MPCV上市许可证的颁发主要基于受种者中获得的免疫原性方面的证据。人补体的SBA≥1:4或使用兔补体的SBA≥1:8已被广泛认同为对相应血清群的脑膜炎球菌具有保护作用,并被作为颁发疫苗上市许可证的标准[4]。已经上市许可的MPCV应用数据均表明,SBA与保护效果具有相关性,可作为评价保护效果的可替代指标。因此国内外多项研究针对不同年龄人群接种不同类型的脑膜炎球菌疫苗开展了免疫原性的评价,也可以用于评价疫苗效力。
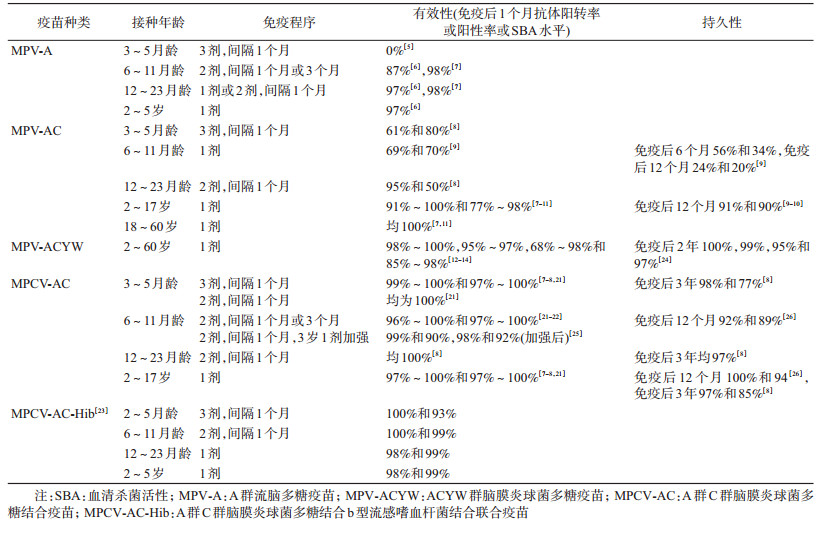
1. MPV:国内多项关于MPV的免疫原性研究显示,3~5月龄婴儿间隔1个月接种3剂MPV-A,6~11月龄婴儿间隔1个月或3个月接种2剂MPV-A,12月龄~5岁接种1剂MPV-A,免疫后1个月抗A群Nm SBA的阳转率分别为0%、87%或98%和97%[5-7];3~5月龄婴儿间隔1个月接种3剂MPV-AC,免疫后1个月抗A群和C群Nm SBA的阳转率分别为61%和80%[8];6~11月龄婴儿接种1剂MPV-AC,免疫后1个月抗A群和C群Nm SBA的阳转率分别为69%和70%[9];12~23月龄婴幼儿间隔1个月接种2剂MPV-AC,免疫后1个月抗A群和C群Nm SBA的阳转率分别为95%和50%[8];2~17岁儿童和青少年接种1剂MPV-AC,免疫后1个月抗A群和C群Nm SBA的阳转率分别为91%~100%和77%~98%[7-11];18~60岁成年人1剂MPV-AC,免疫后1个月抗A群和C群Nm SBA的阳转率均为100%[7, 11]。2~60岁人群接种1剂MPV-ACYW,免疫后1个月抗A群、C群、W135群和Y群Nm SBA阳转率分别为98%~100%,95%~97%,68%~98%和85%~98%[12-14](表 1)。
国内外关于MPV持久性研究显示,接种MPV-A后抗体持久性与接种者年龄相关,<12月龄和12~17月龄婴儿接种2剂MPV-A保护性抗体分别维持1年和2年;18~23月龄、2~3岁和4岁婴幼儿接种1剂MPV-A保护性抗体分别维持1年、2年和3年[15];6月龄~15岁儿童接种1剂MPV-A后1年、2年和3年疫苗效力分别为98%、80%和67%,4年后基本无保护力[16];<4岁人群接种1剂MPV-A后1、2、3年后保护率分别为85%、52%、8%,≥4岁人群接种1剂MPV-A后1、2、3年保护率分别为100%、74%、67%[17];也有研究显示,24名2岁儿童接种1剂MPV-A后1年抗A群Nm的SBA基本下降到免疫前水平[18]。6~24月龄婴幼儿接种1剂MPV-AC后1年抗A群和C群Nm SBA阳性率分别为24%和20%,5~13岁儿童接种1剂MPV-AC后1年后抗A群和C群Nm SBA阳性率分别为91%和90%。<5岁儿童接种1剂MPV-ACYW后免疫持久性为1~3年,而青少年和成年人达3~5年[19]。11~17岁人群接种1剂MPV-ACYW后2年抗A群、C群、W135群和Y群Nm SBA阳性率分别为100%、99%、95%和97%;2~10岁人群接种1剂MPV-ACYW后5年抗C群Nm SBA阳性率为20.3%,11~18岁人群接种1剂MPV-ACYW后3年抗C群Nm SBA阳性率为72.9%[20](表 1)。
2. MPCV:国内多项关于MPCV-AC的免疫原性研究显示,3~5月龄婴儿间隔1个月接种2剂MPCV-AC,免疫后1个月抗A群和C群Nm SBA的阳转率均为100%[21],间隔1个月接种3剂MPCV-AC,免疫后1个月抗A群和C群Nm SBA的阳转率分别为99%~100%和97%~100%[7-8, 21];6~11月龄婴儿间隔1个月或3个月接种2剂MPCV-AC,免疫后1个月抗A群和C群Nm SBA的阳转率分别为96%~100%和97%~100%[21-22];12~23月龄婴幼儿间隔1个月接种2剂MPCV-AC,免疫后1个月抗A群和C群Nm SBA的阳转率均为100%[8];2~17岁儿童和青少年接种1剂MPCV-AC,免疫后1个月抗A群和C群Nm SBA的阳转率均为97%~100%[7-8, 21](表 1)。
国内外关于MPCV-AC的持久性研究显示,3~8月龄接种3剂次、1~2岁接种2剂次、3~4岁接种1剂次MPCV-AC后3年抗A群Nm SBA阳性率分别为98%、97%、97%,抗C群Nm SBA阳性率分别为77%、97%、85%[8]。但也有研究显示,2~3岁25名儿童接种1剂MPCV-AC后1年抗A群Nm SBA有明显下降,基本恢复到免疫前水平,仅有3名儿童抗体阳性[18](表 1)。
3.联合疫苗:国内临床试验显示2~5月龄婴儿间隔1个月接种3剂MPCV-AC-Hib,免疫后1个月抗A群和C群Nm SBA的阳转率分别为100%和93%;6~11月龄婴儿间隔1个月接种2剂MPCV-AC-Hib,免疫后1个月抗A群和C群Nm SBA的阳转率分别为100%和99%;12~23月龄婴儿接种1剂MPCV-AC-Hib,免疫后1个月抗A群和C群Nm SBA的阳转率分别为98%和99%[23](表 1)。
综上研究显示,<2岁婴儿接种MPCV的免疫原性明显优于MPV。3~5月龄婴儿接种3剂MPV-A或MPV-AC后产生的免疫应答较弱;6~11月龄婴儿接种2剂MPV-A可对A群Nm产生较好的免疫应答,接种1剂MPV-AC产生的免疫应答较弱;12~23月龄婴儿接种1剂或2剂MPV-A可对A群Nm产生较好的免疫应答,接种2剂MPV-AC后对A群Nm可产生较好的免疫应答,而对C群Nm的免疫应答较弱。3~5月龄婴儿接种2剂或3剂MPCV-AC,6~23月龄接种2剂MPCV-AC,均可对A群和C群Nm产生良好的免疫原性。2~17岁儿童和青少年以及≥18岁成年人接种1剂MPV-A、MPV-AC、MPV-ACYW或MPCV-AC均可对疫苗覆盖血清群Nm产生较好的免疫原性。2~5月龄婴儿接种3剂MPCV-AC-Hib、6~11月龄接种2剂MPCV-AC-Hib、12月龄~5岁接种1剂MPCV-AC-Hib均可对A群和C群Nm产生良好的免疫原性。对于MPV,<2岁儿童接种2剂或者1剂后保护性抗体可维持1~2年,≥2岁儿童接种1剂可维持2~3年,青少年及成人接种1剂可维持3~5年。对于MPCV,<1岁婴儿接种3剂、1~2岁接种2剂、3~4岁接种1剂后保护性抗体可维持3年。
二、疫苗安全性1. MPV:周晓华[27]研究显示,850名1.5~4岁儿童接种MPV-A后5 d内不良反应发生率为2.94%,其中发热发生率为2.11%,皮疹发生率为0.82%,皮疹以头面部发红、散在的皮疹为主,观察2~6 h后,自然消退。Gold等[28]观察发现,396名3~12月龄婴儿接种MPV-A和C群脑膜炎球菌多糖疫苗(group C meningococcal polysaccharide vaccine,MPV-C)后48 h内不良反应发生率为9.8%,3.9%的婴儿发生的局部反应直径<1 cm且持续时间<24 h,不良反应与疫苗型别、基础免疫、加强免疫均无关。国外在一项研究显示,30名成年人接种MPV-AC后72 h内不良反应包括轻微疼痛(84.2%)、注射部位肿胀(26.3%)、发红(23.7%)[29]。汤妍等[30]研究观察2 974名2~7岁儿童接种MPV-ACYW后1个月内不良反应发生率为12.71%,全身和局部反应发生率分别为11.50%、1.85%。全身反应以发热为主,发热发生率为10.96%,其次为疲倦乏力,发生率为0.44%,观察到哭闹11例、腹泻10例、恶心呕吐9例、哺乳或进食障碍2例、变态反应1例、其他反应7例,未观察到惊厥症状发生;局部反应以触痛为主,发生率为0.74%,其次为发红,发生率为0.67%,观察到硬结9例、肿胀9例、瘙痒3例、皮肤黏膜3例、皮疹1例,与国外相关研究结果类似[31-32]。国内不同研究者在2~7岁儿童中开展了不同生产企业的MPV-ACYW安全性评价,孟繁岳等[33]报道的不良反应发生率为13.79%,伍传宏等[13]报道的不良反应发生率为8.5%,陈万庚等[34]报道不良反应率为7.99%。
2. MPCV:刘文英[35]观察13 245例5~24月龄儿童接种MPCV-AC后不良反应发生率为0.8%,接种第1剂MPCV-AC后局部不良反应发生率为0.14%,其中疼痛0.30‰、发红0.45‰、肿胀0.38‰、硬结0.23‰、瘙痒0.08‰;接种第2剂后,上述局部反应发生率进一步降低,与接种第1剂后比较无显著性差异。接种第1剂MPCV-AC后全身不良反应发生率为0.54%,其中腹泻0.91‰、厌食0.83‰、过敏0.80‰、呕吐0.60‰、烦躁0.80‰、发热0.68‰、嗜睡0.91‰;接种第2剂后上述全身不良反应发生率进一步降低,与接种第1剂后相比腹泻、发热的发生率具有显著性差异,且上述症状均以轻度全身反应为主。
章冰等[36]观察15 000名6~24月龄儿童接种第1剂MPCV-AC后不良反应发生率为81.47‰,严重不良反应发生率为1.13‰,接种第2剂MPCV-AC后不良反应发生率为74.00‰,严重不良反应发生率为0.47‰。第1剂次疫苗接种出现发热反应的发生率为77. 47‰,第2剂次疫苗接种的发热反应发生率为71. 73‰,两剂次均无其他严重不良反应发生。
3.联合疫苗:李江嵘等[37]研究显示,40 226名2~71月龄婴幼儿接种MPCV-AC-Hib后不良事件发生率为0.13%;与疫苗有关的不良反应发生率为0.12%,局部反应主要为接种部位的皮疹0.008%、发红0.008%、肿胀0.008%和硬结0.003%;全身反应主要为发热0.053%、变态反应0.027%。李艳萍等[38]将MPCV-AC-Hib与已上市的MPCV-AC和b型流感嗜血杆菌结合疫苗(Hib疫苗)比较,观察其安全性发现,2、3、4月龄婴儿接种3剂MPCV-AC-Hib后安全性良好,主动监测的重度不良反应发生率低于MPCV-AC和Hib疫苗接种者。
综上研究结果显示,婴幼儿、儿童、青少年和成年人无论是接种MPV、MPCV还是接种含MPCV联合疫苗均未发生严重不良反应,常见的局部反应为接种部位疼痛、红肿等,常见的全身反应为发热、过敏,大多数表现较轻,可自行缓解,具有良好的安全性。
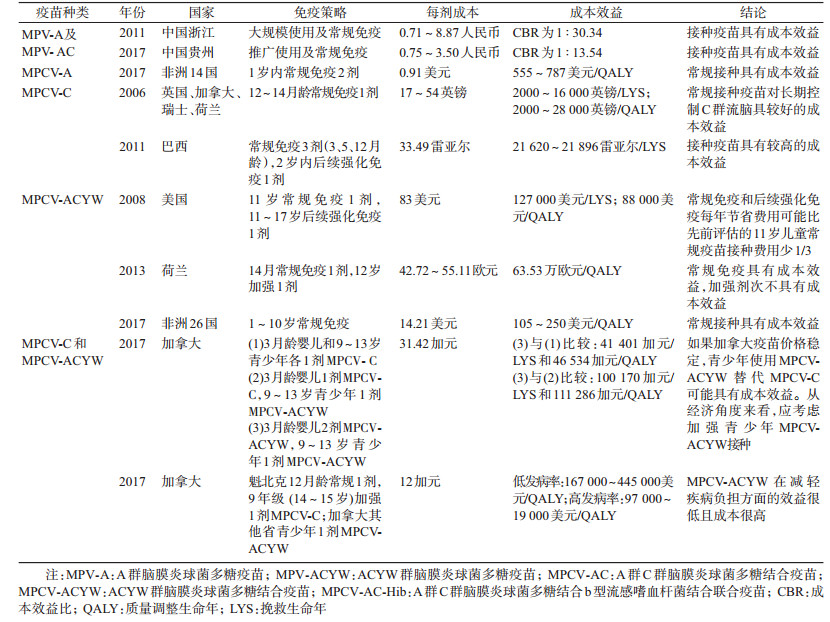
三、疫苗的成本效益Miller等[39-40]的研究表明,16个非洲脑膜炎流行带国家中有14个开展MPV的常规免疫具有成本效益;布基纳法索大规模MPV应急接种策略比使用1剂或4剂的常规免疫策略更有效,成本更低。2011年浙江省[41]、2017年贵州省[42]的研究显示,推广使用MPV-A和MPV-AC并将其纳入常规免疫具有较好的成本效益。2017年Kuznik等[43]研究发现,非洲14国常规接种MPCV-A具有成本效益。英国、加拿大、瑞士、荷兰4国[44]在引进C群脑膜炎多糖结合疫苗(group C meningococcal polysaccharide conjugate vaccine,MPCV-C)前开展了经济学评价,结论一致认为,儿童在12~14月龄常规接种1剂MPCV-C对长期控制C群脑膜炎具较好的成本效益。de Soarez等[45]对巴西2010年将MPCV-C纳入常规免疫及后续强化免疫策略的经济学评价结果表明,接种疫苗具有较高的成本效益。2005年四价ACYW群脑膜炎球菌多糖结合疫苗(group A,C,Y and W meningococcal polysaccharide conjugate combined vaccine,MPCV-ACYW)在美国注册批准,2008—2017年Ismael等[43-47]对美国、荷兰以及非洲26国的研究结果认为,常规和后续强化具较好的成本效益,加强免疫不具成本效益。Delea等[48]对加拿大MPCV-ACYW替代MPCV-C策略进行评价,结果显示,如果疫苗价格稳定,青少年使用MPCV-ACYW替代MPCV-C可能具有成本效益;de Wals和Zhou[49]研究认为,MPCV-ACYW在减轻疾病负担方面的效益很低且成本很高。迄今尚未见中国有关MPCV-C和MPCV-ACYW成本效益评价的研究(表 2)。
综上研究结果显示,MPV-A和MPV-AC的常规免疫及大规模应急接种具有成本效益。<1岁婴儿MPCV-A常规免疫具成本效益。3~14月龄婴儿MPCV-C常规免疫以及<2岁儿童的后续强化免疫具有成本效益。1~11岁儿童MPCV-ACYW的常规免疫以及11~17岁青少年的后续强化免疫具有成本效益。
利益冲突 所有作者均声明不存在利益冲突
志谢 参与本文编写的专家:北京市疾病预防控制中心吴疆、李娟;中国疾病预防控制中心李艺星、邵祝军、李军宏、朱兵清、吴丹;首都医科大学附属北京儿童医院姚开虎、刘钢;中国食品药品检定研究院叶强;重庆市疾病预防控制中心王青;广东省疾病预防控制中心孙立梅;贵州省疾病预防控制中心张丽;陕西省疾病预防控制中心张少白;山东省疾病预防控制中心刘桂芳;浙江省疾病预防控制中心陈恩富。对本文提供建议和指导的专家:中国疾病预防控制中心王华庆、尹遵栋、郑景山、刘大卫;江苏省疾病预防控制中心刁连东、汤奋扬;河南省疾病预防控制中心张延炀
| [1] |
李军宏, 李艺星, 吴丹, 等. 中国2006-2014年流行性脑脊髓膜炎病例菌群分布特征及变迁趋势[J]. 中国疫苗和免疫, 2015, 21(5): 481-485. Li JH, Li YX, Wu D, et al. Epidemiological characteristics of meningococcal meningitis and switching trend of serogroups of neisseria meningitidis in China, 2006-2014[J]. Chin J Vaccines Immun, 2015, 21(5): 481-485. |
| [2] |
Goldschneider I, Gotschlich EC, Artenstein MS. Human immunity to the meningococcus. Ⅰ. The role of humoral antibodies[J]. J Exp Med, 1969, 129(6): 1307-1326. DOI:10.1084/jem.129.6.1307 |
| [3] |
Borrow R, Anderews N, Goldblatt D, et al. Serological basis for use of meningococcal serogroup C conjugate vaccines in the United Kindom:Reevaluation of Correlates of protection[J]. Infect Immun, 2001, 69(3): 1568-1573. DOI:10.1128/IAI.69.3.1568-1573.2001 |
| [4] |
Borrow R, Balmer P, Miller E. Meningococcal surrogates of protection-serum bactericidal antibody activity[J]. Vaccine, 2005, 23(17/18): 2222-2227. DOI:10.1016/j.vaccine.2005.01.051 |
| [5] |
陈昌标, 姜仁杰, 马福宝, 等. A群脑膜炎球菌多糖结合疫苗安全性和免疫原性观察[J]. 中国疫苗和免疫, 2006, 12(5): 403-405. Chen CB, Jiang RJ, Ma FB, et al. Studies on safety and immunogenicity of group A meningococcal polysaccharide conjugate vaccine[J]. Chin J Vaccines Immun, 2006, 12(5): 403-405. DOI:10.3969/j.issn.1006-916X.2006.05.020 |
| [6] |
朱为, 叶强, 李荣成, 等. A群脑膜炎球菌多糖结合疫苗在6月龄~5岁儿童中的安全性与免疫原性研究[J]. 中国疫苗和免疫, 2008, 14(6): 485-488. Zhu W, Ye Q, Li RC, et al. Study on safety and immunogenicity of group A meningococcal polysaccharide conjugate vaccine to the children among 6 months to 5 years old[J]. Chin J Vaccines Immun, 2008, 14(6): 485-488. DOI:10.3969/j.issn.1006-916X.2008.06.002 |
| [7] |
陶红, 李亚楠, 伍传宏, 等. A+C群脑膜炎球菌多糖结合疫苗安全性和免疫原性研究[J]. 中国疫苗和免疫, 2009, 15(6): 531-535. Tao H, Li YN, Wu CH, et al. Study on safety and immunogenicity of group A/C meningococcal polysaccharide conjugate vaccine[J]. Chin J Vaccines Immun, 2009, 15(6): 531-535. |
| [8] |
郑佳, 朱向国, 刘刚, 等. A群C群脑膜炎球菌多糖结合疫苗的免疫原性及免疫持久性观察[J]. 中国生物制品学杂志, 2015, 28(7): 707-710. Zheng J, Zhu XG, Liu G, et al. Immunogenicity and immune persistence of groups A & C meningococcal polysaccharide conjugate vaccine[J]. Chin J Biologicals, 2015, 28(7): 707-710. |
| [9] |
何莉, 李荣成, 李亚南, 等. A+C群脑膜炎球菌多糖疫苗安全性和免疫原性的研究[J]. 中华流行病学杂志, 2007, 28(5): 422-425. He L, Li RC, Li YN, et al. Study on the safety and immunogenicity of group A+C meningococcal polysaccharide vaccine[J]. Chin J Epidemiol, 2007, 28(5): 422-425. DOI:10.3760/j.issn:0254-6450.2007.05.002 |
| [10] |
徐鹭, 路坚, 丁筱竹. 南京市健康儿童流脑A群和C群抗体水平监测及A+C群流脑疫苗免疫效果分析[J]. 现代预防医学, 2009, 36(11): 2048-2049, 2051. Xu L, Lu J, Ding XZ. Monitoring on the antibody levels of meningitis serogroup A and C and immunization effect of A and C meningococcal polysaccharide vaccine among health childern in Nanjing[J]. Mod Prev Med, 2009, 36(11): 2048-2049, 2051. |
| [11] |
闫绍宏, 张洪飞, 刘天英, 等. 冻干A+C群脑膜炎球菌多糖疫苗安全性和免疫原性观察[J]. 微生物学免疫学进展, 2009, 37(2): 16-18. Yan SH, Zhang HF, Liu TY, et al. Observation on the safety and immunogenicity of group A+C meningococcal polysaccharide vaccine[J]. Prog in Microbiol Immunol, 2009, 37(2): 16-18. DOI:10.3969/j.issn.1005-5673.2009.02.004 |
| [12] |
张辉, 胡树梅, 姜强, 等. ACYW135群脑膜炎球菌多糖疫苗的免疫原性评价[J]. 微生物学免疫学进展, 2012, 40(4): 6-9. Zhang H, Hu SM, Jiang Q, et al. The immune effect of group ACYW135 meningococcal polysaccharide vaccine[J]. Prog Microbiol Immunol, 2012, 40(4): 6-9. DOI:10.3969/j.issn.1005-5673.2012.04.002 |
| [13] |
伍传宏, 王跃进, 杭纪红, 等. A、C、W135、Y群脑膜炎球菌四价多糖疫苗的安全性和免疫原性研究[J]. 实用预防医学, 2007, 14(6): 1768-1770. Wu CH, Wang YJ, Hang JH, et al. Study on safety and immunicity of group ACYW135 meningococcal polysaccharide vaccine[J]. Pract Prev Med, 2007, 14(6): 1768-1770. DOI:10.3969/j.issn.1006-3110.2007.06.044 |
| [14] |
李亚南, 乔瑞洁, 梁丽, 等. 2~59岁健康人群接种ACYW135群脑膜炎球菌多糖疫苗的免疫原性观察[J]. 微生物学免疫学进展, 2012, 40(5): 15-19. Li YN, Qiao RJ, Liang L, et al. Immunogenicity of meningococcal groups ACYW135 polysaccharide vaccine inoculated in healthy population of age 2-59 years old[J]. Prog Microbiol Immunol, 2012, 40(5): 15-19. DOI:10.3969/j.issn.1005-5673.2012.05.003 |
| [15] |
Galazka A. Meningococcal disease and its control with meningococcal polysaccharide vaccines[J]. Bull World Health Organ, 1982, 60(1): 1-7. |
| [16] |
七省市"合理使用流脑菌苗研究"协作组. A群多糖脑膜炎菌苗最适免疫剂量的研究[J]. 中国公共卫生学报, 1994, 13(3): 164-166. Group of 7 Provincial Sanitary and Anti-epidemic Stations and Institute of Epidemiology and Microbiology. Study of effective dose of group A polysaccharide vaccination[J]. Chin J Public Health, 1994, 13(3): 164-166. |
| [17] |
Reingold AL, Broome CV, Bolan GA, et al. Age-specific differences in duration of clinical protection after vaccination with meningococcal polysaccharide A vaccine[J]. Lancet, 1985, 326(8447): 114-118. DOI:10.1016/S0140-6736(85)90224-7 |
| [18] |
Joseph H, Ryall R, Bybel M, et al. Immunogenicity and immunological priming of the serogroup A portion of a bivalent meningococcal A/C conjugate vaccine in 2-year-old children[J]. J Infect Dis, 2003, 187(7): 1142-1146. DOI:10.1086/368358 |
| [19] |
Gardner P. Prevention of meningococcal disease[J]. N Engl J Med, 2006, 355(5): 1466-1473. DOI:10.1056/NEJMcp063561 |
| [20] |
Committee on infectious diseases. Meningococcal conjugate vaccines policy update:booster dose recommendations[J]. Pediatrics, 2011, 128(6): 1213-1218. DOI:10.1542/peds.2011-2380 |
| [21] |
秦才珍, 王宏军, 陶红, 等. 不同剂量A/C群脑膜炎球菌多糖结合疫苗免疫学效果评价[J]. 中国疫苗和免疫, 2010, 16(5): 462-465. Qin CZ, Wang HJ, Tao H, et al. Study on immunogenicity between different doses of group A/C meningococcal polysaccharide conjugate vaccine[J]. Chin J Vaccines Immun, 2010, 16(5): 462-465. |
| [22] |
潘金仁, 陈会红, 李寿俊, 等. A群C群脑膜炎球菌多糖结合疫苗6月龄儿童初次免疫效果[J]. 中国疫苗和免疫, 2015, 21(5): 511-514. Pan JR, Chen HH, Li SJ, et al. Immunogenicity of group A and group C meningococcal conjugate vaccine after primary immunization in children aged 6 months[J]. Chin J Vaccines Immun, 2015, 21(5): 511-514. |
| [23] |
李亚南, 梁丽, 李艳萍, 等. A、C群脑膜炎球菌-b型流感嗜血杆菌多糖结合疫苗免疫学效果观察[J]. 中国生物制品学杂志, 2012, 25(9): 1190-1194, 1197. Li YN, Liang L, Li YP, et al. Immune effect of a meningococcal groups A & C/Haemophilus influenzae type b conjugate vaccine[J]. Chin J Biologicals, 2012, 25(9): 1190-1194, 1197. DOI:10.13200/j.cjb.2012.09.111.liyn.025 |
| [24] |
Quiambao BP, Jain H, Bavdekar A, et al. Persistence of the immune response two years after vaccination with quadrivalent meningococcal ACWY-tetanus toxoid conjugate vaccine (MenACWY-TT) in asian adolescents[J]. Human Vaccines Immun, 2016, 12(8): 2162-2168. DOI:10.1080/21645515.2016.1163455 |
| [25] |
周海, 李亚南, 谈晔, 等. A、C群脑膜炎球菌多糖结合疫苗免疫效果观察[J]. 中华预防医学杂志, 2014, 48(8): 737-738. Zhou H, Li YN, Tan Y, et al. Observation on effect of group A and group C meningococcal conjugate vaccine[J]. Chin J Prev Med, 2014, 48(8): 737-738. DOI:10.3760/cma.j.issn.0253-9624.2014.08.018 |
| [26] |
李亚南, 莫少军, 周富昌, 等. A群C群脑膜炎球菌结合疫苗的免疫效果[J]. 中国生物制品学杂志, 2014, 27(8): 1048-1051. Li YN, Mo SJ, Zhou FC, et al. Immune effect of groups A and C meningococcal conjugate vaccine[J]. Chin J Biologicals, 2014, 27(8): 1048-1051. DOI:10.13200/j.cnki.cjb.000504 |
| [27] |
周晓华. A群流脑多糖疫苗预防接种不良反应观察及处理[J]. 中国社区医师, 2011, 13(6): 23. Zhou XH. Observation and treatment of adverse reactions of Group A meningococcal polysaccharide vaccine vaccination[J]. Chin Commun Phys, 2011, 13(6): 23. DOI:10.3969/j.issn.1007-614x.2011.06.018 |
| [28] |
Gold R, Lepow ML, Goldschneider I, et al. Clinical evaluation of group A and group C meningococcal polysaccharide vaccines in infants[J]. J Clin Inivest, 1975, 56(6): 1536-1547. DOI:10.1172/JCI108235 |
| [29] |
Anderson EL, Bowers T, Mink CM, et al. Safety and immunogenicity of meningococcal A and C polysaccharide conjugate vaccine in adults[J]. Infect Immun, 1994, 62(8): 3391-3395. |
| [30] |
汤妍, 张吉凯, 梁剑, 等. A、C、Y、W135群脑膜炎球菌多糖疫苗安全性观察[J]. 热带医学杂志, 2013, 13(7): 901-903. Tang Y, Zhang JK, Liang J, et al. Safety of tetravalent meningococcal A, C, Y, W135 vaccine[J]. J Trop Med, 2013, 13(7): 901-903. |
| [31] |
Pichichero M, Casey J, Blatter M, et al. Comparative trial of the safety and immunogenicity of quadrivalent (A, C, Y, W-135) meningococcal polysaccharide-diphtheria conjugate vaccine versus quadrivalent polysaccharide vaccine in two-to ten-year-old children[J]. Pediatr Infect Dis J, 2005, 24(1): 57-62. DOI:10.1097/01.inf.0000148928.10057.86 |
| [32] |
Bermal N, Huang LM, Dubey AP, et al. Safety and immunogenicity of a tetravalent meningococcal serogroups A, C, W-135 and Y conjugate vaccine in adolescents and adults[J]. Hum Vaccin, 2011, 7(2): 239-247. DOI:10.4161/hv.7.2.14068 |
| [33] |
孟繁岳, 庄菱, 胡月梅, 等. 脑膜炎球菌多糖疫苗安全性及免疫原性评价[J]. 中国公共卫生, 2010, 26(12): 1534-1536. Meng FY, Zhuang L, Hu YM, et al. Evaluation on safety and immunogenicity of tetravalent A/C/W135/Y meningococcal polysaccharide vaccine[J]. Chin J Public Health, 2010, 26(12): 1534-1536. DOI:10.11847/zgggws2010-26-12-33 |
| [34] |
陈万庚, 马永法, 周爱庆. 国产ACYW135流脑多糖疫苗免疫安全性观察[J]. 现代预防医学, 2011, 38(24): 5131-5132. Chen WG, Ma YF, Zhou AQ. Observation on the safety of domestic ACYW135 group of epidemic cerebrospinal meningitis polysaccharide vaccine[J]. Mod Prev Med, 2011, 38(24): 5131-5132. |
| [35] |
刘文英. A、C群脑膜炎球菌多糖结合疫苗在5~24月龄儿童中接种的安全性评价[J]. 中国医学前沿杂志:电子版, 2015, 7(2): 65-67. Liu WY. Safety evaluation of inoculation of A, C meningococcal polysaccharide conjugate vaccine in children with age from 5 to 24 months[J]. Chin J Front Med Sci:Electr Ed, 2015, 7(2): 65-67. DOI:10.3969/j.issn.1674-7372.2015.02.025 |
| [36] |
章冰, 王少芳, 夏志才, 等. 宣城市A+C群脑膜炎球菌结合疫苗接种后不良反应观察[J]. 公共卫生与预防医学, 2015, 26(4): 78-80. Zhang B, Wang SF, Xia ZC, et al. Observation of adverse reactions of group A+C meningococcal conjugate vaccine in Xuancheng city[J]. J Pub Health Prev Med, 2015, 26(4): 78-80. |
| [37] |
李江嵘, 杨军, 刘晓强, 等. AC群脑膜炎球菌(结合)b型流感嗜血杆菌(结合)联合疫苗上市后2~71月龄儿童接种的安全性研究[J]. 中国疫苗和免疫, 2016, 22(5): 578-581. Li JR, Yang J, Liu XQ, et al. Safety of post-marketing group A and C meningococcal conjugate and Haemophilus type b conjugate combined vaccine among children aged 2-71 months[J]. Chin J Vaccines Immun, 2016, 22(5): 578-581. |
| [38] |
李艳萍, 方孔雄, 农艺, 等. AC群脑膜炎球菌-b型流感嗜血杆菌多糖(结合)联合疫苗在中国婴儿中的安全性和免疫原性[C]//第五次全国免疫诊断暨疫苗学术研讨会论文汇编.银川: 中华医学会微生物学与免疫学分会, 中国医药生物技术协会生物诊断技术分会, 2011. Li YP, Fang KX, Nong Y, et al. Safety and immunogenicity of group A and C meningococcal conjugate and Haemophilus type b conjugate combined vaccine in Chin infants[C]//Fifth National Symposium on Immunodiagnosis and Vaccines. Yinchuan, Ningxia, China, 2011. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZHYX201108003121.htm |
| [39] |
Miller MA, Wenger J, Rosenstein N, et al. Evaluation of meningococcal meningitis vaccination strategies for the meningitis belt in Africa[J]. Pediatr Infect Dis J, 1999, 18(12): 1051-1059. DOI:10.1097/00006454-199912000-00005 |
| [40] |
Miller MA, Shahab CK. Review of the cost effectiveness of immunisation strategies for the control of epidemic meningococcal meningitis[J]. Pharmacoeconomics, 2005, 23(4): 333-343. DOI:10.2165/00019053-200523040-00004 |
| [41] |
蒋征刚, 何寒青, 赵艳荣, 等. 浙江省1978-2007年脑膜炎球菌疫苗接种成本效果和效益分析[J]. 中国疫苗和免疫, 2011, 17(1): 54-58. Jiang ZZ, He HQ, Zhao YR, et al. Cost-effectiveness and cost-benefit analysis of meningococcal vaccine immunization in Zhejiang province from 1978 to 2007[J]. Chin J Vaccines Immun, 2011, 17(1): 54-58. |
| [42] |
张丽, 蒋凤, 管庆虎. 贵州省使用脑膜炎球菌多糖疫苗的成本效益分析[J]. 中国疫苗和免疫, 2017, 23(4): 369-374. Zhang L, Jiang F, Guan QH. Cost-benefit evaluation of meningococcal polysaccharide vaccination in Guizhou province[J]. Chin J Vaccines Immun, 2017, 23(4): 369-374. |
| [43] |
Kuznik A, Iliyasu G, Lamorde M, et al. Cost-effectiveness of expanding childhood routine immunization against Neisseria meningitidis serogroups C, W and Y with a quadrivalent conjugate vaccine in the African meningitis belt[J]. PLoS One, 2017, 12(11): e0188595. DOI:10.1371/journal.pone.0188595 |
| [44] |
de Wals P. Immunization strategies for the control of serogroup C meningococcal disease in developed countries[J]. Expert Rev Vaccines, 2006, 5(2): 269-275. DOI:10.1586/14760584.5.2.269 |
| [45] |
de Soarez PC, Sartori AMC, De Andrade Lagoa Nóbrega L, et al. Cost-effectiveness analysis of a universal infant immunization program with meningococcal C conjugate vaccine in Brazil[J]. Value Health, 2011, 14(8): 1019-1027. DOI:10.1016/j.jval.2011.05.045 |
| [46] |
Sanchez IRO, Meltzer MI, Shepard C, et al. Economics of an adolescent meningococcal conjugate vaccination catch-up campaign in the United States[J]. Clin Infect Dis, 2008, 46(1): 1-13. DOI:10.1086/524041 |
| [47] |
Hepkema H, Pouwels KB, van der Ende A, et al. Meningococcal serogroup A, C, W135 and Y conjugated vaccine:a cost-effectiveness analysis in the Netherlands[J]. PLoS One, 2013, 8(5): e65036. DOI:10.1371/journal.pone.0065036 |
| [48] |
Delea TE, Weycker D, Atwood M, et al. Cost-effectiveness of alternate strategies for childhood immunization against meningococcal disease with monovalent and quadrivalent conjugate vaccines in Canada[J]. PLoS One, 2017, 12(5): e175721. |
| [49] |
de Wals P, Zhou Z. Cost-effectiveness comparison of monovalent C versus quadrivalent ACWY meningococcal conjugate vaccination in Canada[J]. Pediatr Infect Dis J, 2017, 36(7): e203-e207. DOI:10.1097/INF.0000000000001512 |
 2019, Vol. 40
2019, Vol. 40