文章信息
- 孟子延, 张家友, 张哲罡, 罗丹, 杨晓明.
- Meng Ziyan, Zhang Jiayou, Zhang Zhegang, Luo Dan, Yang Xiaoming.
- 四价流感病毒灭活疫苗在18~64岁人群免疫原性和安全性的系统综述和Meta分析
- Immunogenicity of inacitivated quadrivalent influenza vaccine in adults aged 18-64 years: A systematic review and Meta-analysis
- 中华流行病学杂志, 2018, 39(12): 1636-1641
- Chinese Journal of Epidemiology, 2018, 39(12): 1636-1641
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2018.12.019
-
文章历史
收稿日期: 2018-07-09
2. 430207 武汉生物制品研究所
2. Wuhan Institute of Biological Products, Wuhan 430207, China
据WHO报道,每年预计有65万人死于与季节性流感有关的呼吸系统疾病[1]。在中国CDC的流感第496期(2018年6月11—17日)监测周报中,南方省份哨点医院监测的结果显示流感样病例占门诊急诊病例总数的4%,高于2016—2018年同期水平。然而,目前临床上尚缺乏特异性治疗流感的药物,且自2017年10月以来,在中国CDC的耐药性监测中,所有的甲型H1N1和H3N2亚型的流感毒株均对烷胺类药物耐药。
自1978年开始使用三价流感病毒灭活疫苗作为针对流感的主要预防策略起[2],三价流感病毒灭活疫苗一直有效的控制了流感在人群中的传播。然而,进入21世纪后,因三价流感病毒灭活疫苗对在世界范围内混合流行且具有交叉保护作用的2种乙型流感病毒株(B/Yamagata和B/Victoria)的防护作用相当有限[2-3],且导致WHO每年根据监测情况推荐的流行株频频出现错配现象[4-5],此种情况下,只包含一个乙型流感病毒亚型的三价流感病毒灭活疫苗已经不足以满意需求。
2012年2月,WHO推荐使用包括了2个乙型疫苗株的四价流感疫苗[6]。当月,第一支鼻用型四价流感疫苗(减毒)FluMist上市[7]。自此之后,多种四价流感疫苗陆续上市,我国已有多家公司或研究机构的四价流感病毒灭活疫苗也已经进入临床试验阶段,然而有关其在成年人群中接种的免疫效果差异较大,故我们尽可能的收集全面的数据,对四价流感病毒灭活疫苗的免疫原性和安全性作系统综述和Meta分析,为我国制定四价流感疫苗的免疫策略提供循证证据。
材料与方法1.文献纳入标准:
(1)研究对象:近10年公开发表在3个收录临床试验文献的数据库(Medline、Cochrane Library、Science Direct)的以英文形式发表的有关18~64岁人群接种四价流感病毒灭活疫苗免疫原性和安全性研究的文献。不包括中文文献。
(2)研究设计:随机对照试验(random control trial,RCT),样本来源为志愿者,严格的遵守知情同意原则。
(3)干预措施:试验组接种四价流感病毒灭活疫苗,对照组接种含1种B型株的三价流感病毒灭活疫苗;免疫途径为非优势臂三角肌注射;血样本采集日期为接种前和接种后21~28 d内。
(4)测量指标:4种疫苗株的抗体保护率(sero-protection rate,SPR)和抗体阳转率(sero-conversion rate,SCR),检测方法为血凝抑制法(hemagglutination-inhibition,HI),SPR定义为组内受试者HI抗体滴度≥1:40的比例;SCR定义为组内受试者接种前HI抗体滴度<1:10且接种后HI抗体滴度≥1:40,或接种前HI抗体滴度>1:10且免疫后HI抗体4倍增高的比例。
2.文献排除标准:①动物试验;②细胞基质来源的疫苗研究;③基因工程亚单位四价流感病毒灭活疫苗的研究;④联合使用其他疫苗。
3.检索策略:选择Medline、Cochrane Library、Science Direct数据库进行检索,检索时间为2008年1月至2018年5月。为尽可能的收集完整的数据,以Medline检索为例,检索式是以(流感疫苗主题词加Pubmed提示的全部自由词)And(哈佛大学医学图书馆对RCT试验的限定检索词)And(灭活疫苗主题词加Pubmed提示的全部自由词),再限定日期。手工检索近一年的特别相关的期刊Vaccine、Human Vaccines & Immunotherapeutics。
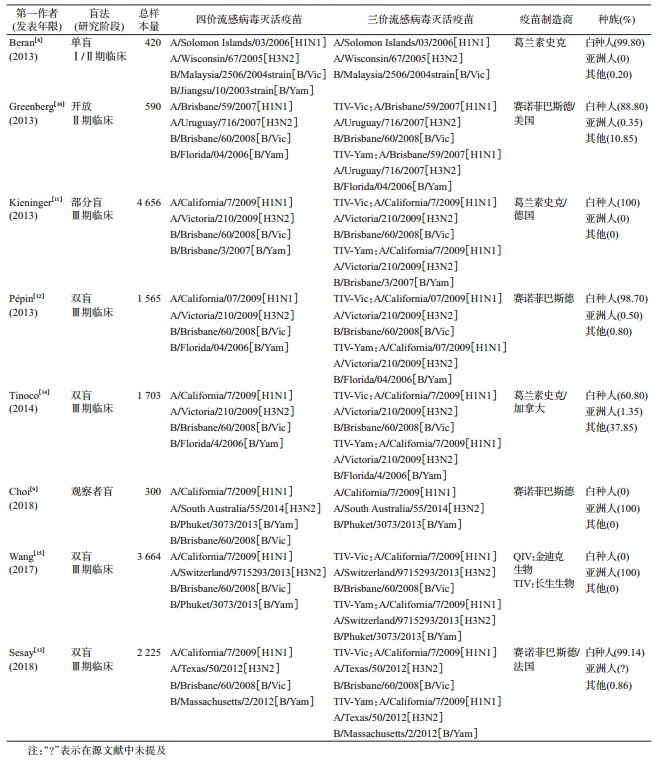
4.文献质量评价与数据提取:2名研究者独立的阅读文献标题、摘要进行初筛工作。对初筛得到的文章依据纳入与排除标准对全文进行阅读,以决定取舍。筛选过程中的不同意见,通过讨论解决,讨论仍有不同意见时,由第三人判断是否纳入。并且根据考克兰协作准则独立的评价纳入研究的偏倚风险。提取资料的内容包括:第一作者、发表年限、疫苗类型、疫苗制造商、测量指标、种族等。由于现有的研究对象中以白种人为主,而本研究感兴趣的是与中国人更相关,故提取的种族数据为白种人(西班牙裔、拉美裔在本篇文章中分在白种人内)、亚洲人、其他种族都归为其他。
5.资料分析方法:利用Revman 5.3软件对符合纳入标准的文献进行Meta分析,根据异质性检验情况,采用随机(固定)效应模型(如异质性较小,P>0.1时,选择固定效应模型),对各指标的RR值进行合并并计算其95%CI,检验水准α=0.05。使用逐篇文献排除的方法进行敏感性的分析,文献带来合并效应值<10%则被认为结果稳健。采用I2对异质性进行定量分析,I2<25%,被认为存在轻度的异质性;I2位于25%~50%之间时,认为存在中度的异质性;I2>50%则被认为存在高度异质性。
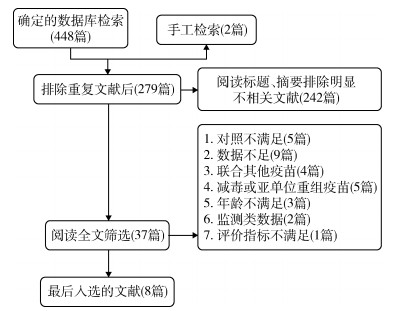
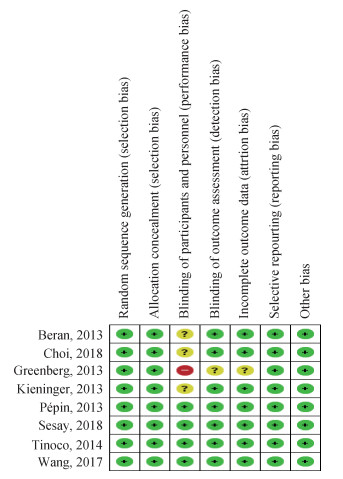
结果1.文献检索及文献质量评价:共检索得到文献450篇,最终符合纳入排除标准的文献8篇[8-15],流程图见图 1。8篇文献对随机和盲法等方面都有相应的描述,质量均较高,文献质量评价见图 2。敏感性分析发现在SPR for B/Victoria(B/Yamagata)分组下Wang等[15]的数据带来的合并RR=16.19%,超过了10%,其他各项指标变化均<10%,结果稳健。纳入文献的其他特征见表 1。
|
| 图 1 文献筛选流程图 |
|
| 图 2 纳入文献质量评价 |
2.免疫原性:
(1)抗体保护率:共7篇文献报道了接种四价和三价流感病毒灭活疫苗(B/Victoria)后对2种甲型疫苗株(A/H1N1、A/H3N2)的SPR数据。其SPR合并效应值分别为RRSPR(Vic)-A/H1N1=1.00(95%CI:0.99~1.02),RRSPR(Vic)-A/H3N2=1.00(95%CI:0.99~1.01),RRSPR(Yam)-A/H1N1=1.00(95%CI:0.99~1.02),RRSPR(Yam)-A/H3N2=1.00(95%CI:0.99~1.01),这4个甲型疫苗株的合并RR值相应的均P>0.05,差异无统计学意义。
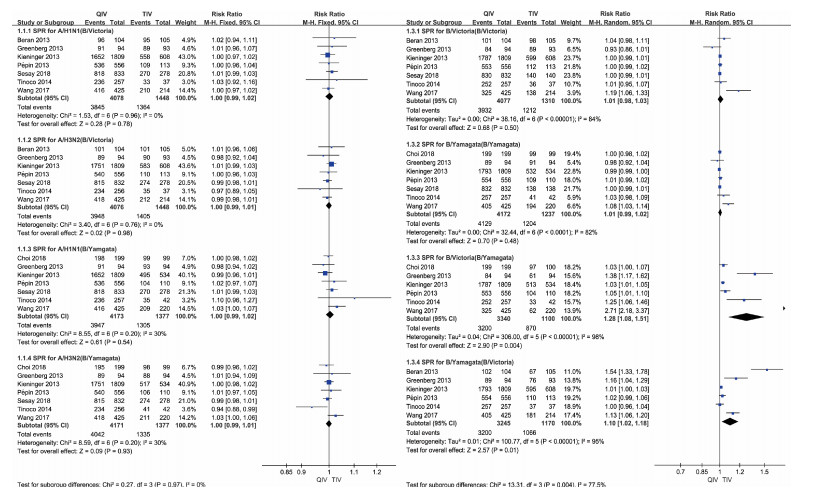
7篇文献报道了接种疫苗后2种乙型疫苗株(B/Victoria、B/Yamagata)的SPR信息。合并的效应值分别为RRSPR(Vic)-B/Vic=1.01(95%CI:0.98~1.03,P>0.05),RRSPR(Yam)-Y/Yam=1.01(95%CI:0.99~1.02,P>0.05),差异无统计学意义;RRSPR(Vic)-B/Yam=1.28(95%CI:1.08~1.51,P<0.05),RRSPR(Yam)-B/Vic=1.10(95%CI:1.02~1.18,P<0.05),差异有统计学意义,统计学上表明此时四价病毒灭活疫苗有略强的保护效果,结合医学背景知识,可以认为对于三价流感病毒灭活疫苗缺少的毒株类型,四价流感病毒灭活疫苗能够带来更好的保护效果。见图 3。
|
| 注:QIV:四价流感病毒灭活疫苗;TIV:三价流感病毒灭活疫苗 图 3 18~64岁人群接种四价流感病毒灭活疫苗和三价流感病毒灭活疫苗后抗体保护率Meta分析 |
(2)抗体阳转率:共有7篇文献报道了接种疫苗后2种甲型疫苗株(A/H1N1、A/H3N2)的SCR数据。合并的效应值分别为RRSCR(Vic)-A/H1N1=0.99(95%CI:0.96~1.03),RRSCR(Vic)-A/H3N2=0.97(95%CI:0.91~1.05),RRSCR(Yam)-A/H1N1=1.00(95%CI:0.96~1.04),RRSCR(Yam)-A/H3N2=0.95(95%CI:0.89~1.01)。这4个甲型疫苗株的合并RR值相应的均P>0.05,差异无统计学意义。
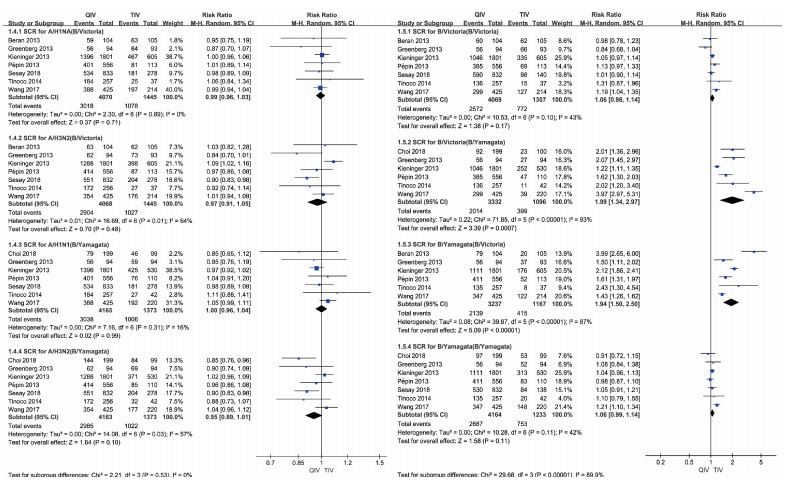
有7篇文献报道了接种疫苗后2种乙型疫苗株(B/Victoria、B/Yamagata)的SCR数据,合并的效应值分别为RRSCR(Vic)-B/Victoria=1.06(95%CI:0.98~1.14),RRSCR(Yam)-B/Yamagata=1.06(95%CI:0.99~1.14),均无统计学意义。RRSCR(Yam)-B/Vic=1.99(95%CI:1.34~2.97),RRSCR(Vic)-B/Yam=1.94(95%CI:1.50~2.50),这2项数据差异有统计学意义,统计学上表明此时四价流感病毒灭活疫苗较强的抗体阳转率,结合医学背景知识,可以认为对于三价流感病毒灭活疫苗缺少的毒株类型,四价流感病毒灭活疫苗能够带来更高的抗体阳转率。见图 4。
|
| 注:QIV:四价流感病毒灭活疫苗;TIV:三价流感病毒灭活疫苗 图 4 18~64岁人群接种四价流感病毒灭活疫苗和三价流感病毒灭活疫苗后抗体保护率差异Meta分析 |
全部纳入文献符合标准的有4 000人左右,相比于单个文献,样本量有了很大的提升;根据文献质量评价图,纳入文献的质量较高;依据文献的敏感性分析的结果,对Wang等[15]的结果进行了讨论,认为其带来合并RR值的改变可能是由于地区历史暴露情况导致人群自然感染不同,从而表现为本身的抗体水平的差异,所以仍然选择使用它。除此之外,其他文献带来的变化都<10%,结果稳健。本次纳入的文献只有8篇,故没有进行发表偏倚等分析。
乙型疫苗株的SPR和SCR分析显示了很高的局部异质性,但总体差异不大。异质性的来源可能是由于地区流行株的差异导致的历史暴露差异、参加试验的志愿者年龄、种族及其HI抗体应答反应个体差异、疫苗生产厂家不同等原因。比如,Sesay等[13]的研究含B/Victoria疫苗株的三价流感病毒灭活疫苗缺少对B/Yamagata亚型的抗体反应数据,含B/Yamagata疫苗株的三价流感病毒灭活疫苗缺少对B/Victoria的数据。另外,由于纳入研究的年龄分组均不同,为减少偏倚,本研究只选取了18~64岁组的数据。
由于样本来源为志愿者而非从自然人群中随机抽样,故可能会导致选择偏倚的产生。另一个局限是未进行安全性数据的分析,在近期Moa等[16]对于四价流感病毒灭活疫苗的Meta分析中关于安全性的部分,其结果为四价流感病毒灭活流感疫苗在局部和系统不良反应的发生上与三价流感病毒灭活流感疫苗没有差别。流感疫苗注射后出现的各个指标,如局部不良反应中的注射部位疼痛、红肿和系统不良反应中的发烧、头痛、虚弱都是临床上感兴趣的,仅以局部和系统不良反应代表各指标整体不能够令人满意。但由于入选的多篇文章在安全性指标的报道上有较多的不一致,且本研究制定的纳入排除标准会丢失掉一部分含有各指标安全性数据的文章,故可能会因为入选文章的不全而有局限性,故对于各个指标的安全性分析,还需要进一步的工作。
本研究虽然存在局限性,但基本能够说明四价灭活疫苗与三价流感病毒灭活疫苗相比,接种后对于含有相同疫苗株的抗体保护率SPR和抗体阳转率SCR没有差异,而对于三价流感病毒灭活疫苗不包含的乙型疫苗株(B/Victoria、B/yamagata),四价流感病毒灭活疫苗的效果高于三价流感病毒灭活疫苗,且2种乙型疫苗株之间的交叉保护效应有限,与Moa等[16]的结论一致。
利益冲突 无
| [1] |
World Health Organization. Up to 650000 people die of respiratory diseases linked to seasonal flu each year[2017-12-19]. http://cdrwww.who.int/mediacentre/news/statements/2017/flu/en/
|
| [2] |
Hannoun C. The evolving history of influenza viruses and influenza vaccines[J]. Expert Rev Vaccines, 2013, 12(9): 1085-1094. DOI:10.1586/14760584.2013.824709 |
| [3] |
McCullers JA, Saito T, Iverson AR. Multiple genotypes of influenza B virus circulated between 1979 and 2003[J]. J Virol, 2004, 78(23): 12817-12828. DOI:10.1128/JVI.78.23.12817-12828.2004 |
| [4] |
Caini S, Huang QS, Ciblak MA, et al. Epidemiological and virological characteristics of influenza B:results of the Global Influenza B Study[J]. Influenza Other Respir Viruses, 2015, 9(Suppl 1): 3-12. DOI:10.1111/irv.12319 |
| [5] |
United States Centers for Disease Control and Prevention: Seasonal influenza activity surveillance reports: 2000-2001 to 2010-2011 seasons[EB/OL]. http://www.cdc.gov/flu/weekly/fluactivitysurv.htm.
|
| [6] |
World Health Organization. Recommended composition of influenza virus vaccines for use in the 2012-2013 northern hemisphere influenza season[EB/OL]. (2012-02)[2018-05-12]. http://www.who.int/influenza/vaccines/virus/recommendations/201202_recommendation.pdf.
|
| [7] |
Block SL, Falloon J, Hirschfield JA, et al. Immunogenicity and safety of a quadrivalent live attenuated influenza vaccine in children[J]. Pediatr Infect Dis J, 2012, 31(7): 745-751. DOI:10.1097/INF.0b013e31825687b0 |
| [8] |
Beran J, Peeters M, Dewé W, et al. Immunogenicity and safety of quadrivalent versus trivalent inactivated influenza vaccine:a randomized, controlled trial in adults[J]. BMC Infect Dis, 2013, 13: 224. DOI:10.1186/1471-2334-13-224 |
| [9] |
Choi WS, Noh JY, Lee J, et al. Immunogenicity and safety of a split-virion quadrivalent influenza vaccine in adults 18-60 years of age in the Republic of Korea[J]. Hum Vaccin Immunother, 2018, 14(3): 587-592. DOI:10.1080/21645515.2017.1381808 |
| [10] |
Greenberg DP, Robertson CA, Noss MJ, et al. Safety and immunogenicity of a quadrivalent inactivated influenza vaccine compared to licensed trivalent inactivated influenza vaccines in adults[J]. Vaccine, 2013, 31(5): 770-776. DOI:10.1016/j.vaccine.2012.11.074 |
| [11] |
Kieninger D, Sheldon E, Lin WY, et al. Immunogenicity, reactogenicity and safety of an inactivated quadrivalent influenza vaccine candidate versus inactivated trivalent influenza vaccine:a phase Ⅲ, randomized trial in adults aged ≥ 18 years[J]. BMC Infect Dis, 2013, 13: 343. DOI:10.1186/1471-2334-13-343 |
| [12] |
Pépin S, Donazzolo Y, Jambrecina A, et al. Safety and immunogenicity of a quadrivalent inactivated influenza vaccine in adults[J]. Vaccine, 2013, 31(47): 5572-5578. DOI:10.1016/j.vaccine.2013.08.069 |
| [13] |
Sesay S, Brzostek J, Meyer I, et al. Safety, immunogenicity, and lot-to-lot consistency of a split-virion quadrivalent influenza vaccine in younger and older adults:A phase Ⅲ randomized, double-blind clinical trial[J]. Hum Vaccin Immunother, 2018, 14(3): 596-608. DOI:10.1080/21645515.2017.1384106 |
| [14] |
Tinoco JC, Pavia-Ruz N, Cruz-Valdez A, et al. Immunogenicity, reactogenicity, and safety of inactivated quadrivalent influenza vaccine candidate versus inactivated trivalent influenza vaccine in healthy adults aged ≥ 18 years:a phase Ⅲ, randomized trial[J]. Vaccine, 2014, 32(13): 1480-1487. DOI:10.1016/j.vaccine.2014.01.022 |
| [15] |
Wang SY, Liu SZ, Chu K, et al. Immunogenicity and safety of an inactivated quadrivalent influenza vaccine candidate versus inactivated trivalent influenza vaccines in participants ≥ 3 years of age:a double-blind, randomized, parallel-controlled phase Ⅲ clinical trial in China[J]. Expert Rev Vaccines, 2017, 16(11): 1155-1169. DOI:10.1080/14760584.2017.1374181 |
| [16] |
Moa AM, Chughtai AA, Muscatello DJ, et al. Immunogenicity and safety of inactivated quadrivalent influenza vaccine in adults:A systematic review and meta-analysis of randomised controlled trials[J]. Vaccine, 2016, 34(35): 4092-4102. DOI:10.1016/j.vaccine.2016.06.064 |
 2018, Vol. 39
2018, Vol. 39