文章信息
- 丁玲, 冯美娟, 刘春亮, 王璐, 宋志超, 杨倩, 李小雪, 宋丽, 高雯, 王金桃.
- Ding Ling, Feng Meijuan, Liu Chunliang, Wang Lu, Song Zhichao, Yang Qian, Li Xiaoxue, Song Li, Gao Wen, Wang Jintao.
- hnRNP K在宫颈上皮内瘤样变中的作用及其与HPV16交互效应
- Effect of hnRNP K and its interaction with HPV16 on cervical intraepithelial neoplasia
- 中华流行病学杂志, 2018, 39(12): 1630-1635
- Chinese Journal of Epidemiology, 2018, 39(12): 1630-1635
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2018.12.018
-
文章历史
收稿日期: 2018-06-06
宫颈癌是多阶段发展的最常见的妇科恶性肿瘤之一[1]。人乳头瘤病毒(human papillomavirus,HPV)感染特别是高危型HPV16感染是最常见的致癌型别,与宫颈病变的发生、发展密切相关[2-3]。核不均一核糖核蛋白(heterogeneous nuclear ribonucleoproteins,hnRNPs)是细胞内含有的一类RNA结合蛋白,对mRNA的剪切、运输、翻译等核酸代谢过程具有调控作用[4]。hnRNP K作为hnRNPs的重要成员,具有独特的高度保守的KH(K homology)结构域,可与核酸富含嘧啶区域相结合而发挥作用[5],为hnRNP K与DNA和RNA的结合提供了结构基础。而作为DNA病毒的HPV16,在其参与转录、复制过程的LCR区内,又提供了多个可能与RNA结合蛋白结合的位点[6]。提示hnRNP K具有实现调控基因转录的结构特点[5, 7-8],可能参与HPV16基因的表达及其生物学功能[7]。现有研究显示,在多种肿瘤组织中hnRNP K呈异常高表达[9-10],但亦有结果不一致的报道[11]。本研究旨在探讨hnRNP K与HPV16感染在宫颈上皮内瘤样变(cervical intraepithelial neoplasia,CIN)中的作用及其交互效应。
对象与方法1.研究对象:于2014年6月至2015年6月在山西省介休市建立的宫颈病变社区队列中,选取经宫颈液基细胞学(thinprep cytologic test,TCT)检查结果为意义不明确的非典型鳞状细胞(atypical squamous cells of undetermined significance,ASCUS)及以上的女性,除腺细胞异常者外,行阴道镜检查,最终经病理学确诊的正常宫颈(normal cervix,NC)女性67例、CINⅠ患者69例、CINⅡ/Ⅲ患者68例作为研究对象。排除妊娠或哺乳期女性、宫颈及阴道病变治疗史者、其他恶性肿瘤患者、严重心、肝、肾等系统疾病者,以及调查资料或生物样本不合格者。所有研究对象均签署了知情同意书,本研究已获得山西医科大学伦理委员会批准。
2.资料收集:采用统一的结构式调查问卷,由专门培训的调查员对研究对象进行面对面调查,调查内容主要包括人口学资料、月经、婚育史、既往病史、个人卫生习惯情况等。由专职妇科医生采集宫颈脱落细胞及阴道镜或手术获取的宫颈组织样本,-80 ℃保存,用于HPV16与hnRNP K蛋白表达水平的检测。
3.实验方法:
(1)采用分子导流杂交技术检测HPVs及HPV16的感染状况:采用广东凯普生物科技股份有限公司的HPV分型检测试剂盒,应用低密度基因芯片、PCR与导流杂交的结合技术,检测宫颈脱落细胞中14种高危型(HPV16、18、31、33、35、39、45、51、52、56、58、59、66、68)、1种疑似高危型(HPV53)和6种低危型(HPV6、11、42、43、44、CP8304)共21种常见型别的感染状况。操作方法:煮沸法提取脱落细胞中的DNA作为模板;PCR扩增条件:95 ℃预变性5 min;95 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,40个循环;72 ℃延伸5 min。采用HB-2012A杂交仪进行导流杂交检测后酶标显色。阳性结果为清晰可见的蓝紫色圆点,任意型别位点处显示蓝紫色即可判定为HPV感染,并根据相应位点判别病毒感染类型,并设立阳性及阴性对照进行质量控制。
(2)采用Western blot技术检测hnRNP K蛋白表达水平:从宫颈组织样本中提取总蛋白,利用BCA蛋白定量。取50 μg蛋白提取样品,进行10%聚丙烯酰胺凝胶电泳,剪取包含hnRNP K与β-actin蛋白条带的凝胶,转膜至0.45 μm孔径的NC膜,5%脱脂奶粉封闭非特异性抗原,分别加入鼠抗人hnRNP K(1:1 000)与β-actin(1:300)单克隆抗体(英国Abcam公司)于4 ℃孵育12 h,洗膜,加入辣根过氧化物酶标记的羊抗鼠IgG二抗(美国Boster Bio公司)常温孵育1 h,暗室中超敏发光液显影,在55 kDa、43 kDa处为hnRNP K、β-actin相应蛋白条带,使用Image Lab系统测定蛋白条带灰度值并进行图像采集。蛋白相对表达水平的计算:hnRNP K蛋白与内参蛋白β-actin灰度值之比。
4.统计学分析:应用SPSS 23.0软件进行相关资料的整理与分析。计量资料采用M(QR)进行描述,计数资料采用构成比(%)进行描述;组间各因素比较采用χ2检验、趋势χ2检验、Kruskal-Wallis H检验;3组间两两比较hnRNP K蛋白表达量采用Bonferroni法;以NC组为对照,采用非条件logistic回归模型计算调整相关因素前后的HPV16感染、hnRNP K蛋白与CIN的关联强度OR值及其95%CI;hnRNP K蛋白与HPV16在CIN发生中的交互效应分析采用相加交互效应模型及其交互作用效应指标超额相对危险度(relative excess risk of interaction,RERI)、交互作用归因比(attributable proportion of interaction,API)和交互作用指数(synergy index,SI)进行评价,若RERI或API>0,或SI>1(3个指标满足1个即可)则存在生物学正相加交互作用[12]。检验水准α=0.05,Bonferroni法进行3组计量资料间两两多重比较时,α’=0.017。
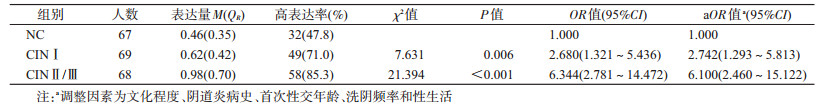
结果1.人口学特征及宫颈病变相关因素:NC组、CINⅠ组与CINⅡ/Ⅲ组在年龄、民族、婚姻状况、居住地、肿瘤家族史、饮酒吸烟史、孕产次、月经初潮年龄、首次生育年龄和经期性生活方面分布均衡(P>0.05),而在文化程度、阴道炎病史、首次性交年龄、洗阴频率和性生活后清洗方面差异有统计学意义(P<0.05),见表 1。
2. HPV16感染与CIN的关系:NC、CINⅠ和CINⅡ/Ⅲ组HPV16的感染率分别为10.4%、14.5%和41.2%,经χ2检验差异有统计学意义(χ2=22.007,P<0.001),且随着宫颈病变的加重,HPV16的感染率逐渐升高(趋势χ2=18.512,P<0.001)。在调整宫颈病变相关影响因素后,与NC组相比,HPV16感染与CINⅡ/Ⅲ的关联强度有统计学意义(OR=5.399,95%CI:2.003~14.555),见表 2。
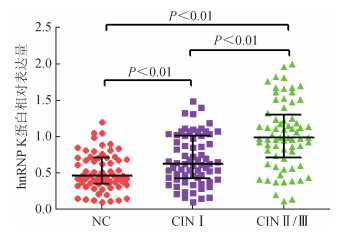
3. hnRNP K蛋白表达与CIN的关系:hnRNP K蛋白在不同CIN组的表达情况见图 1。hnRNP K表达量在不同宫颈病变组差异有统计学意义(H=48.138,P<0.001),采用Bonferroni法进行3组间多重比较,参照检验水准α’即α/比较次数,结果显示hnRNP K表达量在NC、CINⅠ和CINⅡ/Ⅲ组任意两组间差异均有统计学意义(P<0.01),见图 2。进一步以NC组hnRNP K蛋白表达量的中位值(0.46)作为hnRNP K的分界点(>0.46定为高表达,≤0.46定为低表达)进行分析,结果表明,hnRNP K蛋白表达在3组间差异有统计学意义(χ2=22.296,P<0.001),且随着宫颈病变程度的进展加重,hnRNP K蛋白表达量逐渐升高(趋势χ2=21.765,P<0.001)。在调整宫颈病变相关影响因素后,以NC为对照,hnRNP K蛋白与CINⅠ和CINⅡ/Ⅲ组的关联强度依次为2.742(1.293~5.813)和6.100(2.460~15.122),见表 3。

|
| 图 1 不同级别宫颈病变组织中hnRNP K蛋白条带 |
|
| 图 2 不同级别宫颈病变组织中hnRNP K蛋白相对表达量 |
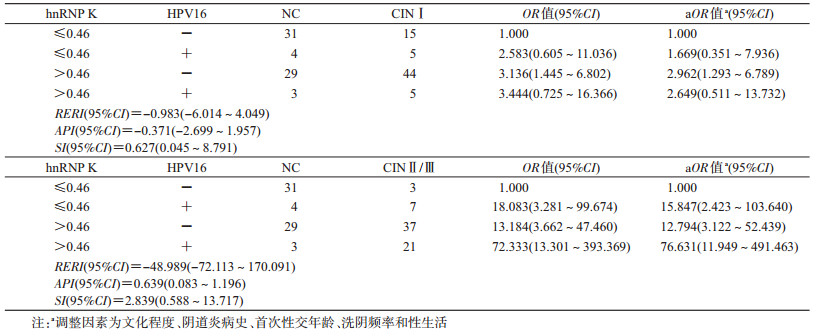
4. hnRNP K蛋白表达与HPV16感染的交互效应分析:以NC组作为对照,hnRNP K蛋白量≤0.46同时HPV16阴性感染作为阴性对照,应用相加作用效应模型对不同CIN组进行hnRNP K蛋白表达与HPV16的交互作用分析,结果显示,hnRNP K蛋白高表达与HPV16感染在CINⅡ/Ⅲ存在正相加交互作用,API(0.639,95%CI:0.083~1.196)不包括0;而在CINⅠ组尚未发现类似交互作用(表 4)。
宫颈癌是复杂病因综合作用的结果。基于山西省的人群研究显示,高危型HPV16感染是宫颈病变的主要感染型别,明显高于其他高危型别的感染率[3]。本研究采用导流杂交技术精确检测HPV16感染状况,结果表明,HPV16检出率随宫颈上皮病变程度的加重而呈递增趋势,高度CIN组的感染率为41.2%,显著高于低度CIN组和宫颈炎组,与本组前期研究结果一致[13],提示HPV16感染是早期宫颈病变的重要标志。
hnRNP K是机体内普遍存在的一类核酸结合蛋白,在细胞增殖和细胞凋亡中发挥着重要作用。人群研究与体外实验研究的结果表明,hnRNP K异常高表达可增加多种肿瘤发生的风险[9-10]。本研究选择不同病变程度的宫颈癌前病变女性,包括NC、CINⅠ和CINⅡ/Ⅲ者为研究对象,结果显示,hnRNP K蛋白表达量在CINⅡ/Ⅲ最高,且随着宫颈病变程度的加重呈逐渐升高趋势。hnRNP K可能与多种抑癌基因协同作用,减弱其对细胞周期的负调控作用[14-15],亦可能通过剪切调控作用,抑制凋亡蛋白的产生,导致细胞凋亡的减少[16],从而促进细胞增殖,导致细胞恶性转化。
宫颈癌变进展中,HPV早期癌基因E6和E7的高表达是目前公认的致癌机制。HPV16早期基因表达在基因转录、mRNA选择性剪切、mRNA多聚腺苷酸化等水平受到RNA结合蛋白的调控[17]。hnRNP K是一种RNA结合蛋白,具有独特的KH、KNS(K specific nuclear shuttling)和KI(K protein- interactive)结构域,可与DNA、RNA和蛋白特异结合,发挥调控基因转录、mRNA可变剪切、mRNA多聚腺苷酸化等一系列生物学功能。现有研究表明,hnRNP K可与HBV/HCV、甲型流感病毒等病毒DNA或RNA相互作用,调节病毒的复制、转录和翻译[18-20]。当HPV16感染上皮细胞时,hnRNP A1表达上调,并可通过绑定HPV16晚期调控元件(late regulatory element,LR)来促进HPV16 mRNA的剪接及晚期蛋白的合成[21]。hnRNP H亦可与HPV16 L1晚期蛋白结合并促进L1蛋白的合成,从而提高HPV16的复制速度[22]。提示,HPV16可与hnRNPs相结合,从而发挥调控HPV16表达的作用。本研究对不同宫颈癌前病变组进行了hnRNP K蛋白表达与HPV16感染的交互作用分析,结果显示hnRNP K蛋白高表达与HPV16感染者患CINⅡ/Ⅲ的风险性明显高于单纯hnRNP K蛋白高表达者或单纯HPV16感染者,提示hnRNP K蛋白高表达和HPV16感染在宫颈恶性病变进展中存在正相加交互作用,hnRNP K蛋白高表达可能通过调控和促进HPV16的癌基因表达,从而提高HPV16感染者致宫颈癌变的风险。但本研究仅揭示了hnRNP K、HPV16与不同CIN的相关关系,这是本研究的局限所在。为进一步探讨hnRNP K对宫颈病变预后以及HPV16基因整合的影响,尚需进行前瞻性队列研究,以及深入的分子机制研究。
利益冲突 无
| [1] |
Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide:sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359-386. DOI:10.1002/ijc.29210 |
| [2] |
Guan P, Howell-Jones R, Li N, et al. Human papillomavirus types in 115789 HPV-positive women:a meta-analysis from cervical infection to cancer[J]. Int J Cancer, 2012, 131(10): 2349-2359. DOI:10.1002/ijc.27485 |
| [3] |
Zhao XL, Hu SY, Zhang Q, et al. High-risk human papillomavirus genotype distribution and attribution to cervical cancer and precancerous lesions in a rural Chinese population[J]. J Gynecol Oncol, 2017, 28(4): e30. DOI:10.3802/jgo.2017.28.e30 |
| [4] |
Han SP, Tang YH, Smith R. Functional diversity of the hnRNPs:past, present and perspectives[J]. Biochem J, 2010, 430(3): 379-392. DOI:10.1042/bj20100396 |
| [5] |
Choi HS, Hwang CK, Song KY, et al. Poly(C)-binding proteins as transcriptional regulators of gene expression[J]. Biochem Biophys Res Commun, 2009, 380(3): 431-436. DOI:10.1016/j.bbrc.2009.01.136 |
| [6] |
Johansson C, Schwartz S. Regulation of human papillomavirus gene expression by splicing and polyadenylation[J]. Nat Rev Microbiol, 2013, 11(4): 239-251. DOI:10.1038/nrmicro2984 |
| [7] |
Napthine S, Treffers EE, Bell S, et al. A novel role for poly(C) binding proteins in programmed ribosomal frameshifting[J]. Nucleic Acids Res, 2016, 44(12): 5491-5503. DOI:10.1093/nar/gkw480 |
| [8] |
Kajitani N, Schwartz S. RNA binding proteins that control human papillomavirus gene expression[J]. Biomolecules, 2015, 5(2): 758-774. DOI:10.3390/biom5020758 |
| [9] |
Lu J, Gao FH. Role and molecular mechanism of heterogeneous nuclear ribonucleoprotein K in tumor development and progression[J]. Biomed Rep, 2016, 4(6): 657-663. DOI:10.3892/br.2016.642 |
| [10] |
Carpenter B, MacKay C, Alnabulsi A, et al. The roles of heterogeneous nuclear ribonucleoproteins in tumour development and progression[J]. Biochim Biophys Acta, 2006, 1765(2): 85-100. DOI:10.1016/j.bbcan.2005.10.002 |
| [11] |
Gallardo M, Lee HJ, Zhang XR, et al. hnRNP K is a Haploinsufficient tumor suppressor that regulates proliferation and differentiation programs in hematologic malignancies[J]. Cancer Cell, 2015, 28(4): 486-499. DOI:10.1016/j.ccell.2015.09.001 |
| [12] |
Knol MJ, VanderWeele TJ. Recommendations for presenting analyses of effect modification and interaction[J]. Int J Epidemiol, 2012, 41(2): 514-520. DOI:10.1093/ije/dyr218 |
| [13] |
南晶, 丁玲, 刘学智, 等. 叶酸与HPV16 E6/E7 mRNA表达在宫颈癌变中的交互作用[J]. 中华流行病学杂志, 2016, 37(6): 852-857. Nan J, Ding L, Liu XZ, et al. Interaction between folate and the expression of human papillomavirus 16 E6/E7 mRNA in the progression of cervix carcinogenesis[J]. Chin J Epidemiol, 2016, 37(6): 852-857. DOI:10.3760/cma.j.issn.0254-6450.2016.06.022 |
| [14] |
Moumen A, Masterson P, O'Connor MJ, et al. hnRNP K:an HDM2 target and transcriptional coactivator of p53 in response to DNA damage[J]. Cell, 2005, 123(6): 1065-1078. DOI:10.1016/j.cell.2005.09.032 |
| [15] |
Yano M, Okano HJ, Okano H. Involvement of Hu and heterogeneous nuclear ribonucleoprotein K in neuronal differentiation through p21 mRNA post-transcriptional regulation[J]. J Biol Chem, 2005, 280(13): 12690-12699. DOI:10.1074/jbc.m411119200 |
| [16] |
Revil T, Pelletier J, Toutant J, et al. Heterogeneous nuclear ribonucleoprotein K represses the production of pro-apoptotic Bcl-xS splice isoform[J]. J Biol Chem, 2009, 284(32): 21458-21467. DOI:10.1074/jbc.m109.019711 |
| [17] |
Xiao SH, Tang YS, Khan RA, et al. Influence of physiologic folate deficiency on human papillomavirus type 16(HPV16)-harboring human keratinocytes in vitro and in vivo[J]. J Biol Chem, 2012, 287(15): 12559-12577. DOI:10.1074/jbc.m111.317040 |
| [18] |
Ng LF, Chan M, Chan SH, et al. Host heterogeneous ribonucleoprotein K (hnRNP K) as a potential target to suppress hepatitis B virus replication[J]. PLoS Med, 2005, 2(7): e163. DOI:10.1371/journal.pmed.0020163 |
| [19] |
Fan BC, Lu KY, Sutandy FXR, et al. A human proteome microarray identifies that the heterogeneous nuclear ribonucleoprotein K (hnRNP K) recognizes the 5'terminal sequence of the hepatitis C virus RNA[J]. Mol Cell Proteomics, 2014, 13(1): 84-92. DOI:10.1074/mcp.m113.031682 |
| [20] |
Tsai PL, Chiou NT, Kuss S, et al. Cellular RNA binding proteins NS1-BP and hnRNP K regulate influenza A virus RNA splicing[J]. PLoS Pathog, 2013, 9(6): e1003460. DOI:10.1371/journal.ppat.1003460 |
| [21] |
Cheunim T, Zhang JX, Milligan SG, et al. The alternative splicing factor hnRNP A1 is up-regulated during virus-infected epithelial cell differentiation and binds the human papillomavirus type 16 late regulatory element[J]. Virus Res, 2008, 131(2): 189-198. DOI:10.1016/j.virusres.2007.09.006 |
| [22] |
Zheng ZZ, Sun YY, Zhao M, et al. Specific interaction between hnRNP H and HPV16 L1 proteins:implications for late gene auto-regulation enabling rapid viral capsid protein production[J]. Biochem Biophys Res Commun, 2013, 430(3): 1047-1053. DOI:10.1016/j.bbrc.2012.12.042 |
 2018, Vol. 39
2018, Vol. 39