文章信息
- 游楠楠, 刘巧, 竺丽梅, 陆伟.
- You Nannan, Liu Qiao, Zhu Limei, Lu Wei.
- 卡介苗接种与复种的研究进展
- Progress in research of bacillus calmette-guerin vaccination and repeated vaccination
- 中华流行病学杂志, 2018, 39(11): 1519-1523
- Chinese Journal of Epidemiology, 2018, 39(11): 1519-1523
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2018.11.019
-
文章历史
收稿日期: 2018-05-11
2. 210009 南京, 东南大学公共卫生学院流行病与卫生统计学系
2. Department of Epidemiology and Biostatistics, School of Public Health, Southeast University, Nanjing 210009, China
结核病是严重威胁人类健康的重大传染病,据WHO最新报告显示[1],2016年全球约有1 040万结核病新发病例,约170万人死于结核病,成为全球首位致死性传染性疾病。卡介苗作为唯一批准的抗结核疫苗,距1921年首例儿童接种卡介苗已近一百年。本文通过分析卡介苗特性、免疫效果及免疫持久力,并综述已有研究成果,总结卡介苗接种及复种效果,为我国开展相关免疫策略提供依据。
一、卡介苗的特性及免疫效果1.卡介苗的概念及特性:卡介苗是一种活菌苗,1908年法国科学家Calmette和Guerin从患结核性乳腺炎的奶牛身上分离出牛型结核分枝杆菌[2]。到1921年,经过13年231代的连续培养和传代,其毒力大大降低,但其免疫原性却得以保持[3]。1974年,卡介苗被WHO纳入扩大免疫规划[4]。目前卡介苗仍是唯一批准广泛使用的抗结核疫苗,全球已有40多亿人接种该疫苗[5]。
卡介苗免疫接种诱导的免疫力水平因不同因素而异,如卡介苗活力、卡介苗株毒力、宿主应答性、接种途径及其他病原体的多重感染等[6]。不像其他减毒活疫苗(如牛痘、麻疹疫苗等)可以诱导终生免疫,一般情况下卡介苗免疫保护期只有10~15年[3]。卡介苗不能诱导终生免疫的原因很多,目前比较受大家认可的假设是,其在去除毒力基因或者传代减毒的同时,也会丢失一些比较重要的保护性抗原和刺激免疫系统密切相关的基因,因此不能诱导终生免疫[3]。
2.免疫效果与持久性:机体对抗结核分枝杆菌主要是以T细胞为主的细胞免疫,而卡介苗的防护作用主要是通过诱导细胞介导的免疫反应来完成,机体接种卡介苗后会形成初次感染,再经过巨噬细胞加工处理,将机体内的抗原信息传递给免疫活性细胞,导致T细胞分化增殖,从而形成致敏淋巴细胞,当机体再次感染结核分枝杆菌时,巨噬细胞和致敏淋巴细胞则会被激活,引起特异性免疫反应[7-9]。
卡介苗虽不能防止结核分枝杆菌的原发感染,但有效的菌苗可以改变人体的防御机制,机体在接种4~8周后会产生免疫力,即使在感染结核分枝杆菌的情况下,也能阻止其繁殖和播散,从而减少体内结核分枝杆菌的数量以达到预防目的。这种特异性免疫的持久性,主要依赖于结核分枝杆菌在体内的存活,随着体内结核分枝杆菌的消亡,机体获得的特异性免疫也会随着记忆性T淋巴细胞数量的减少及功能衰退而逐渐降低直至消失[10]。新生儿接种卡介苗后,平均保护率为85%[11],对成年人的免疫保护力在0%~80%之间[5]。
二、卡介苗接种1.婴幼儿或儿童接种卡介苗:卡介苗被WHO纳入扩大免疫规划以后,目前全球的免疫覆盖率>84%[12]。1933年,卡介苗被引入中国后,到1954年共接种300多万人次[13]。目前,中国实施新生儿出生即接种卡介苗,未接种并在3月龄内的婴儿可直接补种,对年龄>3月龄和<3岁的结核菌纯蛋白衍生物(purified protein derivative,PPD)皮试结果阴性且未接种者予以补种,>4岁和已接种而无卡痕形成的儿童不予补种[14]。现在每年仍有1亿多新生儿接种卡介苗,已成为全球接种最广泛的疫苗之一[5]。
Usher等[15]在爱尔兰的研究结果显示,实施普遍接种和选择性接种卡介苗的结核病发病例数分别为29.6和67.6,而未接种卡介苗的结核病发病例数为76.4,说明接种卡介苗可减少结核病的发生。Nguipdop-Djomo等[16]研究结果显示,经过40余年随访,接种卡介苗者的结核病发病率为1.3/10万人年,未接种卡介苗的结核病发生率为3.3/10万人年,调整后的疫苗平均保护率为49%。这些研究也在一定程度上证明了婴幼儿或者儿童接种卡介苗以后,可以有效的预防和减少结核病的发生。
全面的婴幼儿卡介苗接种取得显著成效,但其保护效果会随着接种时间的延长而逐步下降,并不能对青少年和成年人产生保护效果,而后者是结核病的主要易感人群[17-18]。因此,如何有效降低青少年和成年人中结核病的流行是结核病防治工作的关键。
2.青少年或成年人的卡介苗接种:目前,国内外对于青少年或成年人接种卡介苗效果的研究较少。根据Heimbeck[19]在社区医院的研究,对部分Pirquet皮试阴性的护士学生在进入结核病房前接种卡介苗,结果显示在Pirquet皮试阳性人群中结核病发病密度为10.2/1 000人年,Pirquet皮试阴性人群的发病密度为75.4/1 000人年,接种卡介苗人群的发病密度为26.2/1 000人年,显示接种卡介苗有一定的保护作用。Rosenthal等[20]研究表明,在库克地区医院的护士学生中接种卡介苗的结核病发病密度为8.7/1 000人年,PPD试验阴性的人群发病密度为19.0/1 000人年,PPD试验阳性人群的发病密度为7.1/1 000人年,与对照组相比接种卡介苗的学生中结核病发病率较低。据Dickie[21]对威斯康辛大学医学生的研究,对PPD试验阴性的学生接种卡介苗,结果显示PPD阴性未接种卡介苗的学生结核病发病率约为13.6%,接种卡介苗的学生结核病发病率约为0.94%,说明接种卡介苗能有效降低结核病的发生。
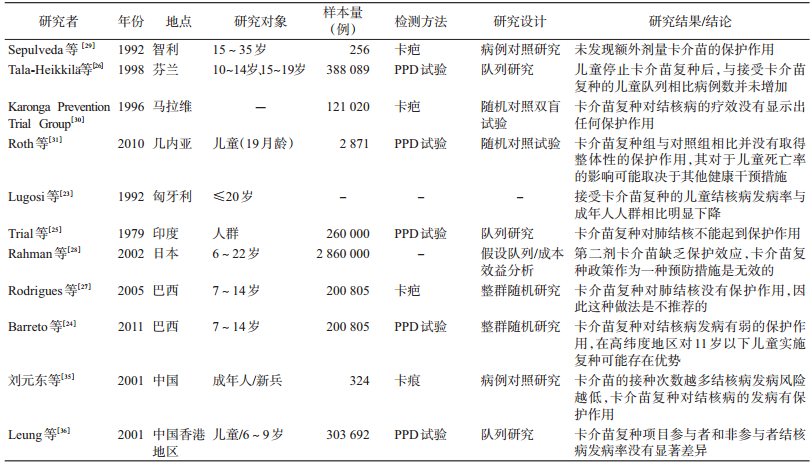
三、卡介苗复种1959年之后,匈牙利对<20岁PPD阴性人群实行卡介苗复种[22],接受卡介苗复种的儿童结核病发病率与成年人人群相比明显下降[23]。另一项在20万名学生中开展的整群随机研究发现[24],在某些亚组(不同人种、地区和年龄段)卡介苗复种对结核病的发病有弱的保护作用,在高纬度地区对于<11岁儿童实施复种可能存在一定优势,但另一些亚组则无保护作用。但印度南部开展的一项大规模卡介苗复种的前瞻性队列研究显示[25],卡介苗接种7.5年后肺结核发病例数卡介苗复种组高于安慰剂组,低、高剂量卡介苗组分别为65与58例,安慰剂组为47例;接种15年后,3组人群肺结核年平均发病率基本相同,分别为54/10万、55/10万、56/10万,结果提示卡介苗复种对肺结核不能起到保护作用。智利、芬兰、马拉维、巴西、日本等国的研究结果显示第二剂卡介苗对结核病的疗效没有保护作用[26-30]。Roth等[31]在几内亚地区针对19月龄儿童实施复种的研究结果显示,在5年随访中发现卡介苗复种组与对照组相比并没有取得如期的保护作用,卡介苗的复种对于儿童死亡率的影响可能取决于其他健康干预措施。我国从1985-1997年期间曾经开展过卡介苗复种,即卡介苗在出生时初种,对7、12岁儿童(限农村)各复种1次[32]。有研究发现,卡介苗复种人群的PPD阳性率(PPD≥5 mm)达到80%以上、PPD的中度阳性率(PPD≥10 mm)>55%,显著高于未复种人群,而该人群的结核杆菌感染率仅为6%(γ-干扰素释放试验阳性),明显低于未接种人群[33-34]。刘元东等[35]的研究发现,卡疤数与结核病发病呈负相关,即卡介苗的接种次数越多结核病发病风险越低,这也提示卡介苗复种对结核病的发病有保护作用。而在我国香港地区开展的一项评价学生卡介苗复种效果的队列研究中[36],结核病发病率复种项目参与者与未参与者中分别为16.5/10万人年和12.9 /10万人年,未发现卡介苗复种对结核病发病有保护作用(表 1)。
1995年,WHO基于印度南部的研究结果,发表了《关于卡介苗复种预防结核病声明》,认为卡介苗的复种效果无法得到证实,因此不提倡复种,而且对任何人都无需进行多次接种[37]。该声明发表后,实施卡介苗复种政策的国家陆续停止复种,中国于1997年停止卡介苗复种[38]。
之后印度南部研究指出存在明显缺陷,一是该研究在用PPD试验筛查时,以3 IU PPD<7 mm为阴性标准,与国际通行标准(5 IU PPD<5 mm为阴性)不符。由于采用低剂量和高判断标准,因此,在以3 IU PPD<7 mm为标准判断的11.5万阴性人群中,就有可能存在大量已感染结核杆菌的假阴性者;二是该研究人群中青少年及成年人结核杆菌感染率非常高,同时全人群环境分枝杆菌感染率也很高,这不符合卡介苗接种对象应为PPD阴性者的要求。因此,该研究的结果只能证明卡介苗对已感染结核分枝杆菌或环境分枝杆菌的人群无效,而缺乏对未感染人群无效的确切证据,仅凭此认为卡介苗复种对成年人无保护作用的理由不充分,因此该研究无充分证据证明卡介苗复种对未感染人群无效[39-41]。
随着结核病患者尤其是耐药性结核病患者的不断增加,基于上述研究结果WHO于2004年又发布了关于卡介苗的立场文件,其部分观点有别于1995年发布的关于卡介苗的声明[4]:建议在结核病高负担地区,婴儿出生后应尽快接种卡介苗;同时肯定了以PPD试验筛选卡介苗接种者的做法。虽不建议在成年人中接种卡介苗,但对PPD阴性而又不可避免地会密切接触耐多药结核病患者的高危人群,可考虑接种卡介苗。中国是结核病高负担国家之一,对适合接种的新生儿出生后即接种卡介苗[42]。2005年一项关于欧洲国家卡介苗接种的研究显示[43],12个国家建议对<1岁儿童普遍接种卡介苗(其中4个国家实行复种),11个国家建议对特定人群接种卡介苗,7个国家没有系统使用卡介苗。澳大利亚对高危人群接种卡介苗,不推荐用于一般人群或大多数医护人员,因其结核病发病率低也不推荐复种[44]。
目前,结核病流行的下降趋势十分缓慢、且又没有新的结核疫苗效果超过卡介苗的背景下,WHO在2018年2月又再次发表了卡介苗使用的最新立场文件,对卡介苗的态度再次发生变化[45]:建议在结核病和麻风病高负担地区,应在婴儿出生后立即接种卡介苗,出生后未接种卡介苗的婴儿应在暴露前尽快补种;结核病高负担地区出生的或即将迁入高负担地区的无卡介苗接种史的儿童、青少年和成年人,以及进入高暴露风险的无卡介苗接种史的成年职业人群(如医务人员等),若PPD或者γ-干扰素释放试验阴性,则应该开展卡介苗接种;对于卡介苗复种,由于缺乏随机对照试验、历史队列研究和病例对照研究的证据,无法评价卡介苗复种的成本效益,因此不推荐在人群中广泛开展卡介苗复种。
五、展望接种疫苗在传染病防治中是最有效的措施,目前全球已有近20种结核病新型疫苗进入Ⅰ~Ⅲ期临床试验,但均未获成功,也无保护效果超过卡介苗的疫苗出现[46-47]。虽然新生儿出生后接种了卡介苗,但其保护效果随着年龄的增加会逐步减弱。在结核病高负担国家中,由于传染源的大量存在,青少年和成年人在卡介苗接种效果逐渐消退、结核分枝杆菌暴露风险逐渐加大的情况下,结核病的发病风险也逐步加大。从上述3个WHO关于卡介苗的立场文件可以看出,WHO对卡介苗的态度随着研究证据的增加和防控形势的变化,呈现出越来越肯定的趋势,尤其是在2018年的最新立场文件中,对于无接种史的青少年和成年人的卡介苗接种给予了推荐。若想通过加强免疫预防来进一步控制结核病的流行,卡介苗仍是目前唯一可能的选择。
利益冲突 无
| [1] |
WHO. Global Tuberculosis Report 2017[EB/OL]. Geneva: World Health Organization, 2016.(2017-12-01)[2018-04-01]. http://www.who.int/tb/publications/global_report/en/.
|
| [2] |
Ritz N, Hanekom WA, Robins-Browne R, et al. Influence of BCG vaccine strain on the immune response and protection against tuberculosis[J]. FEMS Microbiol Rev, 2008, 32(5): 821-841. DOI:10.1111/j.1574-6976.2008.00118.x |
| [3] |
杨晓明, 李忠明. 提升卡介苗免疫保护力的关键技术和研发新型结核病疫苗的策略[J]. 中华微生物学和免疫学杂志, 2012, 32(9): 761-764. Yang XM, Li ZM. Key techniques to enhance the immune protective ability of BCG and strategies for developing new TB vaccines[J]. Chin J Microbiol Immunol, 2012, 32(9): 761-764. DOI:10.3760/cma.j.issn.0254-5101.2012.09.001 |
| [4] |
W HO. BCG vaccine. WHO position paper[J]. Wkly Epidemiol Rec, 2004, 79(4): 27-38. |
| [5] |
范小勇, 李忠明, 朱亚峰. 结核病疫苗研制的免疫优化策略及新疫苗研究进展[J]. 中华微生物学和免疫学杂志, 2013, 33(1): 56-65. Fan XY, Li ZM, Zhu YF. Novel vaccination strategies and progress on tuberculosis vaccine development[J]. Chin J Microbiol Immunol, 2013, 33(1): 56-65. DOI:10.3760/cma.j.issn.0254-5101.2013.01.013 |
| [6] |
王力. 卡介苗的预防接种工作常识[J]. 中国中医药现代远程教育, 2010(21): 101. Wang L. Knowledge of vaccination for BCG[J]. Chin Med Mod Distance Edu Chin, 2010(21): 101. DOI:10.3969/j.issn.1672-2779.2010.21.084 |
| [7] |
Nguipdop-Djomo P, Mangtani P, Pedrazzoli D, et al. Uptake of neonatal BCG vaccination in England:performance of the current policy recommendations[J]. Thorax, 2014, 69(1): 87-89. DOI:10.1136/thoraxjnl-2013-203931 |
| [8] |
Lule SA, Mawa PA, Nkurunungi G, et al. Factors associated with tuberculosis infection, and with anti-mycobacterial immune responses, among five year olds BCG-immunised at birth in Entebbe, Uganda[J]. Vaccine, 2015, 33(6): 796-804. DOI:10.1016/j.vaccine.2014.12.015 |
| [9] |
李丹. 卡介苗补种方法的应用与效果研究[J]. 中国现代药物应用, 2017(21): 26-28. Li D. Study on the application and effect of bacille Calmette-Guerin replantation methods[J]. Chin J Mod Drug Appl, 2017(21): 26-28. DOI:10.14164/j.cnki.cn11-5581/r.2017.21.011 |
| [10] |
卢立国, 严明月, 孙婷婷, 等. 结核患者与卡介苗接种次数相关性断面监测及思考[J]. 临床医药文献杂志, 2016, 3(28): 5526-5528. Lu LG, Yan MY, Sun TT, et al. TB patients and the number of BCG vaccine correlation section monitoring and thinking[J]. J Clin Med, 2016, 3(28): 5526-5528. |
| [11] |
Mangtani P, Abubakar I, Ariti C, et al. Protection by BCG vaccine against tuberculosis:a systematic review of randomized controlled trials[J]. Clin Infect Dis, 2014, 58(4): 470-480. DOI:10.1093/cid/cit790 |
| [12] |
Harris RC, Dodd PJ, White RG. The potential impact of BCG vaccine supply shortages on global paediatric tuberculosis mortality[J]. BMC Med, 2016, 14(1): 138. DOI:10.1186/s12916-016-0685-4 |
| [13] |
宋文虎. 新中国结核病控制的回顾与展望[J]. 中华流行病学杂志, 2000, 21(2): 156-158. Song WH. Review and prospect of tuberculosis control in new China[J]. Chin J Epidemiol, 2000, 21(2): 156-158. DOI:10.3760/j.issn:0254-6450.2000.02.023 |
| [14] |
中华人民共和国国家卫生和计划生育委员会. 国家免疫规划疫苗儿童免疫程序及说明(2016年版)[J]. 中国病毒病杂志, 2017(2): 81-86. National Health and Family Planning Commission of the People's Republic of China. Immunization schedules and instructions for vaccines of the National Immunization Program (2016 Version)[J]. Chin J Viral Dis, 2017(2): 81-86. DOI:10.16505/j.2095-0136.2017.02.001 |
| [15] |
Usher C, Adams R, Schmitz S, et al. Evaluating the neonatal BCG vaccination programme in Ireland[J]. Arch Public Health, 2016, 74: 28. DOI:10.1186/s13690-016-0141-0 |
| [16] |
Nguipdop-Djomo P, Heldal E, Rodrigues LC, et al. Duration of BCG protection against tuberculosis and change in effectiveness with time since vaccination in Norway:a retrospective population-based cohort study[J]. Lancet Infect Dis, 2016, 16(2): 219-226. DOI:10.1016/s1473-3099(15)00400-4 |
| [17] |
Abubakar I, Pimpin L, Ariti C, et al. Systematic review and meta-analysis of the current evidence on the duration of protection by bacillus Calmette-Guerin vaccination against tuberculosis[J]. Health Technol Assess, 2013, 17(37): 371-372. DOI:10.3310/hta17370 |
| [18] |
Weiner J 3rd, Kaufmann SH. Recent advances towards tuberculosis control:vaccines and biomarkers[J]. J Intern Med, 2014, 275(5): 467-480. DOI:10.1111/joim.12212 |
| [19] |
Heimbeck J. Tuberculosis in hospital nurses[J]. Tubercle, 1936, 18(3): 97-99. DOI:10.1016/S0041-3879(36)80249-9 |
| [20] |
Rosenthal SR, Afremow ML, Nikurs L, et al. BCG vaccination and tuberculosis in students of nursing[J]. Am J Nurs, 1963, 63(6): 88-93. DOI:10.2307/3452499 |
| [21] |
Dickie HA. Tuberculosis in student nurses and medical students at the University of Wisconsin[J]. Ann Intern Med, 1950, 33(4): 941-959. DOI:10.7326/0003-4819-33-4-941 |
| [22] |
Barreto ML, Pereira SM, Ferreira AA. BCG vaccine:efficacy and indications for vaccination and revaccination[J]. J Pediatr (Rio J), 2006, 82(3 Suppl): S45-54. DOI:10.2223/jped.1499 |
| [23] |
Lugosi L. Theoretical and methodological aspects of BCG vaccine from the discovery of Calmette and Guérin to molecular biology. A review[J]. Tuber Lung Dis, 1992, 73(5): 252-261. DOI:10.1016/0962-8479(92)90129-8 |
| [24] |
Barreto ML, Pereira SM, Pilger D, et al. Evidence of an effect of BCG revaccination on incidence of tuberculosis in school-aged children in Brazil:second report of the BCG-REVAC cluster-randomised trial[J]. Vaccine, 2011, 29(31): 4875-4877. DOI:10.1016/j.vaccine.2011.05.023 |
| [25] |
Trial TP. Trial of BCG vaccines in south India for tuberculosis prevention:first report-Tuberculosis Prevention Trial[J]. Bull World Health Organ, 1979, 57(5): 819-827. |
| [26] |
Tala-Heikkilä MM, Tuominen JE, Tala EOJ. Bacillus Calmette-Guérin revaccination questionable with low tuberculosis incidence[J]. Am J Resp Crit Care Med, 1998, 157(4): 1324-1327. DOI:10.1164/ajrccm.157.4.9706037 |
| [27] |
Rodrigues LC, Pereira SM, Cunha SS, et al. Effect of BCG revaccination on incidence of tuberculosis in school-aged children in Brazil:the BCG-REVAC cluster-randomised trial[J]. Lancet, 2005, 366(9493): 1290-1295. DOI:10.1016/S0140-6736(05)67145-0 |
| [28] |
Rahman M, Sekimoto M, Hira K, et al. Is Bacillus Calmette-Guerin revaccination necessary for Japanese children[J]. Prev Med, 2002, 35(1): 70-77. DOI:10.1006/pmed.2002.1043 |
| [29] |
Sepulveda RL, Parcha C, Sorensen RU. Case-control study of the efficacy of BCG immunization against pulmonary tuberculosis in young adults in Santiago, Chile[J]. Tuber Lung Dis, 1992, 73(6): 372-377. DOI:10.1016/0962-8479(92)90043-j |
| [30] |
Karonga Prevention Trial Group. Randomised controlled trial of single BCG, repeated BCG, or combined BCG and killed Mycobacterium leprae vaccine for prevention of leprosy and tuberculosis in Malawi[J]. Lancet, 1996, 348(9019): 17-24. DOI:10.1016/S0140-6736(96)02166-6 |
| [31] |
Roth AE, Benn CS, Ravn H, et al. Effect of revaccination with BCG in early childhood on mortality:randomised trial in Guinea-Bissau[J]. BMJ, 2010, 340: c671. DOI:10.1136/bmj.c671 |
| [32] |
成君, 何广学, 成诗明, 等. 中国结核病防治技术策略实施现状及建议[J]. 中国防痨杂志, 2013, 35(10): 835-839. Cheng J, He GX, Cheng SM, et al. Implementation status and suggestions on technical strategy of tuberculosis control and prevention in China[J]. Chin J Antituberc, 2013, 35(10): 835-839. |
| [33] |
Gao L, Lu W, Bai LQ, et al. Latent tuberculosis infection in rural China:baseline results of a population-based, multicentre, prospective cohort study[J]. Lancet Infect Dis, 2015, 15(3): 310-319. DOI:10.1016/S1473-3099(14)71085-0 |
| [34] |
Chen C, Zhu T, Wang ZJ, et al. High latent TB infection rate and associated risk factors in the Eastern China of low TB incidence[J]. PLoS One, 2015, 10(10): e0141511. DOI:10.1371/journal.pone.0141511 |
| [35] |
刘元东, 靳晓红, 李子建, 等. 军队停止卡介苗接种策略的综合性评价[J]. 预防医学文献信息, 2001, 7(4): 361-363. Liu YD, Jin XH, Li ZJ, et al. The evaluation of stopping BCG vaccination strategy in army[J]. Liter Inform Prev Med, 2001, 7(4): 361-363. DOI:10.3969/j.issn.1672-9153.2001.04.003 |
| [36] |
Leung CC, Tam CM, Chan SL, et al. Efficacy of the BCG revaccination programme in a cohort given BCG vaccination at birth in Hong Kong[J]. Int J Tuberc Lung Dis, 2001, 5(8): 717-723. |
| [37] |
WHO. Global tuberculosis programme and global programme on vaccines. Statement on BCG revaccination for the prevention of tuberculosis[J]. Wkly Epidemiol Rec, 1995, 70(32): 229-231. |
| [38] |
刘瑛, 陈兰英, 吴兆龙. 1998-2000年南京市卡介苗补种情况分析[J]. 江苏预防医学, 2001(4): 35-36. Liu Y, Chen LY, Wu ZL. Analysis on the replant of BCG vaccination in Nanjing in 1998-2000[J]. Jiangsu J Prevent Med, 2001(4): 35-36. DOI:10.3969/j.issn.1006-9070.2001.04.021 |
| [39] |
Narayanan PR. Influence of sex, age & nontuberculous infection at intake on the efficacy of BCG:re-analysis of 15-year data from a double-blind randomized control trial in South India[J]. Indian J Med Res, 2006, 123(2): 119-124. |
| [40] |
John TJ. Tuberculosis control in India:why are we failing[J]. Indian Pediatr, 2014, 51(7): 523-527. DOI:10.1007/s13312-014-0440-x |
| [41] |
赵爱华, 卢锦标, 王国治. 我国结核病新疫苗研究策略的探讨[J]. 中华微生物学和免疫学杂志, 2013, 33(12): 885-892. Zhao AH, Lu JB, Wang GZ. Study on the strategy of new tuberculosis vaccine in China[J]. Chin J Microbiol Immunol, 2013, 33(12): 885-892. DOI:10.3760/cma.j.issn.0254-5101.2013.12.001 |
| [42] |
彭晓雯, 刘大卫. 卡介苗预防接种安全性综述[J]. 中国疫苗和免疫, 2010, 16(6): 558-563. Peng XW, Liu DW. Review on the safety of Bacille Calmette-Guérin vaccination[J]. Chin J Vaccin Immuni, 2010, 16(6): 558-563. |
| [43] |
Infuso A, Falzon D, Euro-TB network. European survey of BCG vaccination policies and surveillance in children, 2005[J]. Euro Surveill, 2006, 11(3): 6-11. DOI:10.2807/esm.11.03.00604-en |
| [44] |
Tuberculosis Prevention. The BCG vaccine:Information and recommendations for use in Australia. National Tuberculosis Advisory Committee update October 2012[J]. Commun Dis Intell Q Rep, 2013, 37(1): E65-72. |
| [45] |
BCG vaccines: WHO position paper-February 2018[J]. Wkly Epidemiol Rec, 2018, 93(8): 73-96.
|
| [46] |
Nunn AJ, Rusen ID, van Deun A, et al. Evaluation of a standardized treatment regimen of anti-tuberculosis drugs for patients with multi-drug-resistant tuberculosis (STREAM):study protocol for a randomized controlled trial[J]. Trials, 2014, 15(1): 353. DOI:10.1186/1745-6215-15-353 |
| [47] |
卢水华. 必须高度重视结核病疫苗临床试验研究[J]. 结核病与肺部健康杂志, 2017, 6(1): 1-2. Lu SH. The clinical trial of tuberculosis vaccine should be highly emphasized[J]. J Tuberc Lung Health, 2017, 6(1): 1-2. DOI:10.3969/j.issn.2095-3755.2017.01.001 |
 2018, Vol. 39
2018, Vol. 39