文章信息
- 王科儒, 彭丽萍, 顾菁, 郝春, 邹华春, 郝元涛, 李菁华.
- Wang Keru, Peng Liping, Gu Jing, Hao Chun, Zou Huachun, Hao Yuantao, Li Jinghua.
- 应用传染病动力学模型预测“三个90%”目标与暴露前预防用药对我国男男性行为人群消除艾滋病的影响
- Impact of the 90-90-90 goal and pre-exposure prophylaxis on HIV transmission and elimination in men who have sex with men in China: A mathematical modeling study
- 中华流行病学杂志, 2018, 39(11): 1507-1514
- Chinese Journal of Epidemiology, 2018, 39(11): 1507-1514
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2018.11.017
-
文章历史
收稿日期: 2018-04-25
2. 510080 广州, 中山大学全球卫生研究中心;
3. 518000 深圳, 中山大学公共卫生学院
2. Sun Yat-Sen Global Health Institute, Guangzhou 510080, China;
3. School of Public Health, Sun Yat-Sen University, Shenzhen 518000, China
自1985年我国发现首例艾滋病患者以来,HIV感染人数迅速上升,据中国CDC统计,截止2017年底,全国新发现HIV感染者/AIDS患者(HIV/AIDS)134 512例,现存活HIV/AIDS 758 610例[1]。MSM是我国感染HIV的高危人群,新发现报告感染的比例从2006年的2.5%增至2015年的28.3%,总体感染率也从2012年的6.7%增至2015年的8.0%[2]。虽然我国实施了安全套推广、针具交换项目、艾滋病自愿咨询与检测等多项行为干预及生物医学干预措施,但是MSM的HIV新发感染率依然居高不下。为了控制艾滋病流行,联合国艾滋病规划署(UNAIDS)于2014年提出了“三个90%”目标(至2020年,90%的感染者被检测发现、90%发现的感染者获得抗病毒治疗、90%接受治疗者达到病毒抑制)。截至2015年底,我国“三个90%”目标分别达到了67%、68%、91%[3]。暴露前预防用药(pre-exposure prophylaxis,PrEP)是当今重要的HIV预防新措施,这是指未感染HIV的高风险MSM人群在发生暴露前,通过服用抗反转录病毒药物来减低发生感染的风险。PrEP的安全性和作用在国外研究中得到了证明[4-6],应用到我国高风险MSM时可能产生的效果仍需要进一步的研究。研究中构建了HIV传播的传染病动力学模型,应用模型预测不同措施下的HIV发病情况,并探讨“三个90%”目标与PrEP的组合措施对我国MSM人群艾滋病流行情况的影响,同时分析为达到消除艾滋病所需要采取的干预措施。
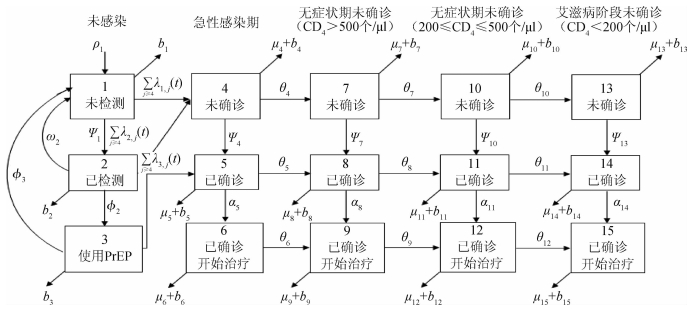
资料与方法1.模型构建:HIV仓室模型将中国15~64岁的MSM人群根据风险水平划分为2个亚组人群:高风险MSM和低风险MSM。本研究高风险MSM人群的年平均同性性伴数为15个[7];低风险MSM人群的年平均同性性伴数为2.6个。每个亚组人群根据HIV感染及治疗干预状态,分为15个状态:①未感染未检测;②未感染已检测;③未感染并使用PrEP;④急性感染期未确诊;⑤急性感染期已确诊;⑥急性感染期并已开始治疗;⑦无症状期未确诊,即CD4+T淋巴细胞计数(CD4)>500个/μl;⑧无症状期已确诊(CD4>500个/μl);⑨无症状期已开始治疗(CD4>500个/μl);⑩无症状期未确诊(200个/μl≤CD4≤500个/μl);无症状期已确诊(200个/μl≤CD4≤500个/μl);无症状期并已开始治疗(200个/μl≤CD4≤500个/μl);艾滋病阶段未确诊(CD4<200个/μl);艾滋病阶段已确诊(CD4<200个/μl);艾滋病阶段并已开始治疗(CD4<200个/μl)。见图 1。
|
| 图 1 HIV仓室模型基本结构示意图及基本参数 |
模型将模拟HIV/AIDS的传播及疾病进展动态过程,每种状态之间的转化通过微分方程进行描述。HIV仓室模型由30个微分方程构成,分别表示两个亚组人群HIV感染疾病进展过程的15个状态(公式1~15)。HIV仓室模型结构符号、参数含义及收集计算方法见表 1。
 (1)
(1)
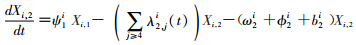 (2)
(2)
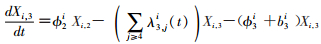 (3)
(3)
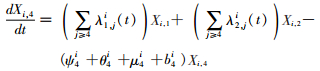 (4)
(4)
 (5)
(5)
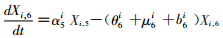 (6)
(6)
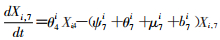 (7)
(7)
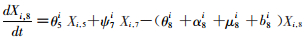 (8)
(8)
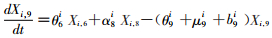 (9)
(9)
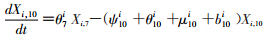 (10)
(10)
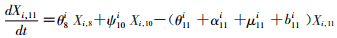 (11)
(11)
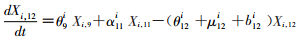 (12)
(12)
 (13)
(13)
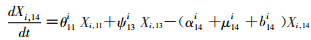 (14)
(14)
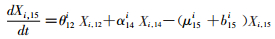 (15)
(15)
λi,j(t)表示感染HIV的概率,即从未感染的状态进展到急性感染期的概率。未感染的低风险MSM人群(未使用/使用PrEP)感染HIV的概率分别见公式16、17所示。其中,n1表示低风险MSM年均同性性伴数。η1,1表示低风险MSM与低风险MSM发生性行为的比例,η1,2表示低风险MSM与高风险MSM发生性行为的比例,由低风险MSM与高风险MSM处于各状态的人数、低风险MSM与高风险MSM年均同性性伴数、被诊断为感染者后性行为减少率、艾滋病阶段性行为减少率间接计算获得。u1表示低风险MSM同性性行为中安全套使用率;κ表示安全套预防HIV感染的有效率。N_LRMSMj(j=4~15)表示未感染并且未使用PrEP的MSM不被HIV阳性的低风险MSM感染的概率,由低风险MSM处于状态4~15的人数、低风险MSM年均同性性伴数、低风险MSM总同性性行为数、不同疾病阶段的感染者每次经同性性行为传播HIV的概率、被诊断为感染者后性行为减少率、艾滋病阶段性行为减少率、因接受ART治疗减弱HIV经性行为传播的效力通过间接计算获得(N_HRMSMj同理)。N_prepLRMSMj(j=4~15)表示未感染并且使用PrEP的MSM人群不被HIV阳性的低风险MSM感染的概率,在N_LRMSMj的基础上,加入考虑PrEP的有效率间接计算获得(N_prepHRMSMj同理)。未感染的高风险MSM人群(未使用/使用PrEP)感染HIV概率的计算同理可得。
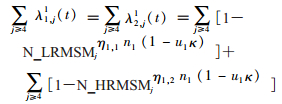 (16)
(16)
 (17)
(17)
2.模型假设:①模型中MSM人群感染HIV只通过同性性行为,不考虑异性性行为或其他途径。②模型的基线情况假设中国艾滋病治疗指南在未来20年保持不变,HIV检测率与HIV治疗率均维持现在的水平。③PrEP的有效率假设为90%;因接受抗病毒治疗减弱HIV经性行为传播的效力假设为90%;艾滋病阶段的性行为减少率假设为90%。
3.模型参数的收集与初始值的确定:本研究所需参数的数据主要通过系统综述和文献查阅的方法直接或间接计算获得[2, 8-10]。模型的初始值是2005年各状态的人数。通过查阅文献可得,我国MSM总人数约为5 000 000人[2],2005年我国15~64岁男性占总男性人口比例为70.46%,计算出我国15~64岁MSM人群约为3 625 000人。模型主要参数及变量的具体数值,见表 2。
4.模型的考核与校正:将根据文献综述获得过去10年的人群HIV感染率作为模型校准依据。首先通过模型敏感度分析确定对模型的输出结果的变化贡献较大的主要参数。然后利用拉丁超立方抽样(改进的蒙特卡罗方法)在主要参数的波动范围内进行1 000次抽样,代入模型进行计算;将1 000组模型的输出结果与校正依据进行拟合,选取输出结果与校准的拟合优度最佳的模型为最优模型,选取拟合优度最佳的前400组模型结果作为本研究的敏感区间。
5.模型的应用:将应用模型评价不同干预模式的流行病学防治效果以及对于消除艾滋病的影响。模型输出指标:①每年HIV感染率及发病率;②每年新感染的HIV人数;③累积发病人数(累积发病率);④累积避免新发感染的人数。
本研究的干预模式包括:
(1) 基线对照组。所有的干预参数(如检测、治疗等参数)将设定为目前中国实际的比例数值。
(2) 扩大HIV检测与治疗。我国的HIV检测率仍然较低,而且检测率较高的部分发达国家(如澳大利亚、英国、美国)的HIV检测率目前也未能达到90%,因此本研究针对不同的HIV检测率设定的分策略如下(抗病毒治疗率均逐步覆盖到90%已发现的感染者):①90%MSM人群每年检测1次;②80%MSM人群每年检测1次;③70%MSM人群每年检测1次。
(3) PrEP分策略:①覆盖20%高风险MSM人群;②覆盖50%高风险MSM人群;③覆盖80%高风险MSM人群。
(4) 组合干预模式。上述两种干预策略的两两组合。
结果模型基于不同的HIV检测率、治疗率和PrEP覆盖率,预测了13种干预措施及组合模式的HIV感染流行情况。模型进行1 000次随机模拟后取平均值,模型拟合结果通过拟合优度检验与实际监测数据差异无统计学意义,预测结果较为准确。
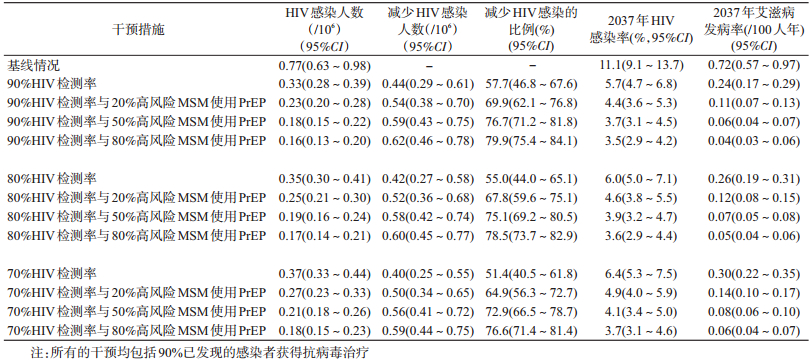
1.基线情况:在现有政策和措施下,MSM人群HIV感染率呈现上升趋势,2030年达到峰值,随后平缓下降(图 2)。未来20年的新发感染MSM人数累计达到77万。到2037年该人群的HIV感染率将达到11.1%,发病率达到0.72/100人年,见表 3。
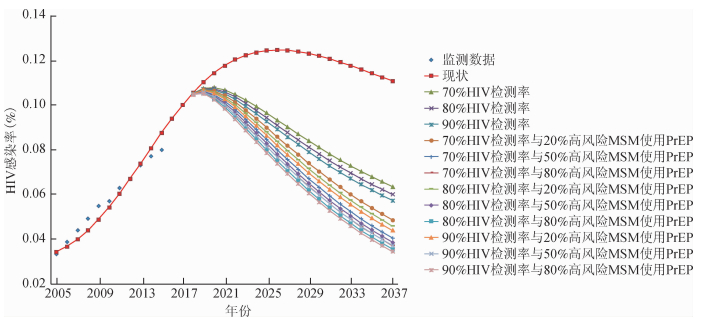
|
| 注:所有的干预均包括90%已发现的感染者获得抗病毒治疗 图 2 不同干预措施下MSM人群的HIV流行趋势 |
2.采用扩大HIV检测与治疗措施:采用扩大检测与治疗措施后,若实现UNAIDS的“三个90%”目标,艾滋病的感染率和发病率将明显下降,2018-2037年将减少57.7%的新发感染,到2037年该人群的HIV感染率下降至5.7%,HIV发病率下降到0.24/100人年,但仍然远高于消除艾滋病的目标。
当HIV年检测率无法达到90%,在“三个90%”目标分别达到“70-90-90”以及“80-90-90”条件下依然能使感染率明显下降。在达到70%的检测率下,未来20年HIV新发感染人数将减少51.4%,2037年HIV感染率下降至6.4%,发病率下降至0.30/100人年。在80%检测率时,未来20年HIV的新发感染总人数将减少55.0%,2037年HIV感染率为6.0%,发病率为0.26/100人年。
3.扩大HIV检测治疗与PrEP的组合效果:在PrEP依从性为90%的前提下,预测扩大HIV检测治疗与PrEP组合的效果,结果见表 3。以90-90和PrEP组合措施为例,高风险MSM人群的PrEP覆盖率越高,发病率越低。覆盖率为20%、50%、80%时,发病率分别为0.11/100人年、0.06/100人年、0.04/100人年。消除艾滋病的标准定义为艾滋病发病率低于0.1/100人年[23],PrEP覆盖50%高风险MSM以上时,可在2037年达到消除艾滋病的目标,见表 3。
4.PrEP措施对消除艾滋病的效果:预测了我国未来10、15和20年在MSM人群中实现消除艾滋病的目标所需要的PrEP的覆盖率和依从性(图 3)。研究发现,HIV检测率越低或越短的时间内实现消除目标则需要在高风险MSM人群中达到更高的PrEP覆盖率和依从性。例如在实现“三个90%”目标的策略下,当PrEP依从性为100%时,10、15和20年内达到消除艾滋病分别需要PrEP覆盖65%、32%、19%高风险MSM。

|
| 图 3 不同年限和策略下为达到消除艾滋病所要求的暴露前预防性用药覆盖率及依从性 |
本研究根据SIR传染病动力学理论,针对我国艾滋病目前的疫情特征对人群及疾病状态进行划分,结合新的干预模式构建了我国MSM人群HIV动力学模型,对经典传染病动力学模型进行改进和完善。用此模型预测中国2018-2037年MSM人群的HIV流行趋势,并探讨UNAIDS “三个90%”目标和PrEP两项干预措施对艾滋病流行的消除效果。本研究发现,在当前政策下,我国的MSM人群的发病率将逐年上升,与吴静[24]的研究一致。在“三个90%”目标策略下,MSM人群的发病率将减少近60%,但不足以达到20年内MSM人群消除艾滋病的目标。为了进一步控制及消除艾滋病,需要如PrEP新的干预手段介入。
提高HIV的检测率是实现UNAIDS的“三个90%”目标的第一步,我国实现这个目标依然面临许多挑战。目前,我国MSM人群的检测率仅为47%。来自社会和医护人员对MSM的歧视,是HIV检测的主要阻碍因素。WHO综合了多项随机对照试验的结果,证实HIV自我检测可以显著提高HIV检测率和检测频率,并于2016年发布了HIV自我检测的指南。自我检测措施有可能将提高我国MSM人群HIV检测率。此外,HIV检测还面临其他的阻碍因素,例如不方便的检测时间和地点及成本。为进一步调高我国MSM人群HIV检测率,需要实施综合的干预策略来减少阻碍。
本研究利用模型研究UNAIDS的“三个90%”目标策略对未来HIV流行的影响及消除艾滋病的研究之一。本研究表明,在不同程度的扩大HIV检测与治疗的策略下(“三个90%”、80-90-90及70-90-90策略),未来20年内,MSM人群新发HIV感染人数将减少51%~57%。即使我国在2020年前实现UNAIDS “三个90%”的目标,到2037年中国仍无法实现MSM人群消除艾滋病的目标,与Scott等[25]发现在澳大利亚达到“三个90%”目标后无法实现消除艾滋病的研究结果一致。为消除HIV在MSM人群的传播,需要新的干预措施或者采取有效的行为干预措施。
在社会、文化和同伴压力等多因素下,中国MSM人群在过去6个月坚持使用安全套的比例不足50%[26]。另外,多个国家和地区在不同的风险人群的监测数据显示,安全套使用率在过去20年相对稳定或增长缓慢[26]。PrEP作为新的生物医学干预措施,为进一步控制HIV的传播带来了新的方向。WHO的指南目前建议对HIV感染的高风险人群使用PrEP。在了解PrEP的安全性和效果后,我国MSM人群对PrEP的使用意愿普遍较高[27]。该模型显示,中国PrEP覆盖率的提高可以使发病率降低,并且表明高风险人群扩大PrEP覆盖率将成为消除艾滋病流行的重要措施,这个结果与其他国家的模型研究一致[28]。另外,本研究模型预测了在不同的策略下的消除艾滋病曲线,能为政策制定者提供一定的科学依据,可以根据所需达到的目标来调整PrEP覆盖率和依从性。
本研究存在不足。首先,模型未考虑MSM人群经异性性行为传播的途径。我国HIV在一般女性人群的感染率低,MSM人群通过异性性行为获得HIV的风险极小。其次,本研究主要探索了向高风险MSM(即年同性性伴数>15个的MSM人群)提供PrEP的效果。主要考虑到我国MSM人群整体对PrEP的知晓率不高,从高风险MSM人群开始实施可行度及可接受度更高。第三,本研究没有考虑PrEP实施后可能存在的风险补偿行为对干预措施效果的影响。最后,本研究没有探索PrEP对HIV以外其他性传播疾病发病率的影响。
综上,本研究模型适用于预测我国MSM人群HIV流行情况并能评估干预措施的效果,目前我国MSM人群的HIV疫情正处上升趋势,需要采取综合干预措施,采用扩大检测治疗和PrEP组合措施能够有效降低HIV的发病率。HIV的预防与控制,需要结合实际情况合理分配资源,重点提高MSM人群的HIV检测率以及做好PrEP在高风险人群的推广工作。
利益冲突 无
| [1] |
中国疾病预防控制中心, 性病艾滋病预防控制中心, 性病控制中心. 2017年12月全国艾滋病性病疫情[J]. 中国艾滋病性病, 2018, 24(2): 111. National Center for AIDS/STD Control and Prevention, National Center for STD Control, Chinese Center for Disease Control and Prevention. Update on the AIDS/STD epidemic in China in December 2017[J]. Chin J AIDS STD, 2018, 24(2): 111. DOI:10.13419/j.cnki.aids.2018.02.01 |
| [2] |
Tang SY, Tang WM, Meyers K, et al. HIV epidemiology and responses among men who have sex with men and transgender individuals in China:a scoping review[J]. BMC Infect Dis, 2016, 16(1): 588. DOI:10.1186/s12879-016-1904-5 |
| [3] |
吴尊友. 我国实现艾滋病防治策略三个90%的进展与挑战[J]. 中华疾病控制杂志, 2016, 20(12): 1187-1189. Wu ZY. The progress and challenges of promoting HIV/AIDS 90-90-90 strategies in China[J]. Chin J Dis Control Prev, 2016, 20(12): 1187-1189. DOI:10.16462/j.cnki.zhjbkz.2016.12.001 |
| [4] |
Grant RM, Lama JR, Anderson PL, et al. Preexposure chemoprophylaxis for HIV prevention in men who have sex with men[J]. N Engl J Med, 2010, 363(27): 2587-2599. DOI:10.1056/NEJMoa1011205 |
| [5] |
Baeten JM, Donnell D, Ndase P, et al. Antiretroviral prophylaxis for HIV prevention in heterosexual men and women[J]. N Engl J Med, 2012, 367(5): 399-410. DOI:10.1056/NEJMoa1108524 |
| [6] |
Choopanya K, Martin M, Suntharasamai P, et al. Antiretroviral prophylaxis for HIV infection in injecting drug users in Bangkok, Thailand (the Bangkok Tenofovir Study):a randomised, double-blind, placebo-controlled phase 3 trial[J]. Lancet, 2013, 381(9883): 2083-2090. DOI:10.1016/S0140-6736(13)61127-7 |
| [7] |
Zhang L, Chow EPF, Wilson DP. Men who have sex with men in China have relatively low numbers of sexual partners[J]. Infect Dis Rep, 2011, 3(1): e10. DOI:10.4081/idr.2011.e10 |
| [8] |
Tang HL, Mao YR, Shi CX, et al. Baseline CD4 cell counts of newly diagnosed HIV cases in China:2006-2012[J]. PLoS One, 2014, 9(6): e96098. DOI:10.1371/journal.pone.0096098 |
| [9] |
Zhang L, Chow EPF, Jing J, et al. HIV prevalence in China:integration of surveillance data and a systematic review[J]. Lancet Infect Dis, 2013, 13(11): 955-963. DOI:10.1016/s1473-3099(13)70245-7 |
| [10] |
Ministry of Health of the People's Republic of China. China 2010 UNGASS Country Progress Report (2008-2009)[R]. Beijing: Ministry of Health of the People's Republic of China, 2010.
|
| [11] |
国家统计局. 中国统计年鉴[M]. 北京: 中国统计出版社, 2017. National Bureau of Statistics. China Statistical Yearbook[M]. Beijing: China Statistics Press, 2017. |
| [12] |
Palella FJ, Deloria-Knoll M, Chmiel JS, et al. Survival benefit of initiating antiretroviral therapy in HIV-infected persons in different CD4+ cell strata[J]. Ann Intern Med, 2003, 138(8): 620-626. DOI:10.7326/0003-4819-138-8-200304150-00007 |
| [13] |
Dunn D, Woodburn P, Duong T, et al. Current CD4 cell count and the short-term risk of AIDS and death before the availability of effective antiretroviral therapy in HIV-infected children and adults[J]. J Infect Dis, 2008, 197(3): 398-404. DOI:10.1086/524686 |
| [14] |
Zhang FJ, Dou ZH, Ma Y, et al. Five-year outcomes of the China National Free Antiretroviral Treatment Program[J]. Ann Intern Med, 2009, 151(4): 241-251. DOI:10.7326/0003-4819-151-4-200908180-00006 |
| [15] |
Lu F, Wang N, Wu Z, et al. Estimating the number of people at risk for and living with HIV in China in 2005:methods and results[J]. Sex Transm Infect, 2006, 82(Suppl 3): iii87-91. DOI:10.1136/sti.2006.020404 |
| [16] |
Caceres CF, van Griensven GJP. Male homosexual transmission of HIV-1[J]. AIDS, 1994, 8(8): 1051-1061. DOI:10.1097/00002030-199408000-00004 |
| [17] |
张北川, 李秀芳, 史同新, 等. 2001年1109例男男性接触者性病艾滋病高危行为监测与调查[J]. 中华皮肤科杂志, 2002, 35(3): 214-216. Zhang BC, Li XF, Shi TX, et al. Survey on the high risk behaviors and other AIDS/STI related factors among men who have sex with men (MSM) in Mainland China (2001)[J]. Chin J Dermatol, 2002, 35(3): 214-216. DOI:10.3760/j.issn:0412-4030.2002.03.014 |
| [18] |
Cayley WE J. Effectiveness of condoms in reducing heterosexual transmission of HIV[J]. Am Fam Physician, 2004, 70(7): 1268-1269. |
| [19] |
Sanders GD, Bayoumi AM, Sundaram V, et al. Cost-effectiveness of screening for HIV in the era of highly active antiretroviral therapy[J]. N Engl J Med, 2005, 352(6): 570-585. DOI:10.1056/NEJMsa042657 |
| [20] |
Kamb ML, Fishbein M, Douglas JM, et al. Efficacy of risk-reduction counseling to prevent human immunodeficiency virus and sexually transmitted diseases:a randomized controlled trial[J]. JAMA, 1998, 280(13): 1161-1167. DOI:10.1001/jama.280.13.1161 |
| [21] |
Castilla J, Del Romero J, Hernando V, et al. Effectiveness of highly active antiretroviral therapy in reducing heterosexual transmission of HIV[J]. J Acquir Immune Defic Syndr, 2005, 40(1): 96-101. DOI:10.1097/01.qai.0000157389.78374.45 |
| [22] |
Lodi S, Phillips A, Touloumi G, et al. Time from human immunodeficiency virus seroconversion to reaching CD4+ cell count thresholds < 200, < 350, and < 500 Cells/mm3:assessment of need following changes in treatment guidelines[J]. Clin Infect Dis, 2011, 53(8): 817-825. DOI:10.1093/cid/cir494 |
| [23] |
Granich RM, Gilks CF, Dye C, et al. Universal voluntary HIV testing with immediate antiretroviral therapy as a strategy for elimination of HIV transmission:a mathematical model[J]. Lancet, 2009, 373(9657): 48-57. DOI:10.1016/s0140-6736(08)61697-9 |
| [24] |
吴静.构建动力学模型评价中国艾滋病防治效果[D].北京: 中国疾病预防控制中心, 2014. Wu J. Projecting the effects of HIV/AIDS prevention and intervention strategies in China using a dynamic model[D]. Beijing: Chinese Center for Disease Control and Prevention, 2014. |
| [25] |
Scott N, Stoové M, Kelly SL, et al. Achieving 90-90-90 human immunodeficiency virus (HIV) targets will not be enough to achieve the HIV incidence reduction target in Australia[J]. Clin Infect Dis, 2018, 66(7): 1019-1023. DOI:10.1093/cid/cix939 |
| [26] |
黄勤, 李巧巧, 李苑, 等. 2010-2013年中国男男性行为人群艾滋病/梅毒感染状况、性行为特征及艾滋病知识知晓情况的Meta分析[J]. 中华流行病学杂志, 2015, 36(11): 1297-1304. Huang Q, Li QQ, Li Y, et al. Prevalence of HIV infection and syphilis, sexual behaviors and awareness of HIV/AIDS related knowledge among men who have sex with men in China:a Meta-analysis of data collected from 2010 to 2013[J]. Chin J Epidemiol, 2015, 36(11): 1297-1304. DOI:10.3760/cma.j.issn.0254-6450.2015.11.023 |
| [27] |
Zhang Y, Peng B, She Y, et al. Attitudes toward HIV pre-exposure prophylaxis among men who have sex with men in western China[J]. AIDS Patient Care STDS, 2013, 27(3): 137-141. DOI:10.1089/apc.2012.0412 |
| [28] |
Nichols BE, Boucher CAB, Van Der Valk M, et al. Cost-effectiveness analysis of pre-exposure prophylaxis for HIV-1 prevention in the Netherlands:a mathematical modelling study[J]. Lancet Infect Dis, 2016, 16(12): 1423-1429. DOI:10.1016/S1473-3099(16)30311-5 |
 2018, Vol. 39
2018, Vol. 39