文章信息
- 许璐, 孙一鑫, 詹思延.
- Xu Lu, Sun Yixin, Zhan Siyan.
- 线性探针技术诊断耐药肺结核准确性的Meta分析
- Diagnostic accuracy of line probe assays for drug-resistant tuberculosis: a Meta-analysis
- 中华流行病学杂志, 2018, 39(11): 1491-1495
- Chinese Journal of Epidemiology, 2018, 39(11): 1491-1495
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2018.11.014
-
文章历史
收稿日期: 2018-07-12
WHO 2017年全球肺结核报告显示,2016年约有60万的新发耐利福平结核病患者,其中49万为耐多药肺结核病(Multidrug-Resistant Tuberculosis,MDR-TB)患者,这些患者中将近半数来自中国、印度和俄罗斯[1]。传统药敏试验通常被视为耐药肺结核诊断的金标准,但该方法耗时较长。1995年de Beenhouwer等[2]提出线性探针诊断肺结核。WHO于2008年提出线性探针可用于肺结核的诊断。线性探针根据与利福平耐药相关的rpoB基因突变、与异烟肼耐药相关的katG基因和inhA启动子区域突变、与二线注射类耐药相关的rrs基因突变以及与喹诺酮耐药相关的gyrA基因突变来判定是否耐药[3]。与传统药敏试验相比,除了耗时短,线性探针技术还可以用于多种耐药菌共存情况下的检测。线性探针对涂片阳性患者的诊断准确性很高,对涂片阴性患者的诊断灵敏度较低[4-5]。研究表明德国Hain Lifescience公司MTBDRplus 1.0对涂阴患者的检测准确性较差、MTBDRplus 2.0可以较准确地诊断耐利福平和耐异烟肼肺结核[6-7]。本研究对线性探针技术诊断耐药肺结核的准确性进行Meta分析。
资料与方法1.检索策略:基于中国临床使用的肺结核分子诊断方法对肺结核和耐药肺结核诊断准确性的循证评价项目,该项目同时检索中文数据库(中国知网、万方数据知识服务平台、中国生物医学文献服务系统、维普期刊中文期刊服务平台)和英文数据库(PubMed、Embase、Cochrane Library),以肺结核、耐药肺结核和各类分子诊断技术的商品名/通用名为主题词或关键词进行检索。并将日期限定为2000年1月1日至2017年9月1日,在进行英文数据库检索时,增加关键词或主题词为“Chinese”或“China”进行限定。
2.纳入排除标准:参考《Cochrane干预措施系统评价手册》制订了原始研究的纳入排除标准。纳入标准:①比较耐药肺结核的线性探针技术与金标准诊断方法准确性(包括灵敏度和特异度)的横断面研究、队列研究和随机对照试验;②患者包括中国成年人和儿童;③其中耐药肺结核包括耐利福平、耐异烟肼、耐多药(同时耐利福平和异烟肼)、耐喹诺酮类药物、耐二线注射类药物(包括卡那霉素、卷曲霉素、丁胺卡那霉素)、广泛耐药(耐多药同时耐喹诺酮类药物或耐二线注射类药物);④耐药肺结核的金标准为传统药敏试验或耐药相关基因测序。排除标准:①不包含耐药肺结核人群的研究;②结局不是诊断方法准确性或无法获取四格表数据;③病例对照研究;④动物实验;⑤综述、指南类研究;⑥意见、评述类文献;⑦机制研究、药理研究、药物合成研究等基础研究;⑧经济学评价类文献;⑨对于重复收录的文献,保留最新的或信息最全的1篇;⑩无法获得全文的文献。
3.文献筛选、数据提取与质量评价:首先对检索到的文献进行剔重,接着通过阅读题目和摘要进行筛选,通过阅读全文对其余文献进一步筛选。最终对纳入文献进行信息提取。提取内容包括文献的基本情况(作者、发表年代、发表语言)、研究设计(研究设计类型、收集数据类型、患者纳入方式)、患者人口特征(性别、年龄、患者疾病特征、纳入人群类型、伴随疾病、患者省份)、疾病特征与基本信息(样本量、耐药类型)、金标准、待检试验(待检试验名称、生产厂家)、结局(真阳性、真阴性、假阳性、假阴性)。本研究使用QUADAS-2(Quality Assessment of Diagnostic Accuracy Studies)工具对纳入的文献进行质量评价。QUADAS-2涉及4个评价域:病例选择、待评价诊断试验、金标准、病例流程和进展情况。所有域均用于偏倚风险评估,前3个域用于临床适用性评估。文献筛选、数据提取与质量评价均先由2名研究者独立进行,最后结果由2名研究者交叉核对,出现分歧时,将通过咨询第三位研究者解决。
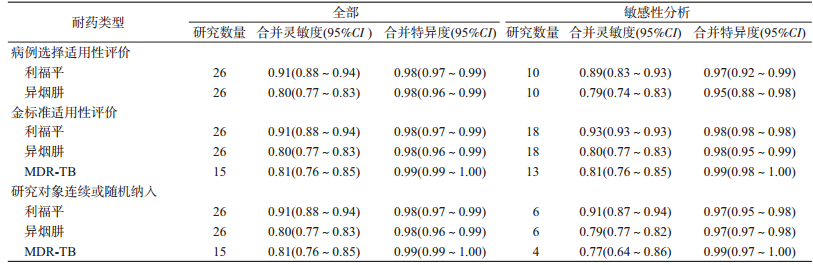
4.统计学分析:准确性分析指标为灵敏度和特异度。通过森林图和SROC(Summary Receiver Operating Characteristic)曲线图进行统计学异质性判断,通过原始研究的特征描述来判断临床异质性。Meta分析针对不同耐药类型分别进行。当原始研究数量≥4项,则采用双变量模型进行合并。当原始研究数量<4项或双变量模型无法拟合时,则采用单变量模型进行合并或仅保留原始单个研究的结果。单变量模型是在不考虑研究间存在阈值效应时,直接合并灵敏度和特异度等单个效应指标。但如果直接合并灵敏度和特异度,会存在忽略2个指标间负相关性的可能,且当研究间存在阈值效应时,如果直接合并单一指标,可能会低估诊断试验的准确性,所以可以通过拟合SROC曲线来综合评价诊断试验的准确性。而传统的SROC曲线法属于固定效应模型,忽略了研究间的变异性。双变量模型则很好地克服了这一缺点,双变量模型属于随机效应模型,并考虑了灵敏度与特异度之间的负相关性,可以得到灵敏度与特异度的综合评估值及其负相关值。针对不同产品进行了亚组分析:德国Hain Lifescience公司的GenoType MTBDRplus和GenoType MTBDRsl;中国亚能生物技术(深圳)有限公司的反向斑点杂交技术。通过仅保留根据QUADAS-2工具判断出的病例选择适用性评价为低风险的研究、仅保留根据QUADAS-2工具判断出的金标准适用性评价为低风险的研究和仅保留研究对象连续(连续纳入是指所有潜在的研究对象都在研究期间被纳入,不存在研究对象的排除或给出了合理的排除理由)或随机纳入的研究来开展3个方面的敏感性分析。所有统计学分析均利用Stata 14.0软件完成。
结果1.纳入文献情况:
(1) 基本情况:最终纳入24篇文献,其中英文6篇、中文18篇(图 1)。24篇文献共包含82项研究,样本量范围为90~1 662。纳入文献发表年份为2011-2017年,其中2016-2017年文献占54.17%。对于金标准,大部分(75项研究)采用了传统药敏试验。还有7项研究将传统药敏试验与耐药相关基因测序结合起来制定金标准。82项研究中,研究数量最多的是耐利福平肺结核、耐异烟肼肺结核和MDR-TB。

|
| 图 1 线性探针技术诊断耐药肺结核准确性Meta分析的文献纳入排除流程图 |
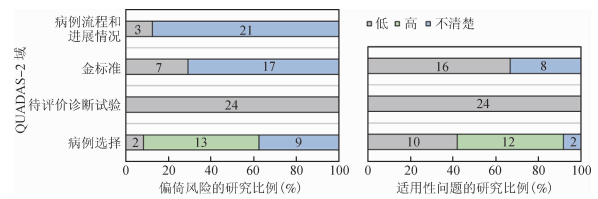
(2) 质量评价:诊断性研究质量评价(采用QUADAS-2工具得出的结果)显示,在偏倚风险方面,对于病例选择域,大部分研究为“高风险”。对于待评价诊断试验域,24篇文献均为“低风险”。对于金标准域,大多数文献为“不清楚”,部分文献为“低风险”。对于病例流程和进展情况域,大多数文献为“不清楚”,但无“高风险”文献。在适用性方面,对于病例选择域,评价为“低风险”、“高风险”的文献较多。对于待评价诊断试验域,所有文献均为“低风险”。对于金标准域,多数文献被评价为“低风险”,部分文献为“不清楚”(图 2)。
|
| 图 2 线性探针技术诊断耐药肺结核准确性Meta分析中纳入文献的质量评价 |
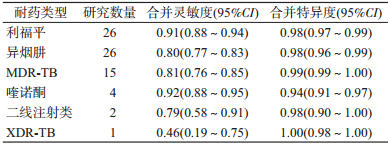
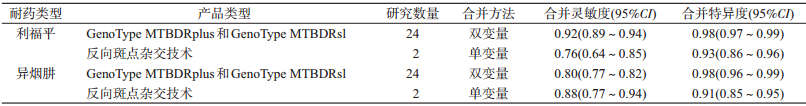
2.线性探针诊断准确性评价:使用双变量模型对耐利福平、耐异烟肼、耐多药、耐喹诺酮肺结核进行分析,使用单变量模型对耐二线注射类肺结核进行分析,广泛耐多药肺结核(Extensively Drug- Resistant Tuberculosis,XDR-TB)仅有1项研究,故仅保留该研究中的结果。线性探针诊断耐利福平肺结核的灵敏度和特异度分别为0.91(0.88~0.94)和0.98(0.97~0.99)。线性探针诊断耐异烟肼肺结核的灵敏度和特异度分别为0.80(0.77~0.83)和0.98(0.96~0.99)。线性探针诊断XDR-TB的灵敏度较低,为0.46(0.19~0.75),特异度为1.00(0.98~1.00)。见表 1。按产品类型进行分析,只有耐利福平和耐异烟肼肺结核相关研究涉及这两类产品。对于耐利福平肺结核,GenoType MTBDRplus和GenoType MTBDRsl的灵敏度和特异度分别为0.92(0.89~0.94)和0.98(0.97~0.99),反向斑点杂交技术的灵敏度和特异度分别为0.76(0.64~0.85)和0.93(0.86~0.96)。对于耐异烟肼肺结核,GenoType MTBDRplus和GenoType MTBDRsl的灵敏度和特异度分别为0.80(0.77~0.82)和0.98(0.96~0.99),反向斑点杂交技术的灵敏度和特异度分别为0.88(0.77~0.94)和0.91(0.85~0.95)(表 2)。所有敏感性分析均采用双变量模型合并效应值,见表 3。
近年来,大量分子诊断技术开始出现,线性探针就是其中之一。虽然线性探针获得检测结果快,但其仍存在一定的缺陷。有研究显示,线性探针的诊断准确性没有传统药敏试验高,且所需费用比传统药敏试验高[8]。一项南非的研究显示[9],对于每例样本,线性探针比传统液体培养方法多支出6.58美元。此外,多项报道提示,线性探针具有较高的特异度,但其灵敏度较低[10]。有研究显示与传统药敏试验相比,GenoType MTBDRplus和GenoType MTBDRsl检测耐异烟肼肺结核的特异度为1.00(0.86~1.00)、灵敏度为0.86(0.42~1.00);检测耐利福平肺结核的特异度为1.00(0.86~1.00)、灵敏度为0.83(0.36~1.00)[11]。可见,线性探针在临床上的推广仍然饱受争议。本研究希望能为临床上线性探针的使用提供循证参考。
本研究分析了线性探针对耐利福平肺结核、耐异烟肼肺结核、MDR-TB、耐喹诺酮肺结核、耐二线注射类肺结核和XDR-TB的诊断准确性。从各自灵敏度和特异度的合并值可以看出,线性探针对各类耐药肺结核诊断的特异度均较高,最小值为耐喹诺酮肺结核对应的0.94(0.91~0.97)。但是线性探针对不同耐药类型肺结核的灵敏度差异较大。线性探针对耐利福平肺结核和耐喹诺酮肺结核的灵敏度较高,但其对XDR-TB的诊断灵敏度仅为0.46(0.19~0.75),这提示线性探针可能不适用于诊断XDR-TB。
本研究存在局限性。本研究仅按产品类型进行亚组分析,由于纳入文献数量不足,未对痰涂片情况进行分析。比如:传统药敏试验较难诊断出菌阴肺结核的耐药性,而线性探针技术就能很好地实现菌阴肺结核的诊断。但由于本研究所纳入的原始研究中的患者基本均为痰涂片阳性患者,仅有1篇文献探讨了痰涂片阴性肺结核[12],所以本研究并未能很好地探讨线性探针诊断菌阴肺结核的情况。此外,在按耐药类型分开分析时,有的耐药类型相关研究数量很少。
利益冲突 无
| [1] |
World Health Organization. Global tuberculosis report 2017[Z]. (2017)[2018-07-12]. Available from: http://www.who.int/tb/publications/global_report/en/.
|
| [2] |
de Beenhouwer H, Lhiang Z, Jannes G, et al. Rapid detection of rifampicin resistance in sputum and biopsy specimens from tuberculosis patients by PCR and line probe assay[J]. Tuber Lung Dis, 1995, 76(5): 425-430. DOI:10.1016/0962-8479(95)90009-8 |
| [3] |
Liu Q, Li GL, Chen C, et al. Diagnostic performance of the GenoType MTBDRplus and MTBDRsl assays to identify tuberculosis drug resistance in Eastern China[J]. Chin Med J, 2017, 130(13): 1521-1528. DOI:10.4103/0366-6999.208248 |
| [4] |
Anek-Vorapong R, Sinthuwattanawibool C, Podewils LJ, et al. Validation of the GenoType® MTBDRplus assay for detection of MDR-TB in a public health laboratory in Thailand[J]. BMC Infect Dis, 2010, 10: 123. DOI:10.1186/1471-2334-10-123 |
| [5] |
Barnard M, van Pittius NCG, van Helden PD, et al. The diagnostic performance of the GenoType MTBDRplus version 2 line probe assay is equivalent to that of the Xpert MTB/RIF assay[J]. J Clin Microbiol, 2012, 50(11): 3712-3716. DOI:10.1128/JCM.01958-12 |
| [6] |
Singh BK, Sharma SK, Sharma R, et al. Diagnostic utility of a line probe assay for multidrug resistant-TB in smear-negative pulmonary tuberculosis[J]. PLoS One, 2017, 12(8): e182988. DOI:10.1371/journal.pone.0182988 |
| [7] |
Crudu V, Stratan E, Romancenco E, et al. First evaluation of an improved assay for molecular genetic detection of tuberculosis as well as rifampin and isoniazid resistances[J]. J Clin Microbiol, 2012, 50(4): 1264-1269. DOI:10.1128/JCM.05903-11 |
| [8] |
Groessl EJ, Ganiats TG, Hillery N, et al. Cost analysis of rapid diagnostics for drug-resistant tuberculosis[J]. BMC Infect Dis, 2018, 18(1): 102. DOI:10.1186/s12879-018-3013-0 |
| [9] |
Shah M, Chihota V, Coetzee G, et al. Comparison of laboratory costs of rapid molecular tests and conventional diagnostics for detection of tuberculosis and drug-resistant tuberculosis in South Africa[J]. BMC Infect Dis, 2013, 13: 352. DOI:10.1186/1471-2334-13-352 |
| [10] |
Javed H, Jamil N, Jagielski T, et al. Evaluation of Genotype MTBDRplus assay for rapid detection of isoniazid and rifampicin resistance in mycobacterium tuberculosis clinical isolates from Pakistan[J]. Int J Mycobacteriol, 2016, 5(Suppl 1): S147-148. DOI:10.1016/j.ijmyco.2016.11.010 |
| [11] |
Felkel M, Exner R, Schleucher R, et al. Evaluation of Mycobacterium tuberculosis drug susceptibility in clinical specimens from Nigeria using Genotype MTBDRplus and MTBDRsl assays[J]. Eur J Microbiol Immunol (Bp), 2013, 3(4): 252-257. DOI:10.1556/EuJMI.3.2013.4.3 |
| [12] |
彭亦平, 宗佩兰, 辛茶香, 等. 应用PCR-反向点杂交技术快速检测结核分枝杆菌耐药突变基因[J]. 中国防痨杂志, 2016, 38(8): 619-622. Peng YP, Zong PL, Xin CX, et al. Rapid detection of Mycobacterium tuberculosis resistant genes using PCR reverse dot blotting hybridization[J]. Chin J Antituberc, 2016, 38(8): 619-622. DOI:10.3969/j.issn.1000-6621.2016.08.004 |
 2018, Vol. 39
2018, Vol. 39