文章信息
- 李俐, 丁玲, 吕元婧, 王铭, 刘春亮, 韩阳, 王金桃.
- Li Li, Ding Ling, Lyu Yuanjing, Wang Ming, Liu Chunliang, Han Yang, Wang Jintao.
- 阴道微环境改变与HPV16感染在宫颈上皮内瘤变中的作用及其交互效应
- Interaction between vaginal micro-environment alterations and HPV16 infection in cervical intraepithelial neoplasia
- 中华流行病学杂志, 2018, 39(11): 1486-1490
- Chinese Journal of Epidemiology, 2018, 39(11): 1486-1490
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2018.11.013
-
文章历史
收稿日期: 2018-04-03
宫颈癌是世界范围内常见的妇科恶性肿瘤之一,全球每年约有48.5万宫颈癌新发病例和26.6万死亡病例[1]。高危型人乳头瘤病毒(HR-HPV)持续感染是宫颈上皮内瘤变(CIN)及宫颈癌的主要病因[2],其中,HPV16是全球最常见的致癌型别,在宫颈癌患者中的检出率>60%[3]。而宫颈癌发生还可能存在其他致癌因素或协同因素。现有研究表明阴道微环境改变与各种阴道炎等生殖道感染性疾病及HPV感染的发生有关[4-7],但相关研究有限,特别是讨论宫颈上皮内瘤变这一宫颈癌前病变进展中,阴道微环境改变与HPV感染的相互关系和作用如何目前尚不清楚。本研究旨在探讨阴道微环境改变和HPV16感染在宫颈上皮内瘤变发生发展过程中的作用及其交互效应,以期为宫颈上皮内瘤变预防和干预措施的制定提供新思路,为实现宫颈癌预防关口的前移提供科学依据。
对象与方法1.研究对象:从建立在山西省介休市社区的宫颈病变研究队列人群中,选取2014年6-12月间经液基薄层细胞检测技术(TCT)筛查、阴道镜检查,最终经病理学确诊的正常子宫颈(NC)妇女623例,低度宫颈上皮内瘤变(CINⅠ)患者303例,高度宫颈上皮内瘤变(CINⅡ/Ⅲ)患者93例为研究对象。排除妊娠期妇女,其他生殖器感染性疾病,其他恶性肿瘤、免疫系统、消化系统、血液系统疾病和精神疾病患者以及子宫切除术史者。在获得山西医科大学伦理委员会批准和患者知情同意的情况下实施本研究。
2.资料和标本的收集:由经过严格培训的调查人员采用统一的结构式问卷收集研究对象的人口学特征、生活习惯、月经婚育史、妇科病史、肿瘤家族史等资料。使用扩阴器暴露宫颈,用无菌棉棒于阴道侧壁上1/3处尽可能多地采集分泌物,以清晰见到棉棒上有分泌物附着为准,随后将棉棒放入盛有500 μl稀释液的塑料软试管中,反复挤压和旋转棉棒使附着的分泌物充分释放,弃棉棒得到所需的分泌物样本液,即刻完成H2O2、pH值、阴道清洁度、β-葡萄糖醛酸苷酶、凝固酶、唾液酸酐酶和白细胞酯酶的检测。同时用宫颈刷于宫颈口处顺时针旋转3~5圈,收集研究对象的宫颈脱落细胞,将其放入专用细胞保存液中,用于HPV分型检测。
3.实验方法:所有实验均由具有检验医师资格证的专业人员完成,实验前进行专项培训,统一检测标准和方法。HPV16感染状态检测采用HPV-DNA提取试剂盒及21种HPV分型检测试剂盒(潮州凯普生物化学有限公司),阳性检测结果为清晰可见的蓝紫色圆点。阴道pH值检测采用pH精密试纸检测阴道分泌物pH值,pH≤4.5判断为正常,pH>4.5判断为异常。阴道清洁度检测严格按照《全国临床检验操作规程》标准判断清洁度[8],Ⅰ~Ⅱ度为正常,Ⅲ~Ⅳ度为异常。阴道分泌物预成酶谱检测严格按照需氧菌性阴道炎(AV)/细菌性阴道病(BV)五项联合测定试剂盒(北京中生金域诊断技术有限公司)操作说明书要求,使用一次性无菌吸管在反应装置的5个孔中每孔滴加一滴(约35 μl)分泌物样本液,阴性判断为正常,阳性判断为异常。为了保证实验结果的可靠性,每周抽取10%的样本进行重复测量,误差控制在3%以内,且每次检测时均使用试剂盒中标准配置的质控品进行各项指标的质控检测,保证实验结果的准确性。
4.统计学分析:采用SPSS 22.0软件进行χ2检验和趋势性χ2检验,采用logistic回归模型计算因素与宫颈上皮内瘤变之间的OR值及其95%CI。应用广义多因子降维模型(GMDR)进行交互作用评价,将检验样本准确度最高和交叉验证一致性最高且置换检验有统计学意义的模型确定为最优模型,根据统计简约性原则,如果检验样本准确度最高和交叉验证一致性最高的模型不是同一个模型,则优先选取阶数较低的模型。以P<0.05为差异有统计学意义。
结果1.人口学特征及相关影响因素分析:NC组、CINⅠ组和CINⅡ/Ⅲ组在年龄、文化程度、婚姻状况、经济收入、吸烟、洗澡方式、经期性生活、非经期使用护垫、月经规律与否、痛经、性病史、阴道炎、盆腔炎、洗澡频率、初潮年龄、首次性生活年龄、首次怀孕年龄、初产年龄、孕次、产次、人流史等方面的差异无统计学意义(P>0.05),但在职业(χ2=6.373,P=0.041)、被动吸烟(χ2=14.166,P=0.001)、洗阴频率(χ2=10.569,P=0.032)、换洗内裤频率(χ2=16.336,P=0.003)、性生活后洗阴(χ2=7.235,P=0.027)、避孕史(χ2=7.587,P=0.023)方面差异有统计学意义。
2.HPV16感染与宫颈上皮内瘤变的关系:NC组、CINⅠ组和CINⅡ/Ⅲ组妇女HPV16感染率的差异有统计学意义(χ2=60.69,P<0.001),调整影响宫颈上皮内瘤变的相关因素后,CINⅠ组、CINⅡ/Ⅲ组妇女HPV16感染率仍高于NC组。随着宫颈病变的进展,HPV16感染与CIN的关联强度逐渐升高(趋势性χ2=55.45,P<0.001)(表 1)。
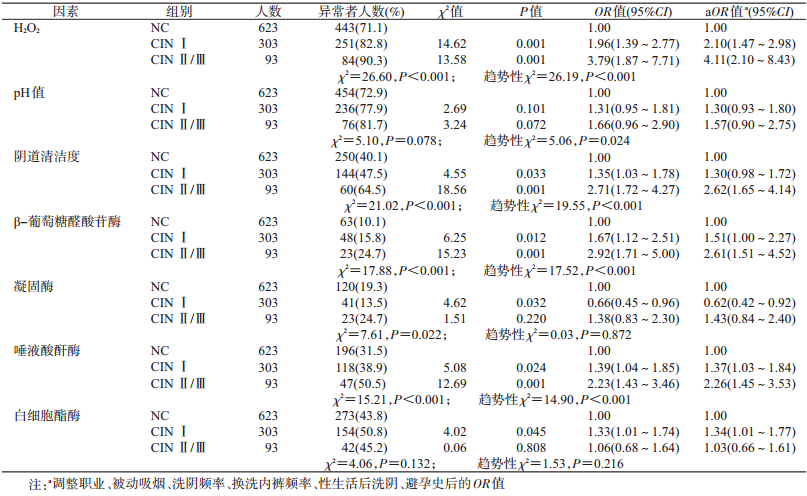
3.阴道微环境因子改变与宫颈上皮内瘤变的关系:H2O2 (χ2=26.60,P<0.001)、阴道清洁度(χ2=21.02,P<0.001)、β-葡萄糖醛酸苷酶(χ2=17.88,P<0.001)、凝固酶(χ2=7.61,P=0.022)、唾液酸酐酶(χ2=15.21,P<0.001)的异常率在NC组、CINⅠ组和CINⅡ/Ⅲ组差异有统计学意义。CINⅠ组妇女H2O2、阴道清洁度、β-葡萄糖醛酸苷酶、唾液酸酐酶、白细胞酯酶异常率高于NC组,凝固酶异常率则低于NC组(P<0.05)。CINⅡ/Ⅲ组妇女H2O2、阴道清洁度、β-葡萄糖醛酸苷酶、唾液酸酐酶异常率均高于NC组(P<0.05)。随着宫颈病变的进展H2O2、pH值、阴道清洁度、β-葡萄糖醛酸苷酶、唾液酸酐酶的异常率均逐渐升高(P<0.05),但凝固酶和白细胞酯酶异常率未见类似趋势(表 2)。
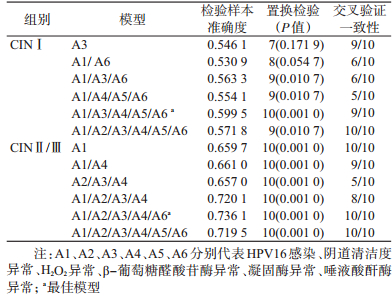
4.阴道微环境因子改变与HPV16感染在宫颈上皮内瘤变中的交互作用:将HPV16、阴道清洁度、H2O2、β-葡萄糖醛酸苷酶、凝固酶、唾液酸酐酶6个因素以异常为1、正常为0进行赋值后引入GMDR模型,以NC组为对照进行交互作用分析。结果显示,调整宫颈上皮内瘤变相关因素(职业、被动吸烟、洗阴频率、换洗内裤频率、性生活后洗阴、避孕史)后,在CINⅠ组,HPV16感染及H2O2、β-葡萄糖醛酸苷酶、凝固酶和唾液酸酐酶异常组成的5阶交互模型为最佳模型,置换检验有统计学意义(P<0.01);在CINⅡ/Ⅲ组,HPV16感染及阴道清洁度、H2O2、β-葡萄糖醛酸苷酶和唾液酸酐酶异常组成的5阶交互模型为最佳模型,置换检验有统计学意义(P<0.01),见表 3。
HPV16感染是宫颈癌的主要病因,在宫颈癌患者中的检出率>60%[3]。本研究显示,CINⅠ组和CINⅡ/Ⅲ组妇女HPV16感染率均高于NC组,且随着宫颈病变程度的加重,HPV16感染率逐渐升高,提示HPV16感染与宫颈上皮内瘤变,特别是高度CIN的发生密切相关。因此在育龄妇女中开展HPV筛查,尤其对HPV16阳性者进行更为精细的宫颈病变检查,对早期发现宫颈病变,将宫颈癌变的预防关口前移具有重要意义。
阴道微环境是由微生物菌群、宿主免疫力、体内外环境及阴道解剖结构组成的动态变化的微生态系统。阴道内聚集着大量微生物,正常情况下,阴道微环境中乳酸杆菌为优势菌,乳酸杆菌可分泌乳酸、H2O2及细菌素等并杀死部分条件致病菌,维持阴道微环境的稳定[4]。有研究显示,阴道微环境中pH值增高、H2O2降低与阴道炎的发生关系密切[9],荷兰研究发现阴道清洁度异常者比正常者癌前病变的发病率明显增加[10]。本研究发现,随着宫颈病变的进展,H2O2、pH值及清洁度异常率均逐渐升高,提示H2O2、pH值及清洁度异常,均可增加患宫颈上皮内瘤变的风险。Lazenby等[11]发现,阴道内致病菌数量增加、乳酸杆菌数量减少可以提高pH值、降低阴道清洁度、延长宫颈鳞状上皮化生时期,同时阴道内产生的丙酸和丁酸代谢产物可导致宫颈上皮细胞发生癌变。因此,提高阴道清洁度、维持阴道正常pH值以及产H2O2乳酸杆菌的正常比例,改善阴道微环境,对于预防宫颈上皮内瘤变以及阻断宫颈癌的进程具有重要意义。
近年来,细菌预成酶谱(唾液酸酐酶、β-葡萄糖醛酸苷酶、凝固酶、白细胞酯酶)联合检测技术在阴道微生态评价中得到广泛应用。唾液酸苷酶阳性与体内含有较多与细菌性阴道病相关的加德纳菌紧密相关[12]。而加德纳菌可利用补体调节分子CD59激活P38-撕裂元-蛋白通路,释放细胞溶解素,导致阴道上皮细胞死亡,从而使乳酸杆菌减少、pH升高[13],其相对丰度在宫颈病变进展中呈现先升高后逐渐降低的趋势[14]。Miyagi等[15]发现人类癌变细胞中唾液酸酐酶NEU3含量较非癌变细胞明显增加,提示细胞内唾液酸酐酶含量可作为检测癌症的标志物之一。本研究中,唾液酸酐酶阳性为CINⅠ、CINⅡ/Ⅲ的危险因素,且随着宫颈病变的进展,唾液酸酐酶异常率呈逐渐上升趋势,提示唾液酸酐酶阳性可作为宫颈病变筛查和病变进展的预警指标。
β-葡萄糖醛酸苷酶阳性与机体大肠埃希菌、B族链球菌感染有关[12]。大肠埃希菌属肠道正常菌群,因机体免疫力下降入侵肠外组织成为条件致病菌,在生殖道感染中检出率较高。研究发现产H2O2能力较强的乳酸杆菌对大肠埃希菌有体外拮抗作用[16],B族链球菌增多,可能抑制其他正常菌群的生长,是导致妊娠期/围产期妇女生殖道感染的主要致病菌。本研究发现,随着宫颈病变的进展,β-葡萄糖醛酸苷酶异常率呈逐渐上升趋势,提示β-葡萄糖醛酸苷酶异常可增加罹患CINⅠ、CINⅡ/Ⅲ的风险,涉及主要分泌β-葡萄糖醛酸苷酶的大肠埃希菌和B族链球菌在宫颈病变中的作用值得关注。
阴道中的致病性菌粪肠球菌和金黄色葡萄球菌可产生凝固酶[12]。粪肠球菌能够产生伏尔加霉素,有效抑制腐败微生物的繁殖;而金黄色葡萄球菌产生的凝固酶将使纤维蛋白沉积于菌体表面或凝固,抑制吞噬细胞的吞噬作用[17]。本研究显示,随着宫颈病变的进展,凝固酶异常率先降低后升高,提示在由正常宫颈到CIN的变化中,凝固酶这一反应阴道菌群变化的重要微环境因子的变化,可在一定程度上揭示阴道粪肠球菌与金黄色葡萄球菌的比值变化,为深入探讨阴道菌群与宫颈病变的关系提供重要线索。
HR-HPV持续感染是癌前病变及宫颈癌的主要病因[2]。McNicol等[18]提出阴道微环境改变可增加HPV感染机会,Korshunov等[19]进一步研究发现,CIN患者阴道内乳酸杆菌减少,各种条件致病菌增多,然而,在宫颈病变发生中阴道微环境改变与HPV感染的相互关系尚不清楚。GMDR是近年来建立的高阶交互作用分析方法,优势在于能够同时检测并刻画影响疾病的多因素联合作用,而且能够纳入协变量以提高预测的准确性,适用的数据结构也更加宽泛。基于GMDR模型,调整宫颈上皮内瘤变的相关因素后发现,HPV16感染和H2O2、β-葡萄糖醛酸苷酶、凝固酶、唾液酸酐酶异常对于CINⅠ的发生具有交互作用,而HPV16感染和阴道清洁度、H2O2、β-葡萄糖醛酸苷酶、唾液酸酐酶异常则在CINⅡ/Ⅲ发生中交互效应更为明显。虽然经GMDR分析难以评价交互作用的强度,但在考虑多种因素影响的情况下,提示HPV16感染与阴道微环境失衡同时存在可增加宫颈上皮内瘤变发生的风险。有研究提示,阴道致病菌可活化炎症转录因子NF-κB、分泌TNF-α、IL-6、IL-8等,这些炎症因子的持续活化,可导致宫颈组织损伤,进而提高HPV16的易感性和致癌能力[20]。Aires等[21]的研究发现,乳酸杆菌有类似质粒的功能,可以整合HPV16,从而防止病毒与宿主细胞的整合。当阴道乳酸杆菌减少,致病菌增加,一系列阴道微环境因子发生改变时,可引起阴道微生态失衡,引发HPV16持续感染的风险增加[22],进而启动HPV16与宿主DNA整合这一关键致癌环节,导致宫颈病变的发生发展。因此,密切关注女性阴道微环境的改变,加强高危型HPV16的检测力度,对于宫颈癌前病变的早期发现和宫颈病变进展的预测具有重要意义。
利益冲突 无
| [1] |
Fitzmaurice C, Dicker D, Pain A, et al. The global burden of cancer 2013[J]. JAMA Oncol, 2015, 1(4): 505-527. DOI:10.1001/jamaoncol.2015.0735 |
| [2] |
Wang HL, Lu X, Yang XD, et al. Association of MBL2 exon1 polymorphisms with high-risk human papillomavirus infection and cervical cancers:a Meta-analysis[J]. Arch Gynecol Obstetr, 2016, 294(6): 1109-1116. DOI:10.1007/s00404-016-4201-z |
| [3] |
Shukla S, Mahata S, Shishodia G, et al. Functional regulatory role of STAT3 in HPV16-mediated cervical carcinigenesis[J]. PLoS One, 2013, 8(7): e67849. DOI:10.1371/journal.pone.0067849 |
| [4] |
Motevaseli E, Shirzad M, Akrami SM, et al. Normal and tumour cervical cells respond differently to vaginal lactobacilli, independent of pH and lactate[J]. J Med Microbiol, 2013, 62(Pt 7): 1065-1072. DOI:10.1099/jmm.0.057521-0 |
| [5] |
Huang YE, Wang Y, He Y, et al. Homogeneity of the vaginal microbiome at the cervix, posterior fornix, and vaginal canal in pregnant Chinese women[J]. Microb Ecol, 2015, 69(2): 407-414. DOI:10.1007/s00248-014-0487-1 |
| [6] |
Clarke MA, Rodriguez AC, Gage JC, et al. A large, population-based study of age-related associations between vaginal pH and human papillomavirus infection[J]. BMC Infect Dis, 2012, 12(1): 1-9. DOI:10.1186/1471-2334-12-33 |
| [7] |
Liu SH, Cummings DAT, Zenilman JM, et al. Characterizing the temporal dynamics of human papillomavirus DNA detectability using short-interval sampling[J]. Cancer Epidemiol Biomarkers Prev, 2014, 23(1): 200-208. DOI:10.1158/1055-9965.EPI-13-0666 |
| [8] |
叶应妩, 王毓三, 申子瑜. 全国临床检验操作规程[M]. 南京: 东南大学出版社, 2006: 234. Ye YW, Wang YS, Shen ZY. National Guide to Clinical Laboratory Procedures[M]. Nanjing: Southeast University Press, 2006: 234. |
| [9] |
Petrova MI, Lievens E, Malik S, et al. Lactobacillus species as biomarkers and agents that can promote various aspects of vaginal health[J]. Front Physiol, 2015, 6: 81. DOI:10.3389/fphys.2015.00081 |
| [10] |
Klomp JM, Boon ME, Haaften MV, et al. Cytologically diagnosed Gardnerella vaginalis infection and cervical (pre)neoplasia as established in population-based cervical screening[J]. Am J Obstetr Gynecol, 2008, 199(5): 480. DOI:10.1016/j.ajog.2008.04.036 |
| [11] |
Lazenby GB, Taylor PT, Badman BS, et al. An association between Trichomonas vaginalis and high-risk human papillomavirus in rural Tanzanian women undergoing cervical cancer screening[J]. Clin Therapeut, 2014, 36(1): 38-45. DOI:10.1016/j.clinthera.2013.11.009 |
| [12] |
Wang ZL, Fu LY, Xiong ZA, et al. Diagnosis and microecological characteristics of aerobic vaginitis in outpatients based on preformed enzymes[J]. Taiwan J Obstetr Gynecol, 2016, 55(1): 40-44. DOI:10.1016/j.tjog.2015.06.012 |
| [13] |
Patterson JL, Stull-Lane A, Girerd PH, et al. Analysis of adherence, biofilm formation and cytotoxicity suggests a greater virulence potential of Gardnerella vaginalis relative to other bacterial-vaginosis-associated anaerobes[J]. Microbiology, 2010, 156(Pt 2): 392-399. DOI:10.1099/mic.0.034280-0 |
| [14] |
潘颖.高危型HPV感染及不同级别宫颈病变女性阴道菌群多样性分析[D].衡阳: 南方医科大学, 2016. Pan Y. Diversity analysis of vaginal microbiota on woman with high-risk human papillomavirus infection and different levels of cervical lesions[D]. Hengyang: Southern Medical University, 2016. |
| [15] |
Miyagi T, Wada T, Yamaguchi K, et al. Human sialidase as a cancer marker[J]. Proteomics, 2008, 8(16): 3303-3311. DOI:10.1002/pmic.200800248 |
| [16] |
王丽莉, 陈其御. 人阴道乳酸杆菌对大肠杆菌的体外拮抗作用[J]. 江苏医药, 2005, 31(9): 662-663. Wang LL, Chen QY. Antagonistic activity of human vaginal lactobacilli against E. coli in vitro[J]. Jiangsu Med, 2005, 31(9): 662-663. DOI:10.3969/j.issn.0253-3685.2005.09.008 |
| [17] |
周朝阳, 蔡东飞, 单东红. 需氧菌阴道炎快速诊断的一种新方法[J]. 中国微生态学杂志, 2011, 23(6): 559-560. Zhou CY, Cai DF, Shan DH. A new method for rapid diagnosis of aerobic bacteria vaginitis[J]. Chin J Microecol, 2011, 23(6): 559-560. |
| [18] |
McNicol P, Paraskevas M, Guijon F. Variability of polymerase chain reaction-based detection of human papillomavirus DNA is associated with the composition of vaginal microbial flora[J]. J Med Virol, 1994, 43(2): 194-200. DOI:10.1002/jmv.1890430218 |
| [19] |
Korshunov VM, Kafarskaia LI, Bagirova MSh, et al. The effect of SolcoTrichovac on the vaginal microflora of patients with a papillomavirus infection associated with a cervical intraepithelial neoplasm[J]. Zh Mikrobiol Epidemiol Immunobiol, 1994(5): 13-17. |
| [20] |
Doerflinger SY, Throop AL, Herbst-Kralovetz MM. Bacteria in the vaginal microbiome alter the innate immune response and barrier properties of the human vaginal epithelia in a species-specific manner[J]. J Infect Dis, 2014, 209(12): 1989-1999. DOI:10.1093/infdis/jiu004 |
| [21] |
Aires KA, Cianeiarullo AM, Carneiro SM, et al. Production of human papillomavirus type 16 L1 virus-like particles by recombinant Lactobaeillus casei cells[J]. Appl Environ Microbiol, 2006, 72(1): 745-752. DOI:10.1128/AEM/72.1.745-752.2006 |
| [22] |
Gillet E, Meys JFA, Verstraelen H, et al. Bacterial vaginosis is associated with uterine cervical human papillomavirus infection:a Meta-analysis[J]. BMC Infect Dis, 2011, 11: 10. DOI:10.1186/1471-2334-11-10 |
 2018, Vol. 39
2018, Vol. 39