文章信息
- 刘吉洛, 蒲蕊, 马龙腾, 王硕, 殷建华, 曹广文.
- Liu Jiluo, Pu Rui, Ma Longteng, Wang Shuo, Yin Jianhua, Cao Guangwen.
- C型HBV感染者发展为肝癌的危险因素及风险预测
- Risk factors analysis and a new risk scoring system predicting hepatocarcinogenesis for chronic genotype C HBV infected patients
- 中华流行病学杂志, 2018, 39(11): 1459-1464
- Chinese Journal of Epidemiology, 2018, 39(11): 1459-1464
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2018.11.008
-
文章历史
收稿日期: 2018-04-11
肝癌发病率和死亡率都较高[1],中国每年大约有50万新发肝癌患者,并有20万患者死于肝癌[2]。肝癌发病的危险因素包括肝硬化、慢性病毒性肝炎感染、酗酒史、肝癌家族史、铁过量摄入和毒素暴露等,其中HBV感染是我国肝癌发病的主要危险因素之一[3]。HBV携带者会发生肝硬化、肝功能衰竭甚至肝癌等终末期肝脏疾病[4]。HBV的基因型包括A~H型,我国主要以A、B、C和D型为主。不同基因型的病毒致病特点不尽相同,B型常引起急性感染,而C型常导致慢性感染并可引发重症肝病,其中C2亚型感染为肝癌发生的一个重要危险因素。在炎症向肝癌转化的过程中,由于人体自身免疫以及抗病毒药物治疗等因素,HBV在患者体内呈现“变异-选择-适应”的进化特征,随着时间的发展会发生不同程度的基因变异,Ji等[5]的研究显示,核心启动子区(Basic Core Promoter,BCP)以及PreS区的相关位点突变可能与肝癌的发生发展密切相关。近年来,出现了多个慢性乙型肝炎(乙肝)患者发生肝癌的风险预测模型,这些模型将年龄、性别、生理生化指标以及DNA载量等作为评价指标[6]。我国HBV感染主要以C型为主,为了评估慢性乙肝患者发生肝癌的风险概率,本研究除了纳入患者的基本临床信息外,还加入了病毒突变情况,构建了C型HBV感染者进展为肝癌的风险评估体系,希望可以与现有评分体系互相补充,以期能够及时准确地判断患者发生肝癌的倾向性,采取有效的干预措施,延缓肝癌的发病进程。
对象与方法1.研究对象:2000年1月至2007年12月由上海长征医院感染科收入院并被确诊为慢性HBV感染者共1 953人。研究者于HBsAg阳性患者入院时抽取血液,并填写知情同意书。干扰素治疗的常规疗程为48周。出院后,对患者进行随访,随访终结标准:肝癌患者的随访终点为确诊肝癌的时间点;非肝癌患者为患者死亡。纳入标准:①慢性HBV感染者;②收住入院进行血清学检测时有足够的血液样本并有备份的血液样本;③血清学检测结果可明确HBV基因型;④患者知晓保密协议并签署知情同意。排除标准:①已经发展为肝癌的患者;②确诊或病史显示并发其他类型肝炎如甲型或丙型病毒性肝炎等;③患者合并感染梅毒、HIV等或有自身免疫性疾病;④在收住入院之前已接受系统的抗病毒治疗。慢性乙肝、肝硬化和肝癌诊断根据现有的临床诊断标准[7-8]。临床信息采集及患者完成调查问卷后,由工作人员统一录入。其中部分患者因为下列原因排除研究:拒绝签署知情同意书;血清学检测样本量不足;其他严重的肝脏疾病;1年内发现肝癌;失访。随访截止时间为2013年5月,共成功随访1 525例患者,随访率为78.08%。本研究由第二军医大学伦理审查委员会审核批准。
2. HBV基因分型、DNA测序:HBV基因型鉴定采用多重PCR法和巢式多重PCR法[7, 9]。BCP区点突变采用巢式PCR法进行扩增,共计两轮扩增反应。第一轮共计30个循环,每个循环变性60 s(94 ℃)、退火55 s(53 ℃)以及延伸60 s(72 ℃);第二轮共计35个循环,每个循环扩增条件同第一轮相同。第一轮的引物为BCP-1S(TGC ACT TCG CTT ACC TCT G)、BCP-1AS(TAA GCG GAG GAG TGC GAA T);第二轮的引物为BCP-2S(TCG CAT GGA GAC CAC CGT GA)、BCP-2AS(ATA GCT TGC CTG AGT GC)。条带清晰且单一的PCR产物经挑选纯化后送生工生物工程(上海)股份有限公司,采用ABI3730基因分析仪进行产物直接双向测序。
3.风险预测模型构建与评估:单因素分析肝癌相关的危险因素采用Cox风险比例模型;然后将确定的单因素结果纳入Cox风险比例模型进行多因素分析。针对有统计学意义的风险因素,应用R语言(https://www.r-project.org/)的rms软件包构建列线图预测模型,并以C值评估预测模型性能,对所选项目进行加权拟合,计算风险分数。按照模型计算的结果,对验证队列的患者进行评分,以中位数作为界点,分为高分数组以及低分数组并依据分组绘制生存曲线,检验模型对于不同肝癌风险患者的区分度。
4.生物信息学和统计学分析:采用MEGA 5.0和BioEdit 7.0软件进行序列分析。通过整理文献选取肝炎转化为肝癌的相关特异性变异位点。采用SPSS 18.0软件进行数据库构建和统计学分析。采用χ2检验比较分析分类变量如年龄、是否发生肝癌、各项生理指标范围在基因型B型和C型分布差异;非正态分布的计量资料如病毒DNA载量等,经对数转换后再进行Student’s t检验或方差分析的比较。所有统计学检验均为双侧检验,检验水准α=0.05。
结果1.一般特征:1 953例患者中,1 525例成功鉴别HBV基因型纳入最终分析,其中B型27.2%(415/1 525),C型72.8%(1 110/1 525)。基因型C组患者平均随访8.52(5.36~11.68)年,肝癌发生率为11.93/1 000人年。见表 1。
2.影响肝癌发生的危险因素分析:单因素Cox分析显示,男性、年龄≥40岁、肝硬化、直接胆红素(>7 μmol/L),白蛋白(<35 g/L)和HBV T1674CG、A1762T/G1764A、A3120T、G2951A、A2962G、C2964A突变能够增加肝癌发生的危险性;干扰素治疗能够降低肝癌发生的危险性。将上述风险因素纳入Cox多因素分析中,结果显示,男性、年龄≥40岁、HBV T1674CG、A1762T/G1764A、A3120T和A2962G突变可以增加肝癌发生的危险性;干扰素治疗可以降低肝癌发生的危险性。见表 2。
3.基因型C型HBV感染者肝癌风险模型的构建:应用R语言的rms软件包对性别、年龄、是否应用干扰素治疗和有统计学意义的基因点突变进行加权分析。根据加权系数可以为每项危险因素赋予相应风险评分,分别为年龄≥40岁10分、性别为男性5分、未进行干扰素治疗10分、T1674C/G突变4分、A1762T/G1764A突变6分、A3120T突变5分、A2962G突变5分。最终的风险评估量表包括性别、年龄(是否≥40岁)、是否进行干扰素治疗、T1674C/G、A1762T/G1764A、A3120T和A2962G突变情况。总分为0~45分。
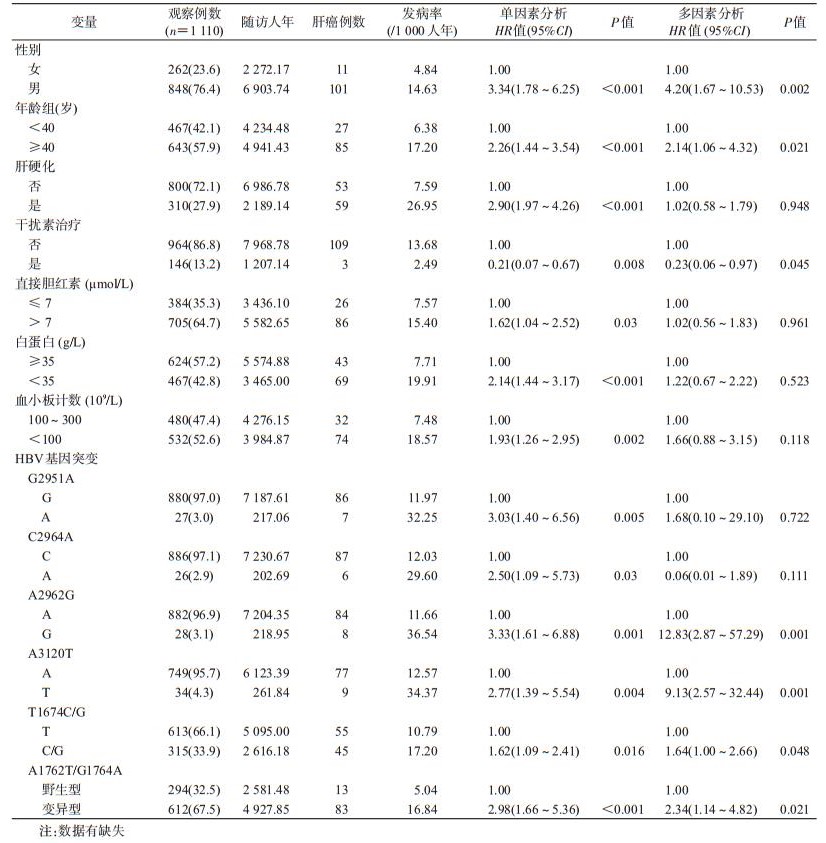
对本研究中的C型HBV感染者依据模型进行评分并检验患者实际患肝癌情况与模型的拟合度。探索队列中,检验该模型5年及10年的拟合效果,列线图模型预测C型HBV感染者肝癌发病风险的C值均>0.7,表明预测与实际的无病生存率拟合效果较好,即该模型可以较为真实地反映探索队列中患者的肝癌发生情况,预测效果可信度较高。其中该模型对于患者结局的5年预测效果优于10年预测效果。见图 1。

|
| 图 1 C型HBV感染者实际发病情况与模型预测情况拟合曲线 |
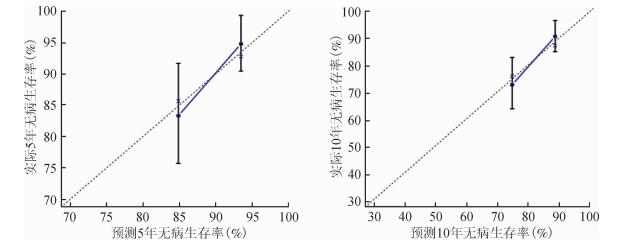
4.列线图模型的预测效果检验:验证队列取自1998年8月至2001年1月在长征医院分院感染科以及其他科室收治入院的C型HBV感染者。其中男性患者138人(76.5%),女性患者43人(23.5%),共计181人。患者平均随访12.43(QR:13.48~13.73)年,肝癌发生率为6.74/1 000人年。验证队列中C型HBV感染者肝癌发病实际情况与模型预测情况的拟合程度。在该模型验证队列中,患者5年及10年的预测无病生存率与实际无病生存率拟合良好,列线图模型预测患者肝癌发病风险的C值为0.64。见图 2。
|
| 图 2 验证队列中患者实际发病情况与模型预测情况拟合曲线 |
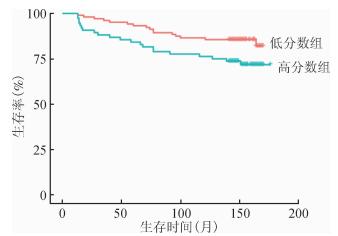
在验证队列中,依据列线图模型各项指标对患者进行评分。以所有患者综合得分的中位数(27分)作为分界点,依次将所有患者按照得分从高到低分为高、低分数组,高分数组定义为肝癌发生高风险组,低分数组定义为肝癌发生低风险组。两组患者的肝癌实际发病率差异有统计学意义(P=0.039),提示列线图模型对于各组患者的区分明显,可以较好地确认不同组患者肝癌发病的危险性,验证了列线图模型的有效性。见图 3。
|
| 图 3 验证队列中高、低分数组(肝癌发生高、低风险组)的生存曲线 |
全球范围内HBV慢性感染是患者发生包括肝癌等终末期肝脏疾病的主要危险因素[10]。大样本流行病学调查研究显示中国HBsAg阳性人群肝癌累计发病率达到35%,C亚型HBV感染为肝癌发生的一个重要危险因素[11]。
为探究并验证在慢性乙肝转换为肝癌的过程中的危险因素,本研究纳入1 110例C型HBV感染者,结合其收住入院即随访开始时的基线资料对各项因素进行评估。结果显示,在C型HBV感染者中,性别为男性、年龄≥40岁、发生肝硬化、直接胆红素(>7 μmol/L),白蛋白(<35 g/L)和HBV T1674CG、A1762T/G1764A、A3120T、G2951A、A2962G、C2964A是病毒感染发展为肝癌的独立危险因素;干扰素抗病毒治疗是病毒感染发展为肝癌的保护性因素。
迄今为止,国际上已经存在一些包括但不局限于上述危险因素的慢性乙肝患者转化为肝癌的评分系统,主要有CU-肝癌(Chinese University-肝癌)评分系统,GAG-肝癌(Guide with Age,Gender,HBV DNA,Core Promoter Mutations and Cirrhosis-肝癌)评分系统,REACH-B(Risk Estimation for Hepatocellular Carcinoma in Chronic Hepatitis B)评分系统[12]。CU-肝癌评分系统选取的评估项目包括年龄、血清白蛋白、血清胆红素、HBV DNA载量以及肝硬化,制定了从0~44.5分的量化评分体系[13]。GAG-肝癌评分系统的纳入项目包括基本资料以及BCP区的病毒DNA突变情况,但部分患者的病毒点突变情况由于条件限制不可测,故最终版本点突变排除[14]。REACH-B评分系统将年龄、性别和血清学检测指标作为危险评分项目,由于样本量足够大,目前为一种较为公认的风险预测模型并有若干改良后的版本[15-16]。以上的各个风险预测评分系统从不同角度对慢性乙肝患者转化为肝癌的风险进行了评估[17]。为了更好地对HBV感染者尤其是C型HBV感染者进行健康管理以及治疗,降低其肝癌发生风险,有必要建立一个有针对性的肝癌预测评分模型。
相对于其他类型的HBV感染,C型HBV在体内复制水平更高,所以在复制过程中更易诱发病毒的基因突变[18]。肝癌相关的HBV变异主要发生在核心启动子区和Pre S区[19]。其中位于病毒基因核心启动子区域的T1674CG、A1762T/G1764A等点突变在增强HBV在体内的复制能力的同时抑制了人体免疫系统对于病毒的识别和杀伤作用[20]。这些突变也能诱发病毒表达HBx蛋白的改变,使之有更强的致癌能力[21]。位于PreS区的A3120T、G2951A、A2962G、C2964A等突变影响肝脏细胞内部信号通路的转导和病毒蛋白的组装,从而增加了病毒的繁殖优势[22]。同时,HBV preS区变异发生频率较高,与肝癌的发生发展关系密切[23]。介于BCP区和PreS区相关突变在肝炎向肝癌转化过程中的重要作用,基因突变的情况应当纳入风险评估模型当中。
与此同时由于治疗效果不明确,现有的风险评估均未将干扰素治疗因素纳入评估项目[24-25]。但本研究结果显示,在C型HBV感染者中,干扰素治疗确实为有效的保护因素。本研究构建了列线图模型,结果显示,预测效果可信度较高。其中对于患者结局的5年预测效果优于10年预测效果,可能的解释是随着时间的推移,治疗方法的变化、生活习惯的改变等会作为混杂因素掩盖其他危险因素的作用。同时,本研究的样本仅来自长征医院,为单中心研究,样本代表性不足,模型的准确性有待在多中心进行不同组之间的比较和验证。
综上所述,本研究针对C型HBV感染者,验证了性别、年龄和血清学指标等经典因素在肝炎转化为肝癌中的作用,研究结果也显示,干扰素治疗及HBV相应区域基因突变对于肝癌发生发展具有重要作用。同时,本研究通过对相应的风险因素进行分析比较,提出了一种基于C型HBV变异情况的肝癌预测评分模型,通过这一风险预测系统,结合现有传统评分模型的辅助,可以及时对C型HBV感染者进行评估和健康管理,并可以通过施加相应的预防或治疗手段有效地遏制乙肝相关肝癌的发生。
利益冲突 无
| [1] |
Zhang AY, Lai CL, Poon RTP, et al. Hepatitis B virus full-length genomic mutations and quasispecies in hepatocellular carcinoma[J]. J Gastroenterol Hepatol, 2016, 31(9): 1638-1645. DOI:10.1111/jgh.13316 |
| [2] |
Kuang SY, Jackson PE, Wang JB, et al. Specific mutations of hepatitis B virus in plasma predict liver cancer development[J]. Proc Natl Acad Sci USA, 2004, 101(10): 3575-3580. DOI:10.1073/pnas.0308232100 |
| [3] |
Chen YM, Yu DJ, Zhang WY, et al. HBV subgenotype C2 infection, A1762T/G1764A mutations may contribute to hepatocellular carcinoma with cirrhosis in Southeast China[J]. Iran J Public Health, 2012, 41: 10-18. |
| [4] |
Kao JH. Risk stratification of HBV infection in Asia-Pacific region[J]. Clin Mol Hepatol, 2014, 20(3): 223-227. DOI:10.3350/cmh.2014.20.3.223 |
| [5] |
Ji XW, Zhang Q, Du Y, et al. Somatic mutations, viral integration and epigenetic modification in the evolution of hepatitis B virus-induced hepatocellular carcinoma[J]. Curr Genomics, 2014, 15(6): 469-480. DOI:10.2174/1389202915666141114213833 |
| [6] |
Varbobitis I, Papatheodoridis GV. The assessment of hepatocellular carcinoma risk in patients with chronic hepatitis B under antiviral therapy[J]. Clin Mol Hepatol, 2016, 22(3): 319-326. DOI:10.3350/cmh.2016.0045 |
| [7] |
Chen JS, Yin JH, Tan XJ, et al. Improved multiplex-PCR to identify hepatitis B virus genotypes A-F and subgenotypes B1, B2, C1 and C2[J]. J Clin Virol, 2007, 38(3): 238-243. DOI:10.1016/j.jcv.2006.12.007 |
| [8] |
Xie JX, Zhang YW, Zhang Q, et al. Interaction of signal transducer and activator of transcription 3 polymorphisms with hepatitis B virus mutations in hepatocellular carcinoma[J]. Hepatology, 2013, 57(6): 2369-2377. DOI:10.1002/hep.26303 |
| [9] |
Yin JH, Zhang HW, He YC, et al. Distribution and hepatocellular carcinoma-related viral properties of hepatitis B virus genotypes in Mainland China:a community-based study[J]. Cancer Epidemiol Biomarkers Prev, 2010, 19(3): 777-786. DOI:10.1158/1055-9965.EPI-09-1001 |
| [10] |
Fattovich G, Bortolotti F, Donato F. Natural history of chronic hepatitis B:special emphasis on disease progression and prognostic factors[J]. J Hepatol, 2008, 48(2): 335-352. DOI:10.1016/j.jhep.2007.11.011 |
| [11] |
Huang YT, Jen CL, Yang HI, et al. Lifetime risk and sex difference of hepatocellular carcinoma among patients with chronic hepatitis B and C[J]. J Clin Oncol, 2011, 29(27): 3643-3650. DOI:10.1200/JCO.2011.36.2335 |
| [12] |
Lee HW, Ahn SH. Prediction models of hepatocellular carcinoma development in chronic hepatitis B patients[J]. World J Gastroenterol, 2016, 22(37): 8314-8321. DOI:10.3748/wjg.v22.i37.8314 |
| [13] |
Wong GLH, Chan HLY, Wong CKY, et al. Liver stiffness-based optimization of hepatocellular carcinoma risk score in patients with chronic hepatitis B[J]. J Hepatol, 2014, 60(2): 339-345. DOI:10.1016/j.jhep.2013.09.029 |
| [14] |
Seo YS, Kim MN, Kim SU, et al. Risk assessment of hepatocellular carcinoma using transient elastography vs. liver biopsy in chronic hepatitis b patients receiving antiviral therapy[J]. Medicine (Baltimore), 2016, 95(12): e2985. DOI:10.1097/MD.0000000000002985 |
| [15] |
Chen TM, Chang CC, Huang PT, et al. Performance of risk estimation for hepatocellular carcinoma in chronic hepatitis B (REACH-B) score in classifying treatment eligibility under 2012 Asian Pacific Association for the Study of the Liver (APASL) guideline for chronic hepatitis B patients[J]. Aliment Pharmacol Ther, 2013, 37(2): 243-251. DOI:10.1111/apt.12144 |
| [16] |
Yang HI, Yuen MF, Chan HLY, et al. Risk estimation for hepatocellular carcinoma in chronic hepatitis B (REACH-B):development and validation of a predictive score[J]. Lancet Oncol, 2011, 12(6): 568-574. DOI:10.1016/S1470-2045(11)70077-8 |
| [17] |
Yang HI, Lee MH, Liu J, et al. Risk calculators for hepatocellular carcinoma in patients affected with chronic hepatitis B in Asia[J]. World J Gastroenterol, 2014, 20(20): 6244-6251. DOI:10.3748/wjg.v20.i20.6244 |
| [18] |
Liu CJ, Kao JH. Global perspective on the natural history of chronic hepatitis B:role of hepatitis B virus genotypes A to J[J]. Semin Liver Dis, 2013, 33(2): 97-102. DOI:10.1055/s-0033-1345716 |
| [19] |
El-Serag HB, Rudolph KL. Hepatocellular carcinoma:epidemiology and molecular carcinogenesis[J]. Gastroenterology, 2007, 132(7): 2557-2576. DOI:10.1053/j.gastro.2007.04.061 |
| [20] |
Moriyama K, Okamoto H, Tsuda F, et al. Reduced precore transcription and enhanced core-pregenome transcription of hepatitis B virus DNA after replacement of the precore-core promoter with sequences associated with e antigen-seronegative persistent infections[J]. Virology, 1996, 226(2): 269-280. DOI:10.1006/viro.1996.0655 |
| [21] |
Liu LP, Hu BG, Ye C, et al. HBx mutants differentially affect the activation of hypoxia-inducible factor-1α in hepatocellular carcinoma[J]. Br J Cancer, 2014, 110(4): 1066-1073. DOI:10.1038/bjc.2013.787 |
| [22] |
Abe K, Thung SN, Wu HC, et al. Pre-S2 deletion mutants of hepatitis B virus could have an important role in hepatocarcinogenesis in Asian children[J]. Cancer Sci, 2009, 100(12): 2249-2254. DOI:10.1111/j.1349-7006.2009.01309.x |
| [23] |
Liu SJ, Xie JX, Yin JH, et al. A matched case-control study of hepatitis B virus mutations in the preS and core promoter regions associated independently with hepatocellular carcinoma[J]. J Med Virol, 2011, 83(1): 45-53. DOI:10.1002/jmv.21829 |
| [24] |
Lin SM, Yu ML, Lee CM, et al. Interferon therapy in HBeAg positive chronic hepatitis reduces progression to cirrhosis and hepatocellular carcinoma[J]. J Hepatol, 2007, 46(1): 45-52. DOI:10.1016/j.jhep.2006.08.021 |
| [25] |
Cordero-Ruiz P, Carmona-Soria I, Rodriguez-Tellez M, et al. Long-term follow-up of patients with chronic hepatitis C treated with alpha-interferon and ribavirin antiviral therapy:clinical and fibrosis impact of treatment response[J]. Eur J Gastroenterol Hepatol, 2017, 29(7): 792-799. DOI:10.1097/Meg.0000000000000886 |
 2018, Vol. 39
2018, Vol. 39