文章信息
- 乔晓彤, 丁盈盈, 何纳.
- Qiao Xiaotong, Ding Yingying, He Na.
- HIV感染者神经认知障碍相关血液生物标志物研究
- A systematic review on blood biomarkers of neurocognitive disorders in HIV infected individuals
- 中华流行病学杂志, 2018, 39(9): 1274-1280
- Chinese Journal of Epidemiology, 2018, 39(9): 1274-1280
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2018.09.025
-
文章历史
收稿日期: 2018-01-13
随着高效抗反转录病毒治疗的广泛应用,HIV感染者的生存期明显延长,HIV相关神经认知障碍并发症显得尤为突出[1-2]。神经认知障碍多起病隐匿,至今还未发现任何一种量表能够既灵敏又特异地识别所有临床环境中该疾病的早期阶段。然而,生物标志物的改变可以在不可逆的中枢神经系统损伤之前发生。因此,通过对血液中生物标志物的检测,能够临床辅助筛查出早期的神经认知障碍,帮助HIV感染者改善疾病预后,提高生存质量。
资料与方法1.检索方法:检索2008-2017年英文数据库PubMed,检索词有“Neurocognitive Disorder”或“Neurocognitive Impairment”或“Cognitive Dysfunction”或“Cognitive Decline”,“HIV”,“Biomarker”。对中国知网、万方和维普数据库检索,检索词有“神经认知障碍”或“神经认知疾病”或“神经认知损伤”或“神经认知紊乱”,“HIV”或“艾滋病”。
2.文献筛选:纳入标准:①关于HIV相关神经认知障碍的标志物研究;②使用的生物材料为血液;③原创性研究;④包含研究类型、研究地点、研究人群、样本量、研究结果等信息。排除标准:①文献类型为综述、评论、信件、基础研究、案例报道等;②重复报道;③使用的生物材料为脑组织、脑脊液或为影像学研究。
3.分析方法:根据检索策略在4个数据库中进行独立检索,将检索的文献用NoteExpress 3.2.0.7103软件查重并剔除重复的文献,随后按照纳入及排除标准对文献进行筛选,对所有符合纳入标准的研究文献进行数据提取,主要提取内容包括:①生物标志物;②发表时间;③研究类型;④研究现场;⑤样本量;⑥样本类型;⑦统计值。
结果1.文献检索与筛选:共检索到392篇文献,其中综述96篇,评论、报纸文章、信件等类型文献未检索到,阅读摘要后剔除无关的研究以及基础研究154篇,剔除有关脑脊液或脑组织的生物标志物以及其他神经影像学等技术研究文献101篇。阅读过程中通过引文追溯检索到与纳入排除标准相符合的文献2篇,一共纳入43篇HIV相关神经认知障碍的血液生物标志物研究[3-45]。
43篇文献包含14个队列研究和29个横断面研究,共报告了55个生物标志物。平均样本量为137例,最少为8例,最多为1 261例,≥200例样本量的队列研究仅有2个。其中,31个研究使用血浆,4个研究使用血清,1个研究需要从血浆中分离神经元来源的外泌体,6个研究需要分离外周血单核细胞,还有1个研究未做详细说明。43篇文献中,仅有6篇文献报告了生物标志物用于疾病诊断的灵敏度与特异度信息。
2.免疫激活与慢性炎症相关的生物标志物:共检索到21篇文献以及24个免疫激活及慢性炎症相关的生物标志物。其中,CD4+T淋巴细胞(CD4)计数的最低点、外周血单核细胞中HIV DNA载量、CD4/CD8比率、单核细胞计数(CCR2+MONO、CD14+CD16+CD163+MONO以及CD14+CD38+MONO)、新喋呤、β2-微球蛋白可以作为机体广泛免疫激活的生物标志物。单核细胞/巨噬细胞活化的标志物有CD163、sCD14、单核细胞趋化蛋白-1(MCP-1)、粒细胞集落刺激因子(G-CSF)、组织蛋白酶B、胱抑素B和胱抑素C。其他的炎性生物标志物还有白介素(IL)-6、IL-10、IL-16、IL-18、C反应蛋白(CRP)、干扰素诱导蛋白-10(IP-10)、肿瘤坏死因子α(TNF-α)、可溶性Ⅱ型肿瘤坏死因子结合蛋白(sTNFRⅡ)、肿瘤坏死因子诱导配体(TRAIL)、巨噬细胞炎性蛋白1β(MCP-1β)和单核细胞上趋化因子受体2(CCR2)。见表 1。其中,神经认知受损者血浆sCD163水平高于未受损者,差异有统计学意义(P=0.028),但在两次随访间,血浆sCD163水平的升高差异无统计学意义(P=0.500)[3]。在女性感染者中,血浆sCD14水平与认知状态相关,差异有统计学意义(r=0.366,P < 0.001),但在男性感染者中差异无统计学意义(r=-0.057,P=0.68)[4],对血浆新喋呤及sTNFRⅡ的研究也仅在女性中显示差异有统计学意义(P=0.020,P=0.008)[5]。此外,对单核细胞中组织蛋白酶和胱抑素的研究也仅局限于妇女,对其他人群还未有相关报告[6]。值得注意的是,Lyons等[7]的研究发现,当把血浆sCD14水平的界值定为2.6 μg/ml时可达到单一指标诊断疾病的最大预测准确度(特异度和灵敏度分别为0.78和0.60),如果再结合当前CD4计数,CD4计数最低点和血浆病毒载量将能更准确地预测神经认知障碍(ROC曲线面积由0.71上升到0.73)。Marcotte等[8]的研究也显示,结合两项指标(血浆sCD14和sTNFR-Ⅱ)诊断可获得0.96的灵敏度和0.68的特异度,当结合7项指标(血浆sCD14、sTNFR-Ⅱ、TNF-α、IP-10、MCP-1、SDF-1α、IL-6)进行诊断时,可以获得0.86的灵敏度和0.83的特异度。
3.脂质代谢和内皮功能紊乱相关的生物标志物:检索到的文献中共有9篇报告了15个脂质代谢及内皮功能紊乱相关的生物标志物。脂质标志物有TC、LDL-C、TG、脂联素、可溶性细胞相关胰岛素受体全长(sIR-αβ)和载脂蛋白E(apoE)。血管及内皮细胞功能紊乱的生物标志物有可溶性P-选择素(sCD62P)、纤维蛋白原、钙粒蛋白B(S100A9)、酪氨酸激酶受体-2(Tie-2),血管内皮生长因子(VEGF)和细胞间黏附分子5(sICAM-5)。此外,反映凝血功能障碍的促凝血素的升高和平均红细胞容量及平均红细胞血红蛋白等指标的改变也可以作为神经认知障碍的预测因子。见表 2。其中,对于TC、LDL-C、TG和脂联素的研究仅适用于MSM人群[9-10],对于sIR-αβ的研究仅适用于妇女[11],对于促凝血素的研究仅适用于老年人[12],对于sCD62P和纤维蛋白原的研究仅适用于围产期感染HIV的青少年和儿童[13],这些研究结果的外推性受到质疑。
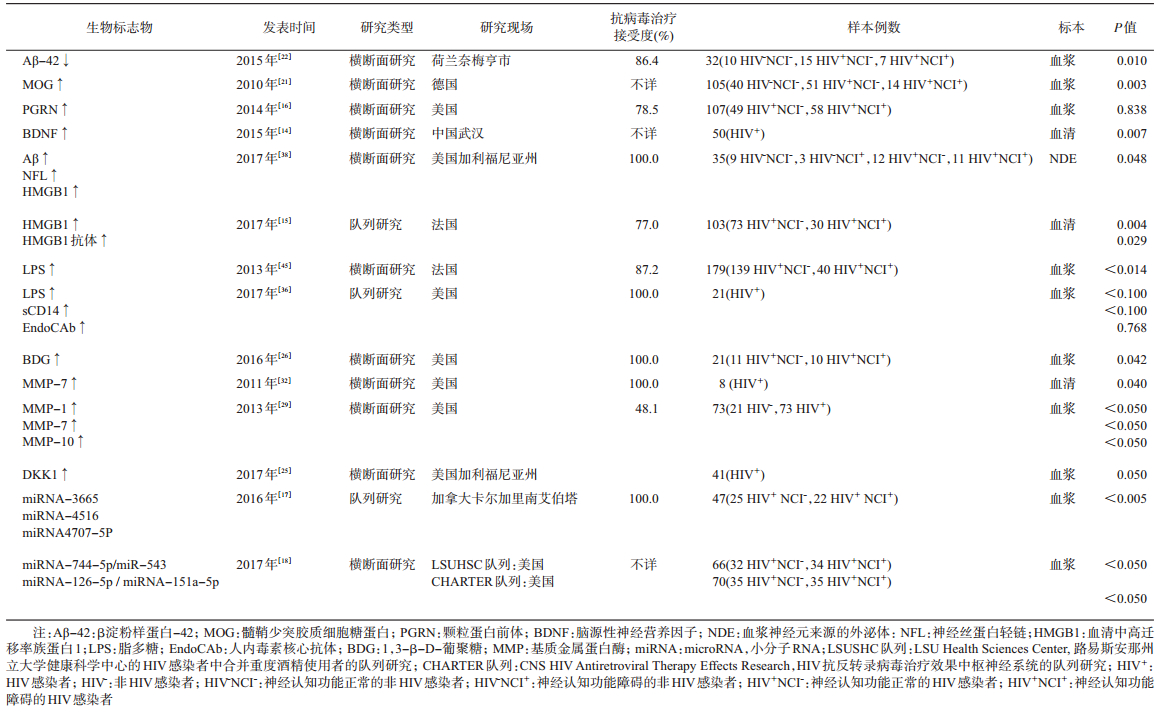
4.其他生物标志物:其他14篇文献中共报告了16个生物标志物。其中,神经损伤标志物有淀粉样蛋白(Aβ)、神经丝蛋白轻链(NFL)、颗粒蛋白前体(PGRN)、脑源性神经营养因子(BDNF)和髓鞘少突胶质细胞糖蛋白(MOG)。血浆Aβ42的降低、PGRN和MOG的升高分别反映神经元、轴突以及髓鞘的损伤。影响血脑屏障通透性的标志物有基质金属蛋白酶MMP-1、MMP-7、MMP-9和MMP-10;反映微生物易位的生物标志物有脂多糖(LPS)、人内毒素核心抗体(End℃Ab)和1,3-β-D-葡聚糖(BDG)。见表 3。值得注意的是,叶蓉和章军建[14]的研究发现血清BDNF水平预测神经认知功能受损的能力明显高于CD4计数和血浆病毒载量(ROC曲线下面积分别为0.74、0.61和0.61)。此外,Gougeon等[15]的研究显示,血清中高迁移率族蛋白1(HMGB1)及其抗体水平和血浆中的Dickkop-1(DKK1)也是预测神经认知障碍的良好指标。在所有HIV感染者中,检测血清HMGB1水平可以达到0.654的预测准确度(P=0.020);而在HIV RNA受抑制的成年人血浆中,以735 pg/ml为界值的DKK1可达到0.833的预测准确度[16]。最近,一些研究发现通过检测特定的miRNA可以区分HIV感染者神经认知功能正常与受损者。Asahchop等[17]的研究发现,检测miR-3665具有最高的预测价值(灵敏度和特异度分别为0.917和0.750)。而Wyczechowska等[18]在两个不同的队列中对miRNA的研究发现,在路易斯安那州立大学健康科学中心的HIV感染者中合并重度酒精使用者(来自LSUHSC队列)中,最高的阳性预测值0.83来自miR-744-5p/miR-543对(灵敏度和特异度都是0.800),在HIV抗反转录病毒治疗效果的中枢神经系统研究样本(来自CHARTER队列)中,最高的阳性预测值0.94来自miR-126-5p/miR-151a-5p对(灵敏度和特异度分别是0.800和0.970)。
HIV相关神经认知障碍一般认为是由于HIV感染诱导的免疫激活及炎症反应的继发作用和HIV直接的神经毒性作用共同导致的。HIV感染涉及的免疫激活直接诱导体内单核细胞/巨噬细胞的活化,单核细胞/巨噬细胞活化后附着于血管壁,诱导炎症介质、趋化因子分泌,从而引起慢性炎症,导致炎性标志物的水平升高,这些都是疾病进展并引发神经认知障碍的高危因素[46]。一方面,全身的慢性炎症和氧化应激反应增加了血脑屏障的通透性,促进单核细胞通过血脑屏障,继而通过谷氨酸代谢异常和钙离子紊乱等机制损伤中枢神经系统,导致神经元变性和胶质细胞过度活化。另一方面,炎症反应又能够诱导脂质物质的异常修饰,调控神经酰胺,鞘磷脂和胆固醇等的代谢,从而损伤微血管及内皮细胞,并且这些改变的脂质物质还能延续炎症过程[47-48]。其他可能涉及到的机制还有能量代谢紊乱、谷氨酸异常、微生物易位等。这些机制给了我们探索HIV感染者神经认知障碍生物标志物的方向,同时,相关生物标志物的发现也反过来指导了临床诊断和治疗并帮助我们进一步了解发病机制。
最近,新颖的脑成像技术以及在脑脊液和脑组织上发现的生物标志物的改变,均提示了可喜的研究进展[49-50]。但是,考虑到脑脊液采集的创伤性和脑成像技术昂贵的资源投入,这些技术在临床筛查神经认知障碍方面的实际应用均受到限制。值得注意的是,这些研究进展可以帮助我们在血液或尿液中发现更加适宜的生物标志物,从而更好地辅助临床诊断。
通过系统综述发现,血液中的生物标志物主要集中于免疫激活与慢性炎症以及血管损伤及内皮功能紊乱方面,这也证明了炎性机制和微血管病变在神经认知障碍发病机制中的重要作用。而对于脑脊液中经常发现的反映神经损伤的生物标志物在血液中研究较少或显示关联性不强,这提示脑脊液中强关联的生物标志物进入血液后可能已经有所改变,不能更好地反映神经系统的状态,因此很难作为疾病早期筛检的生物标志物,但可能是良好的疾病预后标志物[51-52]。
尽管对血液中生物标志物的检测有很多优点,例如方便快捷、成本低、易于被大众接受,但要将其作为临床辅助诊断与筛查技术仍然面临一些挑战[53-54]。轻微或早期的神经认知障碍很容易受毒品和烟酒滥用、营养状况、精神状态等混杂因素的干扰,尽管在统计分析中可以控制这些因素,但在任何给定的筛查人群中控制所有的混杂变量将十分困难。而且,现在收集到的研究大多是小样本量的横断面研究,控制混杂以及论证因果联系的能力不强。其次,当前研究基本局限于对单一生物标志物的检验,只有少数研究是通过结合多项指标进行筛查。因此,未来需要有大样本多中心研究来解决潜在的混杂因素的影响或者能够发现受这些因素影响较小的生物标志物。此外,多指标结合检测对神经认知障碍的诊断价值也需要有更多的研究和更大的样本量进行验证。
利益冲突: 无
| [1] |
Elbirt D, Mahlab-Guri K, Bezalel-Rosenberg S, et al. HIV-associated neurocognitive disorders (HAND)[J]. Isr Med Assoc J, 2015, 17(1): 54-59. |
| [2] |
宋凤丽, 张玉林, 乔录新, 等. 中国HIV-1感染人群神经认知损害初步筛查[J]. 首都医科大学学报, 2012, 33(5): 610-615. Song FL, Zhang YL, Qiao LX, et al. An initial screening for HIV-1 associated neurocognitive disorders in HIV-1 infected patients in China[J]. J Capit Med Univ, 2012, 33(5): 610-615. DOI:10.3969/j.issn.1006-7795.2012.05.011 |
| [3] |
Burdo TH, Weiffenbach A, Woods SP, et al. Elevated sCD163 in plasma but not cerebrospinal fluid is a marker of neurocognitive impairment in HIV infection[J]. AIDS, 2013, 27(9): 1387-1395. DOI:10.1097/QAD.0b013e32836010bd |
| [4] |
Royal WR, Cherner M, Burdo TH, et al. Associations between cognition, gender and monocyte activation among HIV infected individuals in Nigeria[J]. PLoS One, 2016, 11(2): e147182. DOI:10.1371/journal.pone.0147182 |
| [5] |
Krebs SJ, Slike BM, Sithinamsuwan P, et al. Sex differences in soluble markers vary before and after the initiation of antiretroviral therapy in chronically HIV-infected individuals[J]. AIDS, 2016, 30(10): 1533-1542. DOI:10.1097/QAD.0000000000001096 |
| [6] |
Cantres-Rosario Y, Plaud-Valentín M, Gerena Y, et al. Cathepsin B and cystatin B in HIV-seropositive women are associated with infection and HIV-1-assoCiated neurocognitive disorders[J]. AIDS, 2013, 27(3): 347-356. DOI:10.1097/QAD.0b013e32835b3e47 |
| [7] |
Lyons JL, Uno H, Ancuta P, et al. Plasma sCD14 is a biomarker associated with impaired neurocognitive test performance in attention and learning domains in HIV infection[J]. J Acquir Immune Defic Syndr, 2011, 57(5): 371-379. DOI:10.1097/QAI.0b013e3182237e54 |
| [8] |
Marcotte TD, Deutsch R, Michael BD, et al. A concise panel of biomarkers identifies neurocognitive functioning changes in HIV-infected individuals[J]. J Neuroimmune Pharmacol, 2013, 8(5): 1123-1135. DOI:10.1007/s11481-013-9504-2 |
| [9] |
Lake JE, Vo QT, Jacobson LP, et al. Adiponectin and interleukin-6, but not adipose tissue, are associated with worse neurocognitive function in HIV-infected men[J]. Antivir Ther, 2015, 20(2): 235-244. DOI:10.3851/IMP2952 |
| [10] |
Mukerji SS, LocasCIo JJ, Misra V, et al. Lipid profiles and APOE4 allele impact midlife cognitive decline in HIV-infected men on antiretroviral therapy[J]. Clin Infect Dis, 2016, 63(8): 1130-1139. DOI:10.1093/CId/CIw495 |
| [11] |
Gerena Y, Skolasky RL, Velez JM, et al. Soluble and cell-associated insulin receptor dysfunction correlates with severity of HAND in HIV-infected women[J]. PLoS One, 2012, 7(5): e37358. DOI:10.1371/journal.pone.0037358 |
| [12] |
Montoya JL, Iudicello J, Oppenheim HA, et al. Coagulation imbalance and neurocognitive functioning in older HIV-positive adults on suppressive antiretroviral therapy[J]. AIDS, 2017, 31(6): 787-795. DOI:10.1097/QAD.0000000000001404 |
| [13] |
Kapetanovic S, Leister E, Nichols S, et al. Relationships between markers of vascular dysfunction and neurodevelopmental outcomes in perinatally HIV-infected youth[J]. AIDS, 2010, 24(10): 1481-1491. DOI:10.1097/QAD.0b013e32833a241b |
| [14] |
叶蓉, 章军建. HIV相关神经认知障碍患者中血清神经营养因子水平的变化研究[C].第四届全国痴呆与认知障碍学术研讨会及高级讲授班论文汇编.北京: 中华医学会, 中华医学会神经病学分会: 2015: 1. Ye R, Zhang JJ. Research on changes of serum neurotrophic factors in patients with HIV-associated neurocognitive disorders[C]. The fourth national symposium on dementia and cognitive impairment and compilation of papers for advanced lectures. Beijing: Chinese Medical Association, Chinese Society of Neurology, 2015: 1. |
| [15] |
Gougeon ML, Poirier-Beaudouin B, Durant J, et al. HMGB1/anti-HMGB1 antibodies define a molecular signature of early stages of HIV-Associated Neurocognitive Isorders (HAND)[J]. Heliyon, 2017, 3(2): e00245. DOI:10.1016/j.heliyon.2017.e00245 |
| [16] |
Yu C, Seaton M, Letendre S, et al. Plasma dickkopf-related protein 1, an antagonist of the Wnt pathway, is associated with HIV-associated neurocognitive impairment[J]. AIDS, 2017, 31(10): 1379-1385. DOI:10.1097/QAD.0000000000001481 |
| [17] |
Asahchop EL, Akinwumi SM, Branton WG, et al. Plasma microRNA profiling predicts HIV-associated neurocognitive disorder[J]. AIDS, 2016, 30(13): 2021-2031. DOI:10.1097/QAD.0000000000001160 |
| [18] |
Wyczechowska D, Lin HY, LaPlante A, et al. A miRNA signature for cognitive deficits and alcohol use disorder in persons living with HIV/AIDS[J]. Front Mol Neurosci, 2017, 10: 385. DOI:10.3389/fnmol.2017.00385 |
| [19] |
Kusao I, Shiramizu B, Liang CY, et al. Cognitive performance related to HIV-1-infected monocytes[J]. J Neuropsychiatry Clin Neurosci, 2012, 24(1): 71-80. DOI:10.1176/appi.neuropsych.11050109 |
| [20] |
Yuan L, Liu A, Qiao LX, et al. The relationship of CSF and plasma cytokine levels in HIV infected patients with neurocognitive impairment[J]. Biomed Res Int, 2015, 2015: 506872. DOI:10.1155/2015/506872 |
| [21] |
Lackner P, Kuenz B, Reindl M, et al. Antibodies to myelin oligodendrocyte glycoprotein in HIV-1 associated neurocognitive disorder:a cross-sectional cohort study[J]. J Neuroinflammat, 2010, 7: 79. DOI:10.1186/1742-2094-7-79 |
| [22] |
Mothapo KM, Stelma F, Janssen M, et al. Amyloid beta-42(Aβ-42), neprilysin and cytokine levels. A pilot study in patients with HIV related cognitive impairments[J]. J Neuroimmunol, 2015, 282: 73-79. DOI:10.1016/j.jneuroim.2015.03.017 |
| [23] |
Williams DW, Byrd D, Rubin LH, et al. CCR2 on CD14+CD16+ monocytes is a biomarker of HIV-associated neurocognitive disorders[J]. Neurol Neuroimmunol Neuroinflamm, 2014, 1(3): e36. DOI:10.1212/NXI.0000000000000036 |
| [24] |
Sattler FR, He JX, Letendre S, et al. Abdominal obesity contributes to neurocognitive impairment in HIV-infected patients with increased inflammation and immune activation[J]. J Acquir Immune Defic Syndr, 2015, 68(3): 281-288. DOI:10.1097/QAI.0000000000000458 |
| [25] |
Suh HS, Lo Y, Choi N, et al. Evidence of the innate antiviral and neuroprotective properties of progranulin[J]. PLoS One, 2014, 9(5): e98184. DOI:10.1371/journal.pone.0098184 |
| [26] |
Hoenigl M, de Oliveira MF, Pérez-Santiago J, et al. (1->3)-β-D-Glucan levels correlate with neurocognitive functioning in HIV-infected persons on suppressive antiretroviral therapy:a cohort study[J]. Medicine (Baltimore), 2016, 95(11): e3162. DOI:10.1097/MD.0000000000003162 |
| [27] |
Ndhlovu LC, D'Antoni ML, Ananworanich J, et al. Loss of CCR2 expressing non-classical monocytes are associated with cognitive impairment in antiretroviral therapy-naïve HIV-infected Thais[J]. J Neuroimmunol, 2015, 288: 25-33. DOI:10.1016/j.jneuroim.2015.08.020 |
| [28] |
Ragin AB, Wu Y, Ochs R, et al. Biomarkers of neurological status in HIV infection:a 3-year study[J]. Proteomics Clin Appl, 2010, 4(3): 295-303. DOI:10.1002/prca.200900083 |
| [29] |
Li SY, Wu Y, Keating SM, et al. Matrix metalloproteinase levels in early HIV infection and relation to in vivo brain status[J]. J Neurovirol, 2013, 19(5): 452-460. DOI:10.1007/s13365-013-0197-3 |
| [30] |
Cohen RA, De La Monte S, Gongvatana A, et al. Plasma cytokine concentrations associated with HIV/hepatitis C coinfection are related to attention, executive and psychomotor functioning[J]. J Neuroimmunol, 2011, 233(1/2): 204-210. DOI:10.1016/j.jneuroim.2010.11.006 |
| [31] |
Okafor CN, Kelso NE, Bryant V, et al. Body mass index, inflammatory biomarkers and neurocognitive impairment in HIV-infected persons[J]. Psychol Health Med, 2017, 22(3): 289-302. DOI:10.1080/13548506.2016.1199887 |
| [32] |
Ragin AB, Wu Y, Ochs R, et al. Serum matrix metalloproteinase levels correlate with brain injury in human immunodeficiency virus infection[J]. J Neurovirol, 2009, 15(3): 275-281. DOI:10.1080/13550280902913271 |
| [33] |
Kamat A, Ravi V, Desai A, et al. Estimation of virological and immunological parameters in subjects from South India infected with human immunodeficiency virus type 1 clade C and correlation of findings with occurrence of neurological disease[J]. J Neurovirol, 2009, 15(Suppl 1): 25-35. DOI:10.1080/13550280802338652 |
| [34] |
Monnig MA, Kahler CW, Cioe PA, et al. Markers of microbial translocation and immune activation predict cognitive processing speed in heavy-drinking men living with HIV[J]. Microorganisms, 2017, 5(4): E64. DOI:10.3390/microorganisms5040064 |
| [35] |
Sakoda ME, Fazeli PL, Ellis RJ, et al. Higher cystatin C levels are associated with neurocognitive impairment in Older HIV+ adults[J]. J Acquir Immune Defic Syndr, 2017, 74(3): 243-249. DOI:10.1097/QAI.0000000000001235 |
| [36] |
Montoya JL, Iudicello J, Fazeli PL, et al. Elevated markers of vascular remodeling and arterial stiffness are associated with neurocognitive function in older HIV+ adults on suppressive antiretroviral therapy[J]. J Acquir Immune Defic Syndr, 2017, 74(2): 134-141. DOI:10.1097/QAI.0000000000001230 |
| [37] |
Fabbiani M, Muscatello A, Perseghin P, et al. Brief report:peripheral monocyte/macrophage phenotypes associated with the evolution of cognitive performance in HIV-infected patients[J]. J Acquir Immune Defic Syndr, 2017, 76(2): 219-224. DOI:10.1097/QAI.0000000000001480 |
| [38] |
Sun B, Dalvi P, Abadjian L, et al. Blood neuron-derived exosomes as biomarkers of cognitive impairment in HIV[J]. AIDS, 2017, 31(14): F9-F17. DOI:10.1097/QAD.0000000000001595 |
| [39] |
Yuan L, Wei FL, Zhang X, et al. Intercellular adhesion molecular-5 as marker in HIV associated neurocognitive disorder[J]. Aging Dis, 2017, 8(3): 250-256. DOI:10.14336/AD.2016.0918 |
| [40] |
Kallianpur AR, Wang Q, Jia PL, et al. Anemia and red blood cell indices predict HIV-associated neurocognitive impairment in the highly active antiretroviral therapy era[J]. J Infect Dis, 2016, 213(7): 1065-1073. DOI:10.1093/infdis/jiv754 |
| [41] |
Vassallo M, Fabre R, Durant J, et al. A decreasing CD4/CD8 ratio over time and lower CSF-penetrating antiretroviral regimens are associated with a higher risk of neurocognitive deterioration, independently of viral replication[J]. J Neurovirol, 2017, 23(2): 216-225. DOI:10.1007/s13365-016-0490-z |
| [42] |
Colon K, Perez-Laspiur J, Quiles R, et al. Macrophage secretome from women with HIV-associated neurocognitive disorders[J]. Proteomics Clin Appl, 2016, 10(2): 136-143. DOI:10.1002/prca.201400203 |
| [43] |
Muñoz-Moreno JA, Fumaz CR, Ferrer MJ, et al. Nadir CD4 cell count predicts neurocognitive impairment in HIV-infected patients[J]. AIDS Res Hum Retroviruses, 2008, 24(10): 1301-1307. DOI:10.1089/aid.2007.0310 |
| [44] |
Rubin LH, Benning L, Keating SM, et al. Variability in C-reactive protein is associated with cognitive impairment in women living with and without HIV:a longitudinal study[J]. J Neurovirol, 2018, 24(1): 41-51. DOI:10.1007/s13365-017-0590-4 |
| [45] |
Vassallo M, Dunais B, Durant J, et al. Relevance of lipopolysaccharide levels in HIV-associated neurocognitive impairment:the Neuradapt study[J]. J Neurovirol, 2013, 19(4): 376-382. DOI:10.1007/s13365-013-0181-y |
| [46] |
Burdo TH, Lackner A, Williams KC. Monocyte/macrophages and their role in HIV neuropathogenesis[J]. Immunol Rev, 2013, 254(1): 102-113. DOI:10.1111/imr.12068 |
| [47] |
Levine AJ, Panos SE, Horvath S. Genetic, transcriptomic, and epigenetic studies of HIV-associated neurocognitive disorder[J]. J Acquir Immune Defic Syndr, 2014, 65(4): 481-503. DOI:10.1097/QAI.0000000000000069 |
| [48] |
Spudich SS, Ances BM. Central nervous system complications of HIV infection[J]. Top Antivir Med, 2011, 19(2): 48-57. |
| [49] |
Haughey NJ, Zhu XM, Bandaru VVR. A biological perspective of CSF lipids as surrogate markers for cognitive status in HIV[J]. J Neuroimmune Pharmacol, 2013, 8(5): 1136-1146. DOI:10.1007/s11481-013-9506-0 |
| [50] |
Masters MC, Ances BM. Role of neuroimaging in HIV-associated neurocognitive disorders[J]. Semin Neurol, 2014, 34(1): 89-102. DOI:10.1055/s-0034-1372346 |
| [51] |
Ortega M, Ances BM. Role of HIV in amyloid metabolism[J]. J Neuroimmune Pharmacol, 2014, 9(4): 483-491. DOI:10.1007/s11481-014-9546-0 |
| [52] |
Cassol E, Misra V, Morgello S, et al. Applications and limitations of inflammatory biomarkers for studies on neurocognitive impairment in HIV infection[J]. J Neuroimmune Pharmacol, 2013, 8(5): 1087-1097. DOI:10.1007/s11481-013-9512-2 |
| [53] |
Beck SE, Queen SE, Witwer KW, et al. Paving the path to HIV neurotherapy:predicting SIV CNS disease[J]. Eur J Pharmacol, 2015, 759: 303-312. DOI:10.1016/j.ejphar.2015.03.018 |
| [54] |
Lista S, Faltraco F, Hampel H. Biological and methodical challenges of blood-based proteomics in the field of neurological research[J]. Prog Neurobiol, 2013, 101-102: 18-34. DOI:10.1016/j.pneurobio.2012.06.006 |
 2018, Vol. 39
2018, Vol. 39