文章信息
- 张萌, 龙遗芳, 郭莉敏, 吴崧霖, 方苓, 杨芬, 李晖, 黄琼, 孙立梅.
- Zhang Meng, Long Yifang, Guo Limin, Wu Songlin, Fang Ling, Yang Fen, Li Hui, Huang Qiong, Sun Limei.
- 广东省2013-2017年3种基因型诺如病毒感染暴发疫情的流行特征
- Epidemiological characteristics of outbreaks of norovirus-GⅡ.2, GⅡ.17 and GⅡ.4/Sydney in Guangdong province, 2013-2017
- 中华流行病学杂志, 2018, 39(9): 1210-1215
- Chinese Journal of Epidemiology, 2018, 39(9): 1210-1215
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2018.09.013
-
文章历史
收稿日期: 2018-02-22
2. 511430 广州, 广东省疾病预防控制中心广东省现场流行病学培训项目;
3. 511430 广州, 广东省疾病预防控制中心病原微生物检验所;
4. 511430 广州, 广东省疾病预防控制中心公共卫生应急部;
5. 511515 清远市清城区疾病预防控制中心;
6. 518118 深圳市坪山新区疾病预防控制中心
2. Guangdong Field Epidemiology Training Program, Guangdong Provincial Center for Disease Control and Prevention, Guangzhou 511430, China;
3. Institute of Pathogenic Microbiology, Guangdong Provincial Center for Disease Control and Prevention, Guangzhou 511430, China;
4. Department of Public Health Emergency, Guangdong Provincial Center for Disease Control and Prevention, Guangzhou 511430, China;
5. Qingyuan Qingcheng District of Center for Disease Control and Prevention, Qingyuan 511515, China;
6. Shenzhen Pingshan New District of Center for Disease Control and Prevention, Shenzhen 518118, China
诺如病毒属于杯状病毒科,感染人体后可导致急性胃肠炎表现,是非细菌性感染性腹泻暴发的主要病原体[1]。诺如病毒感染引起的急性胃肠炎具有传播途径多、传播速度快、涉及范围广等特点。该病毒通过突变和重组机制能够快速发生变异,有研究认为重组变异是导致诺如病毒在人群中持续暴发流行的最重要原因[2]。近年来,诺如病毒感染暴发疫情呈现逐步上升趋势,已成为广东省乃至全国较为重要的公共卫生问题,但国内外对于诺如病毒暴发疫情特点,特别是不同病毒基因型引起暴发疫情特点总结分析的研究较少。广东省于2008年开始全面开展诺如病毒感染暴发疫情监测,2012年开始对诺如病毒开展基因分型。本研究对2013-2017年广东省诺如病毒感染暴发疫情进行分析,了解诺如病毒GⅡ.2、GⅡ.17和GⅡ.4/Sydney 3种基因型引起暴发疫情的特点,为疫情防控提供科学依据。
对象与方法1.资料来源:2013年1月1日至2017年11月30日,广东省各级CDC通过“突发公共卫生事件报告管理信息系统”报告的诺如病毒感染暴发疫情。暴发疫情报告标准为:7 d内,同一学校、托幼机构、医疗机构、养老院、工厂、建筑工地、游轮、社区/村庄等集体单位或场所,发生≥20例有流行病学关联的诺如病毒感染病例,其中至少2例是实验室诊断病例。按照《广东省诺如病毒感染性腹泻预防控制工作指引》的要求调查并收集相关资料,包括涉疫单位一般情况、病例搜索和个案调查、相关因素如食品卫生、水卫生、环境卫生及个人防护等情况。上述疫情报告及信息收集方法自2012年开始执行,至2017年11月期间未进行调整。
2.诺如病毒感染病例定义:
(1)疑似病例:24 h内出现排便≥3次且有性状改变(呈稀水样便),和/或24 h内出现呕吐者。
(2)临床诊断病例:在诺如病毒感染引起的暴发疫情中,满足疑似病例定义,且与实验室诊断病例有流行病学关联的病例。
(3)实验室诊断病例:疑似病例或临床诊断病例中,粪便、肛拭子或呕吐物标本经诺如病毒核酸检测阳性者。其中,临床诊断病例和实验室诊断病例纳入暴发疫情病例统计。
3.导致暴发疫情的病毒基因型别判定:每起暴发疫情,均要求采集病例发病3 d内的粪便、肛拭子或呕吐物标本;若病例数为<20例则全部采集,病例数≥20例则至少采集20例病例标本;经病原学检测,至少2例病例标本检出诺如病毒核酸阳性且无其他感染性腹泻病原体检出,可判定为诺如病毒感染暴发疫情。阳性标本经基因测序,结果均为同一型别,或虽有≥2种型别检出,但其中某种型别的比例>75.00%,可判定为该种基因型别诺如病毒感染暴发疫情;若有≥2种型别检出,但其中某种型别的比例<75.00%,则认为是混合感染。
4.传播途径判定:诺如病毒感染暴发的传播途径包括食源性、水源性和接触传播,其中食源性传播的判断依据主要为病例具有共同进餐史,分析发现可疑暴露因素为某食物/某餐次,或食品加工人员发病且发病时间早于其他病例至少1个潜伏期,排除水源性和单纯接触传播等;水源性传播的判断依据主要为病例空间分布与污染水源、管网分布一致或从有流行病学关联的饮水中检出诺如病毒核酸,排除食源性和单纯接触传播;接触传播的判断依据主要为病例具有明确的班级、宿舍、车间等空间聚集特点,续发病例与首发病例的发病时间间隔大约为一个平均潜伏期,排除食源性和水源性传播的可能。诺如病毒传播力强,在食源性或水源性传播疫情发生后常继发接触传播疫情,但本文着重分析不同基因型别的疫情特点,因此仅考虑主要的传播模式,继发的接触传播将不进行分析。
5.采样和检测:每起暴发疫情均采集病例粪便、肛拭子、呕吐物标本、水样标本等,进行样品处理后,采用QIAGEN QIAamp Vir al RNA Mini Kit(德国QIAGEN公司)试剂盒提取病毒RNA,提取方法按照试剂说明书。采用实验室自备以及商业化诺如病毒核酸检测试剂盒进行检测。应用G2SKF/G2SKR引物对诺如病毒阳性的疫情标本进行RT-PCR检测-1,每起暴发疫情挑选1~4份扩增效果最好的产物进行基因测序。用Qiagen PCR产物纯化试剂盒(德国QIAGEN公司)纯化,再采用单向PCR引物和Bigdye 3.1测序反应试剂盒(美国Applied Bio systems公司)完成测序反应,产物纯化后直接在ABI PRISMR 3100测序仪上进行测序。将剔除引物序列的毒株序列与GenBank中的序列进行BLAST比较。
6.直接标准化法:已知各暴发场所中3种基因型呕吐和腹泻的发生比例,因此选用直接标准化法。以某暴发场所中3种基因型病例合计数作为标准人数,利用公式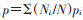
7.统计学分析:采用Excel 2010软件录入和数据整理,描述分析,采用SPSS 19.0软件进行χ2检验,以P<0.05判断差异有统计学意义,双侧检验。
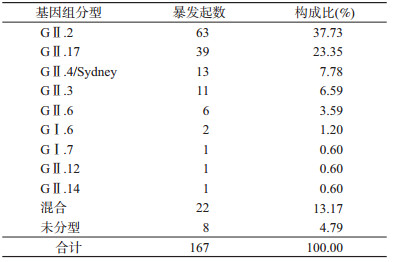
结果1.暴发疫情情况:2013年1月1日至2017年11月30日,广东省累计报告诺如病毒感染暴发疫情167起。疫情涉及病例数20~679例,罹患率为0.03%~31.62%。疫情主要发生在每年10月至次年3月,见图 1。暴发疫情共涉及9种病毒基因型,其中GⅠ型2种、GⅡ型7种;GⅡ.2(63起)、GⅡ.17(39起)引起的暴发疫情最多,另有22起为混合感染,8起未能确认型别,见表 1。GⅡ.2、GⅡ.17和GⅡ.4/Sydney 3种基因型别分别引起2012-2013、2014-2015和2016-2017年冬春季的3波流行季的大部分暴发疫情,其余年度则为多种基因型同时存在,见图 1。3种基因型别共涉及115起暴发疫情,暴发疫情涉及病例数20~282例,罹患率为0.87%~4.12%,3种基因型别暴发疫情的罹患率差异无统计学意义(χ2=16.35,P=0.36)。

|
| 图 1 2013-2017年广东省各基因型诺如病毒感染暴发疫情时间分布 |
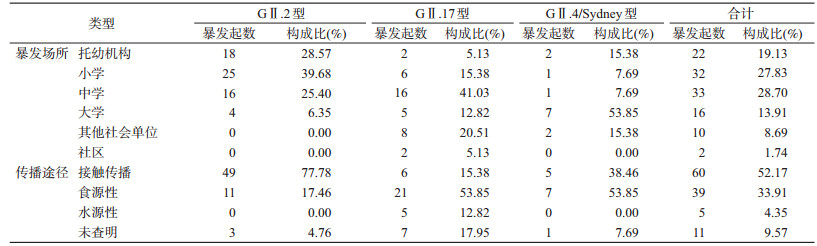
2.暴发场所分析:115起暴发疫情中,中学发生33起(占28.70%)、小学32起(占27.83%)、托幼机构22起(占19.13%)、大学16起(占13.91%)、其他社会单位10起(占8.69%)、社区2起(占1.74%)。GⅡ.2型引起的暴发疫情中,小学占39.68%(25/63)、托幼机构占28.57%(18/63)、中学占25.40%(16/63),大学占6.35%(4/63),其他社会单位和社区无疫情报告;GⅡ.17型引起的暴发疫情中,中学暴发疫情占41.03%(16/39)、其他社会单位占20.51%(8/39)、小学占15.38%(6/39)、大学占12.82%(5/39)、社区和托幼机构各占5.13%(2/39);GⅡ.4/Sydney型引起的暴发疫情中,大学占53.85%(7/13)、托幼机构和其他社会单位各占15.38%(2/13)、小学和中学各占7.69%(1/13),无社区疫情报告。3种型别暴发场所之间的差异有统计学意义(χ2=53.46,P<0.01)。见表 2。
3.传播途径分析:115起暴发疫情中,单纯接触传播60起(占52.17%)、食源性传播39起(占33.91%)、水源性传播5起(占4.35%)、未查明传播途径11起(占9.57%)。GⅡ.2型引起的暴发疫情中,接触传播占77.78%(49/63)、食源性传播占17.46%(11/63)、无水源性传播疫情、未查明原因占4.76%(3/63);GⅡ.17型引起的暴发疫情中,食源性传播占53.85%(21/39)、接触传播占15.38%(6/39)、水源性传播占12.82%(5/39)、未查明原因占17.95%(7/39);GⅡ.4/Sydney型引起的暴发疫情中,食源性传播占53.85%(7/13)、接触传播占38.46%(5/13)、无水源性传播疫情、未查明原因占7.69%(1/13)。3种型别传播途径之间的差异有统计学意义(χ2=47.72,P<0.01)。见表 2。
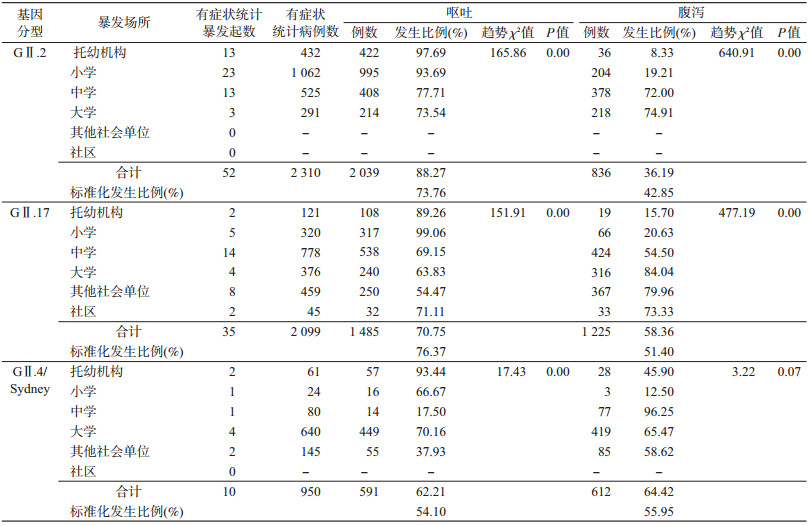
4.呕吐和腹泻症状分析:115起暴发疫情中,97起疫情记录了5 085例病例的呕吐和腹泻症状。总体上呕吐发生比例为17.50%~100.00%,平均76.79%;腹泻发生比例为1.92%~100.00%,平均49.88%。3种基因型别引起的暴发疫情中,呕吐症状均呈现随年龄增加,发生比例降低的趋势,差异均有统计学意义;腹泻除GⅡ.4/Sydney型外,其余2种基因型均呈随年龄增加,发生比例增加的趋势。见表 3。为消除暴发场所(年龄)构成不同所造成的影响,采用直接标准化计算各基因型呕吐和腹泻的标准化发生比例,GⅡ.2型的标准化呕吐比例为73.76%、腹泻比例为42.85%;GⅡ.17型的标准化呕吐比例为76.37%、腹泻比例为51.40%;GⅡ.4/Sydney型的标准化呕吐比例为54.10%、腹泻比例为55.95%;3个型别呕吐发生比例之间的差异有统计学意义(χ2=730.79,P<0.01)、腹泻发生比例之间的差异也有统计学意义(χ2=189.61,P<0.01)。见表 3。
本研究对2013-2017年广东省115起由GⅡ.2、GⅡ.17和GⅡ.4/Sydney 3种基因型别引起的诺如病毒感染暴发疫情分析,发现3种基因型引起的暴发疫情在暴发场所和传播途径上各有不同:GⅡ.2型主要涉及小学、托幼机构和中学,以接触传播为主;GⅡ.17型主要涉及中学和其他社会单位,以食源性传播为主;GⅡ.4/Sydney型主要涉及大学,食源性传播比例最高,接触传播也有较高比例。
国内外有较多文献报道GⅡ.17和GⅡ.4/Sydney型诺如病毒引起中小学、大学、工厂公司、养老院等集体单位暴发疫情,饮水和食物被污染引起为主,偶有接触传播报道[3-13],也有文献报道GⅡ.2型诺如病毒通过密闭环境内暴露于病例呕吐物造成的暴发疫情[14];杨芬等[15]对2008-2015年广东省诺如病毒感染暴发疫情危险因素的分析也发现,小学和幼儿园以接触传播疫情为主,工厂企业、大学和中学等以食源性传播疫情为主,提示传播方式与人群年龄相关。本研究与上述国内外的各种相关研究结果基本一致。但通过文献检索尚未发现有其他总结性分析不同基因型引起暴发疫情特点的文献报道。
本研究发现,广东省的诺如病毒感染暴发疫情呈现不同基因型病毒对人群年龄似乎有选择性,GⅡ.4/Sydney型主要感染成年人,而GⅡ.2和GⅡ.17型主要感染未成年人群,其中GⅡ.2型感染的人群年龄较GⅡ.17型更低。国外有研究提出,人群对不同病毒基因型的易感性与基因型的流行和变异有关,成年人易通过感染经常发生突变的基因型别(如GⅡ.4/Sydney型)发病,GⅡ.2和GⅡ.17型则属于相对稳定的基因型,较少感染成年人,而未成年人在免疫力发育完全之前,会持续感染各种基因型别[16]。该研究结论从一定程度上解释了我们的分析结果,但广东省2014-2015年冬春季流行的GⅡ.17型和2016-2017年冬春季流行的GⅡ.2型均为已发生变异的病毒[17-18],成年人病例的比例依然较低,目前已有的研究结果尚无法解释该现象。
诺如病毒感染成年人主要表现为腹泻症状,感染儿童主要表现为呕吐症状[19],本研究得出类似结果。通过直接标准化可以看出,GⅡ.2和GⅡ.17型引起的症状分布较近似,呕吐比例均高于70%,但GⅡ.2型主要通过接触(包括呕吐物)传播,而GⅡ.17型通过接触传播的比例很低;GⅡ.4/Sydney型呕吐比例明显低于前述2种型别,接触传播的比例却要明显高于GⅡ.17型。这种传播特点除了年龄因素外,是否还受其他因素的影响?国内外有研究表明,人体对诺如病毒的易感性与体内表达的HBGA受体有一定的关系[20-23]。是否因不同人群体内表达了针对不同基因型别诺如病毒的HBGA受体,造成人群对病毒易感性的差异,从而影响传播途径,目前的研究结果尚不足以解释,需要针对多种基因型别诺如病毒继续开展人群HBGA受体表达和其对病毒易感性影响的研究。
本研究存在局限性。研究采用暴发疫情数据来分析诺如病毒症状和传播途径,与疾病本身的症状谱和传播方式可能会有不同。本研究在定义食源性和水源性疫情时,未考虑其后续发生的接触传播。本研究只对达到暴发疫情标准的事件进行分析,未掌握规模较小的疫情的特点,分析诺如疫情特点时存在一定的选择偏倚。
综上所述,诺如病毒不同基因型别引起的暴发疫情特点不同:GⅡ.2型主要涉及小学、托幼机构和中学,以接触传播为主;GⅡ.17型主要涉及中学和其他社会单位,以食源性传播为主;GⅡ.4/Sydney型主要涉及大学,食源性传播比例最高,接触传播也有较高比例。
利益冲突: 无
| [1] |
Atmar RL, Estes MK. The epidemiologic and clinical importance of norovirus infection[J]. Gastroenterol Clin North Am, 2006, 35(2): 275-290. DOI:10.1016/j.gtc.2006.03.001 |
| [2] |
靳淼, 孙军玲, 常昭瑞, 等. 中国2006-2007年诺如病毒胃肠炎暴发及其病原学特征分析[J]. 中华流行病学杂志, 2010, 31(5): 549-553. Jin M, Sun JL, Chang ZR, et al. Outbreaks of noroviral gastroenteritis and their molecular characteristics in China, 2006-2007[J]. Chin J Epidemiol, 2010, 31(5): 549-553. DOI:10.3760/cma.j.issn.0254-6450.2010.05.017 |
| [3] |
da Silva Ribeiro de Andrade J, Fumian TM, Leite JPG, et al. Norovirus GⅡ.17 associated with a foodborne acute gastroenteritis outbreak in Brazil, 2016[J]. Food Environ Virol, 2018, 10(2): 212-216. DOI:10.1007/s12560-017-9326-0 |
| [4] |
Cheng HY, Hung MN, Chen WC, et al. Ice-associated norovirus outbreak predominantly caused by GⅡ.17 in Taiwan, 2015[J]. BMC Public Health, 2017, 17: 870. DOI:10.1186/s12889-017-4869-4 |
| [5] |
Sanchez MA, Corcostégui SP, de Broucker CA, et al. Norovirus GⅡ.17 outbreak linked to an infected post-symptomatic food worker in a French military unit located in France[J]. Food Environ Virol, 2017, 9(2): 234-237. DOI:10.1007/s12560-016-9274-0 |
| [6] |
Chen MY, Chen WC, Chen PC, et al. An outbreak of norovirus gastroenteritis associated with asymptomatic food handlers in Kinmen, Taiwan[J]. BMC Public Health, 2016, 16: 372. DOI:10.1186/s12889-016-3046-5 |
| [7] |
Qin M, Dong XG, Jing YY, et al. A waterborne gastroenteritis outbreak caused by Norovirus GⅡ.17 in a Hotel, Hebei, China, December 2014[J]. Food Environ Virol, 2016, 8(3): 180-186. DOI:10.1007/s12560-016-9237-5 |
| [8] |
Cho HG, Lee SG, Lee MY, et al. An outbreak of norovirus infection associated with fermented oyster consumption in South Korea, 2013[J]. Epidemiol Infect, 2016, 144(13): 2759-2764. DOI:10.1017/S0950268816000170 |
| [9] |
Zhou N, Zhang H, Lin X, et al. A waterborne norovirus gastroenteritis outbreak in a school, eastern China[J]. Epidemiol Infect, 2016, 144(6): 1212-1219. DOI:10.1017/S0950268815002526 |
| [10] |
Zheng QM, Zeng HT, Dai CW, et al. Epidemiological investigation of a norovirus GⅡ.4 Sydney outbreak in a China elder care facility[J]. Jpn J Infect Dis, 2015, 68(1): 70-74. DOI:10.7883/yoken.JJID.2014.081 |
| [11] |
Polkowska A, Rönnqvist M, Lepistö O, et al. Outbreak of gastroenteritis caused by norovirus GⅡ.4 Sydney variant after a wedding reception at a resort/activity centre, Finland, August 2012[J]. Epidemiol Infect, 2014, 142(9): 1877-1883. DOI:10.1017/S0950268813002847 |
| [12] |
Maritschnik S, Kanitz EE, Simons E, et al. A food handler-associated, foodborne norovirus GⅡ.4 Sydney 2012-outbreak following a wedding dinner, Austria, October 2012[J]. Food Environ Virol, 2013, 5(4): 220-225. DOI:10.1007/s12560-013-9127-z |
| [13] |
Zhou X, Li H, Sun L, et al. Epidemiological and molecular analysis of a waterborne outbreak of norovirus GⅡ.4[J]. Epidemiol Infect, 2012, 140(12): 2282-2289. DOI:10.1017/S0950268812000374 |
| [14] |
Zhang TL, Lu J, Ying L, et al. An acute gastroenteritis outbreak caused by GⅡ.2 norovirus associated with airborne transmission via the air conditioning unit in a kindergarten in Lianyungang, China[J]. Int J Infect Dis, 2017, 65: 81-84. DOI:10.1016/j.ijid.2017.10.003 |
| [15] |
杨芬, 孙立梅, 李晖, 等. 广东省2008-2015年诺如病毒感染暴发的危险因素分析[J]. 中华流行病学杂志, 2017, 38(7): 906-910. Yang F, Sun LM, Li H, et al. Analysis on risk factors for norovirus outbreaks in Guangdong province, 2008-2015[J]. Chin J Epidemiol, 2017, 38(7): 906-910. DOI:10.3760/cma.j.issn.0254-6450.2017.07.012 |
| [16] |
Parra GI, Squires RB, Karangwa CK, et al. Static and evolving norovirus genotypes:implications for epidemiology and immunity[J]. PLoS Pathog, 2017, 13(e1006136). DOI:10.1371/journal.ppat.1006136 |
| [17] |
Lu J, Sun LM, Fang L, et al. Gastroenteritis outbreaks caused by norovirus GⅡ.17, Guangdong Province, China, 2014-2015[J]. Emerg Infect Dis, 2015, 21(7): 1240-1242. DOI:10.3201/eid2107.150226 |
| [18] |
Lu J, Fang L, Sun LM, et al. Association of GⅡ.P16-GⅡ.2 recombinant norovirus strain with increased norovirus outbreaks, Guangdong, China, 2016[J]. Emerg Infect Dis, 2017, 23(7): 1188-1190. DOI:10.3201/eid2307.170333 |
| [19] |
Heymann DL. Control of communicable diseases manual[M]. 20th ed. Washington, D. C. : American Public Health Association, 2014.
|
| [20] |
Zhang XF, Huang Q, Long Y, et al. An outbreak caused by G Ⅱ.17 norovirus with a wide spectrum of HBGA-associated susceptibility[J]. Sci Rep, 2015, 5: 17687. DOI:10.1038/srep17687 |
| [21] |
Yang Y, Xia M, Tan M, et al. Genetic and phenotypic characterization of G Ⅱ-4 noroviruses that circulated during 1987 to 2008[J]. J Virol, 2010, 84(18): 9595-9607. DOI:10.1128/JVI.02614-09 |
| [22] |
Dai YC, Hu GF, Zhang XF, et al. Molecular epidemiology of norovirus gastroenteritis in children in Jiangmen, China, 2005-2007[J]. Arch Virol, 2011, 156(9): 1641-1646. DOI:10.1007/s00705-011-1010-3 |
| [23] |
Dai YC, Zhang XF, Xia M, et al. Antigenic relatedness of norovirus GⅡ.4 variants determined by human challenge sera[J]. PLoS One, 2015, 10(4): e0124945. DOI:10.1371/journal.pone.0124945 |
 2018, Vol. 39
2018, Vol. 39