文章信息
- 张娜, 刘慧鑫, 康殿民, 汪宁.
- Zhang Na, Liu Huixin, Kang Dianmin, Wang Ning.
- 临床结局观察性研究中的领先时间偏倚及控制
- Lead time bias and its control in observational studies for clinical outcomes
- 中华流行病学杂志, 2018, 39(5): 700-703
- Chinese Journal of Epidemiology, 2018, 39(5): 700-703
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2018.05.032
-
文章历史
收稿日期: 2017-10-10
2. 250014 济南, 山东省疾病预防控制中心艾滋病防制所;
3. 100044 北京大学人民医院
2. Institute for AIDS Control and Prevention, Shandong Provincial Center for Disease Control and Prevention, Jinan 250014, China;
3. Peking University People's Hospital, Beijing 100044, China
观察性研究(observational studies)又称非实验性研究(non-experimental study),是流行病学研究的重要组成部分,该研究方法不对研究对象施加任何外部干预而获得事实材料。研究者按照疾病自然史进行研究,探索和检验暴露因素和结局之间的因果关联,为评价检测、治疗等干预措施或其他暴露因素的作用提供信息[1-2]。以具有多个临床结局的疾病为研究内容时,由于不能人为设置处理因素,同时受试对象接受何种处理因素或同一处理因素的不同水平不是随机而定,使得临床结局观察性研究中可能存在领先时间偏倚,比如已为熟知的评价筛检诊断实验对肿瘤患者生存期影响的研究或探讨危险因素的研究[3-4]。HIV感染后的疾病自然史存在多个病程,HIV感染者和艾滋病患者(HIV/AIDS)的诊断时间、高效抗反转录病毒治疗(highly active antiretroviral therapy,HAART)开始的时间也不一致,基于观察性研究评价HAART对HIV/AIDS生存时间的影响作用时也存在领先时间偏倚,但在许多HAART效果评价的研究中忽视该问题或数据分析时人为排除某些研究对象从而导致无法准确评估HAART与HIV/AIDS生存时间真实的因果关系[5-6]。为此,笔者在复习筛检诊断试验中的领先时间偏倚概念及控制方法基础上,主要阐述HAART对HIV/AIDS生存时间影响评价中的领先时间偏倚的概念、产生原因及控制方法。
一、领先时间及领先时间偏倚概念1.评价筛检诊断试验与研究结局因果关系时,领先时间是指从筛检诊断发现到临床诊断发现所赢得的时间;这个时间差往往被解释为因筛检而延长的生存时间,这种表面上延长的生存时间,实际上是筛检导致诊断时间提前所致的偏倚,即领先时间偏倚[7]。比如,在评价早筛查对结局(如预后)的影响时,患者在筛检时被及时发现,其生存期从筛检之日算起,即使措施无效,也会因确诊时间的领先而出现上述病例的生存期长于出现临床症状后被确诊病例的生存期的假象。领先时间偏倚常发生于评价早筛查等干预措施对慢性病(如肿瘤或癌症)患者生存时间作用的研究中[3-4, 8]。
2.评价HAART与HIV/AIDS生存结局的因果关系时,领先时间是指接受治疗较晚的HIV/AIDS在治疗前的生存时间,即CD4+T淋巴细胞(CD4细胞)从高水平数值进展为低水平(治疗基线水平)的时间,由于忽略这段生存时间而导致的偏倚即为领先时间偏倚。从另一角度理解,HIV/AIDS从较高基线CD4细胞水平开始接受HAART,即使HAART无效,也会因治疗时间的提前而出现生存时间长于治疗基线CD4细胞水平低的HIV/AIDS的假象,这种表面上延长的生存时间,实际上是HIV/AIDS自身疾病进程的时间却被解释为因提前治疗而延长的生存时间,从而高估HAART效果。比如,在其他基本条件类似的前提下,治疗基线CD4细胞为100个/mm3的HIV/AIDS患者生存时间比治疗基线CD4细胞为500个/mm3患者的生存时间要短。评价HAART对HIV/AIDS生存结局的作用效果时,不同治疗基线CD4细胞水平的HIV/AIDS比较生存时间,由于提前治疗而延长的生存时间必须考虑。HAART效果评价中领先时间偏倚见图 1。

|
| 图 1 HAART效果评价中领先时间偏倚示例 |
1.筛检诊断试验效果评价中,领先时间偏倚产生的根本原因是由于肿瘤或癌症等慢性病自然史具有多个阶段,通过筛检诊断试验,在其自然史的早期且未出现临床症状前,提前做出了诊断。
2. HAART效果评价中领先时间偏倚产生的根本原因是以下一个或多个因素共同作用导致HIV/AIDS启动HAART时的基线CD4细胞水平不同而致。
(1)HIV感染自然史有多个分期:包括急性感染期、无症状感染期和艾滋病期;无症状感染期又分CD4细胞>500个/mm3和200个/mm3<CD4<500个/mm3两个阶段,艾滋病期又分50个/mm3<CD4<200个/mm3和CD4<50个/mm3(终末期)两个阶段;受宿主和病毒双重因素的影响,每个HIV/AIDS具有不同的自然史[9]。
(2)HAART标准的调整:HAART通过抑制个体体内HIV的复制,延长HIV/AIDS的生存时间[10]。自20世纪90年代中期HAART技术应用以来,越来越多HIV/AIDS从中受益,截至2016年,全球接受HAART人数约为1 820万人[11]。2005年在《国家免费艾滋病抗病毒治疗手册》(《手册》)[12]指导下,我国将HAART入选标准定为CD4细胞计数<200个/mm3,2008年在《手册》指导下,HAART入选标准定为CD4细胞计数<350个/mm3;2012年开始对CD4细胞计数<500个/mm3的HIV/AIDS提供HAART服务;在“治疗即预防”策略指导下,2016年不再考虑CD4细胞计数,在知情同意前提下,HIV/AIDS均可接受HAART服务,由此全面进入HAART时代。截至2015年底,全国累计治疗HIV/AIDS47.7万例,正在治疗38.7万例[13]。由于治疗标准调整,HIV/AIDS治疗基线CD4细胞水平发生变化,2008年前接受HAART的基线CD4细胞计数<200个/mm3占64.8%,2012-2013年降为43.6%[6]。
(3)HIV/AIDS接受HAART服务的概率不同:扩大治疗前,HIV/AIDS的CD4细胞数值满足治疗条件才可接受HAART服务;扩大治疗后,接受HAART服务是知情后的自愿选择,基于伦理,不能拒绝HIV/AIDS接受HAART服务的机会,也有部分HIV/AIDS拒绝治疗直到CD4细胞数值很低、出现临床症状或机会性感染后才愿意接受服务,因此导致不同HIV/AIDS启动HAART的基线CD4细胞水平差异较大。CD4细胞是影响HIV/AIDS疾病进程的重要因素[14],综合以上分析,在评价HAART对HIV/AIDS生存结局的作用效果时,必须考虑由于基线CD4细胞水平不同而导致的领先时间偏倚(Lead time bias)。
三、领先时间偏倚的控制目前,对领先时间偏倚的控制方法研究主要集中在数据分析阶段,如分层分析法和参数模型估算法。
1.分层分析法:是控制领先时间偏倚的一种简单有效分析方法,可按照不同基线CD4细胞水平分组进行分析评价。但在分析多个影响因素时,过多的分层会导致数据信息的利用减弱从而影响结果推论。
2.参数模型估算法:该方法的基本原理是利用参数模型估算领先时间,将估算的领先时间从观察生存时间中减掉或增补到观察生存时间中从而实现控制领先时间偏倚的目的。
(1)删除领先时间:筛检诊断试验作用评价中,Duffy等[15]建议从生存时间或观察时间中去除因早诊断/早治疗产生的领先时间从而达到控制其对研究结果造成的偏倚。该团队利用指数模型模拟肿瘤无症状且可被筛检发现至出现临床症状的时间,即领先时间E(s)。观察期内出现结局事件的研究对象的领先时间分布为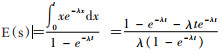

(2)增补领先时间:HAART效果评价中,研究者建议将估算的领先时间增补到延迟组的观察生存时间上从而达到控制其对研究结果造成的偏倚。Ahdieh-Grant等[16]运用MACS和WIHS两个纵向HIV/AIDS队列数据研究判断HIV/AIDS接受HAART的最佳时机时[17-18],建议将CD4从高值降至治疗基线水平的变化进程所用时间作为领先时间。该研究将HAART开始时基线CD4细胞在350~499个/mm3的HIV/AIDS为及时治疗组;介于200~349个/mm3为延迟治疗1组,<200个/mm3为延迟治疗2组。从延迟治疗组HIV/AIDS治疗前所有介于350~499个/mm3的CD4细胞数值中随机选择1次作为随访起始时间,计算该次CD4检测至出现结局事件或截尾事件的时间作为校正领先时间偏倚后的生存时间,包括随机选择的CD4检测时间至治疗基线CD4水平经过的时间(领先时间)和HAART开始至结局或截尾事件出现经过的时间(观察的随访时间)。控制领先时间偏倚后,与及时治疗组相比,延迟1组的HIV/AIDS发病风险无差异(RR=1.05,95%CI:0.52~2.13);而延迟2组发病风险增加(RR=2.68,95%CI:1.40~5.14)。
上述研究方法要求队列随访质量较高。尽管MACS和WIHS两个队列中[17-18],所有HIV/AIDS每半年定期接受CD4检测服务,CD4<200个/mm3的HIV/AIDS每3个月定期随访,失访仍然是队列研究不可避免的问题。Cole等[19]提出用多重填补法(multiple imputation,MI)估算领先时间[20]。该研究用参数分布模型模拟HAART实施前自然状态下[21-22],从第一次CD4检测到CD4下降至治疗标准最上限的时间分布及在这个过程中进展为AIDS或死亡的概率,广义γ分布模拟领先时间分布;在拟合分布基础上,MI法计算产生全部数据,其中计算得到的领先时间补充在延迟治疗组的观察生存时间上,使之与及时治疗组具有可比性从而达到控制领先时间偏倚的目的。研究结果显示,未控制领先时间偏倚,治疗基线CD4<200个/mm3的HIV/AIDS临床发病风险是介于201~350个/mm3的2.71倍(RR=2.71,95%CI:1.62~4.54);控制领先时间偏倚后,前者临床发病风险是后者的1.97倍(RR=1.97,95%CI:1.09~3.54),发病风险下降27%。MI法解决了观察性队列研究缺失数值的问题。该方法可适用于结局事件为临床发病、死亡或病毒学失败等的研究;为难以实现随机化的观察性队列研究提供较为理想的控制领先时间偏倚的方法;在能够实现随机化的研究中,该方法也可使随机设计研究结果与观察性研究结果具有可比性。
Wada等[23]综合了上述两种方法,对HAART前CD4细胞检测数据完整详细的,随机选择1次CD4检测日期作为随访开始时间;CD4细胞检测数据缺失的,通过MI计算HAART前的人时作为领先时间。控制领先时间偏倚后,各组HIV/AIDS死于AIDS相关和无关疾病的风险均较控制前降低;而治疗基线CD4>500个/mm3的HIV/AIDS与未感染HIV人群死于非AIDS相关风险无差异(Hazard Ratio,HR=1.01,95%CI:0.72~1.43)。该结果从另一角度证明了在评价HAART对HIV/AIDS的作用时存在领先时间偏倚。
四、结论尽管领先时间偏倚常用于评价筛检诊断试验对肿瘤患者生存时间的作用;但笔者认为,当观察性研究所研究的疾病(如结核、高血压、糖尿病等)存在多个疾病进程或分期的情况下,评价检测、治疗等干预措施时,考虑到研究对象处于不同的起始病程或分期,均可能存在领先时间偏倚,因此,必须考虑并控制领先时间偏倚才能得到真实的暴露因素和结局之间的因果关系。本文通过详细阐述在评价HAART对HIV/AIDS生存时间的影响研究中领先时间偏倚的识别及控制方法,旨在为其他类似研究提供思路和方法。
利益冲突: 无
| [1] | Grimes DA, Schulz KF. An overview of clinical research:the lay of the land[J]. Lancet, 2002, 359(9300): 57–61. DOI:10.1016/S0140-6736(02)07283-5 |
| [2] |
王波, 詹思延. 如何撰写高质量的流行病学研究论文:第一讲观察性流行病学研究报告规范——STROBE介绍[J]. 中华流行病学杂志, 2006, 27(6): 547–549.
Wang B, Zhan SY. How to write high quality dissertation on epidemiology:the first section:Introduction of STROBE for observational epidemiological study[J]. Chin J Epidemiol, 2006, 27(6): 547–549. DOI:10.3760/j.issn:0254-6450.2006.06.020 |
| [3] | Facciorusso A, Ferrusquía J, Muscatiello N. Lead time bias in estimating survival outcomes[J]. Gut, 2016, 65(3): 538–539. DOI:10.1136/gutjnl-2015-310199 |
| [4] | Jansen RJ, Alexander BH, Anderson KE, et al. Quantifying lead-time bias in risk factor studies of cancer through simulation[J]. Ann Epidemiol, 2013, 23(11): 735–741. DOI:10.1016/j.annepidem.2013.07.021 |
| [5] | Zhang FJ, Dou ZH, Ma Y, et al. Effect of earlier initiation of antiretroviral treatment and increased treatment coverage on HIV-related mortality in China:a national observational cohort study[J]. Lancet Infect Dis, 2011, 11(7): 516–524. DOI:10.1016/s1473-3099(11)70097-4 |
| [6] |
曾亮, 马烨, 豆智慧, 等. 我国艾滋病抗病毒治疗标准调整前后治疗病人生存情况研究[J]. 中国艾滋病性病, 2016, 22(7): 488–492.
Zeng L, Ma Y, Dou ZH, et al. Study on the survival of adult HIV/AIDS patients received antiretroviral therapy before and after the adjustment of enrollment criteria[J]. Chin J AIDS STD, 2016, 22(7): 488–492. DOI:10.13419/j.cnki.aids.2016.07.02 |
| [7] |
李立明. 流行病学[M]. 6版. 北京: 人民卫生出版社, 2007: 178–179.
Li LM.Epidemiology[M]. Sixth edition. Beijing: People's Medical Publishing House, 2007: 178–179. |
| [8] | Liu R, Gaskins JT, Mitra R, et al. A Review of Estimation of Key Parameters and Lead Time in Cancer Screening[J]. Revista Colombiana De Estadistica, 2017, 40(2): 263. DOI:10.15446/rce.v40n2.60642 |
| [9] |
王陇德. 艾滋病学[M]. 北京: 北京出版社, 2009: 12–293.
Wang LD.AIDS[M]. Beijing: Beijing Publishing House, 2009: 12–293. |
| [10] | Thaker HK, Snow MH. HIV viral suppression in the era of antiretroviral therapy[J]. Postgrad Med J, 2003, 79(927): 36–42. DOI:10.1136/pmj.79.927.36 |
| [11] | World Health Organization. Progress report 2016: prevent HIV, test and treat all-WHO support for country impact[EB/OL]. (2017-10-01)[2017-11-01]. http://www.who.int/hiv/pub/progressreports/2016-progress-report/en/. |
| [12] |
《国家免费艾滋病抗病毒药物治疗手册》编写组. 国家免费艾滋病抗病毒药物治疗手册[M]. 1版, 2版, 3版, 4版. 北京: 人民卫生出版社, 2005, 2008, 2012, 2016.
The Ministry of Health AIDS Clinical Expert Working Group.China's free ART manual[M]. 1st ed, 2nd ed, 3rd ed, 4th ed. Beijing: People's Medical Publishing House, 2005, 2008, 2012, 2016. |
| [13] |
中国疾病预防控制中心, 性病艾滋病预防控制中心, 性病控制中心. 2015年12月全国艾滋病性病疫情及主要防治工作进展[J]. 中国艾滋病性病, 2016, 22(2): 69.
NCAIDS, NCSTD, China CDC. Update on the AIDS/STD epidemic in China and main response in control and prevention in December, 2015[J]. Chin J AIDS STD, 2016, 22(2): 69. DOI:10.13419/j.cnki.aids.2016.02.01 |
| [14] | Egger M, May M, Chêne G, et al. Prognosis of HIV-1-infected patients starting highly active antiretroviral therapy:a collaborative analysis of prospective studies[J]. Lancet, 2002, 360(9327): 119–129. DOI:10.1016/S0140-6736(02)09411-4 |
| [15] | Duffy SW, Nagtegaal ID, Wallis M, et al. Correcting for lead time and length bias in estimating the effect of screen detection on cancer survival[J]. Am J Epidemiol, 2008, 168(1): 98–104. DOI:10.1093/aje/kwn120 |
| [16] | Ahdieh-Grant L, Yamashita TE, Phair JP, et al. When to initiate highly active antiretroviral therapy:a cohort approach[J]. Am J Epidemiol, 2003, 157(8): 738–746. DOI:10.1093/aje/kwg036 |
| [17] | Kaslow RA, Ostrow DG, Detels R, et al. The multicenter AIDS cohort study:rationale, organization, and selected characteristics of the participants[J]. Am J Epidemiol, 1987, 126(2): 310–318. DOI:10.1093/aje/126.2.310 |
| [18] | Barkan SE, Melnick SL, Preston-Martin S, et al. The women's interagency HIV study[J]. Epidemiology, 1998, 9(2): 117–125. DOI:10.1097/00001648-199803000-00004 |
| [19] | Cole SR, Li R, Anastos K, et al. Accounting for leadtime in cohort studies:evaluating when to initiate HIV therapies[J]. Stat Med, 2004, 23(21): 3351–3363. DOI:10.1002/sim.1579 |
| [20] | Consortium WTS, Sterne JA, May M, et al. Timing of initiation of antiretroviral therapy in AIDS-free HIV-1-infected patients:a collaborative analysis of 18 HIV cohort studies[J]. Lancet, 2009, 373(9672): 1352–1363. DOI:10.1016/S0140-6736(09)60612-7 |
| [21] | Veugelers PJ, Cornelisse PGA, Craib KJP, et al. Models of survival in HIV infection and their use in the quantification of treatment benefits[J]. Am J Epidemiol, 1998, 148(5): 487–496. DOI:10.1093/oxfordjournals.aje.a009674 |
| [22] | Muñoz A, Xu JN. Models for the incubation of AIDS and variations according to age and period[J]. Stat Med, 1996, 15(21/22): 2459–2473. DOI:10.1002/(SICI)1097-0258(19961130)15:22<2459::AID-SIM464>3.0.CO;2-Q |
| [23] | Wada N, Jacobson LP, Cohen M, et al. Cause-specific mortality among HIV-infected individuals, by CD4+ cell count at HAART initiation, compared with HIV-uninfected individuals[J]. AIDS, 2014, 28(2): 257–265. DOI:10.1097/QAD.0000000000000078 |
 2018, Vol. 39
2018, Vol. 39


