文章信息
- 秦帅, 段然, 景怀琦, 王鑫.
- Qin Shuai, Duan Ran, Jing Huaiqi, Wang Xin.
- 我国2010-2014年不同城乡类型地区细菌性腹泻病原谱的流行特征
- Etiology of bacterial diarrhea in large cities, mid-sized/small cities and rural areas of China
- 中华流行病学杂志, 2018, 39(5): 651-655
- Chinese Journal of Epidemiology, 2018, 39(5): 651-655
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2018.05.021
-
文章历史
收稿日期: 2017-10-18
感染性腹泻是我国重要的公共卫生问题之一,每年我国约有7 000万感染性腹泻患者[1]。细菌、病毒和寄生虫均可引起感染性腹泻。在我国夏季多发生细菌性腹泻。同时有研究指出细菌是发展中国家感染性腹泻的主要病原体[2-4]。我国大型城市和传统农村经济水平、居民生活环境和卫生习惯均有显著差异。此外我国存在大量中小城镇与城乡过渡带,这部分地区经济水平、居民生活环境和卫生习惯与大型城市和传统农村均不相同。不同经济水平、卫生条件、卫生习惯地区引起感染性腹泻的主要细菌病原谱排序存在差异[5-8]。目前我国鲜有覆盖多个省市城乡全年龄组人群细菌性腹泻的比较研究。为此在2010-2014年对我国17省份进行感染性腹泻病原学监测,比较不同城乡类型地区细菌性腹泻病原谱的流行特征。
资料与方法1.病例来源:2010-2014年通过传染病重大专项传染病监测技术平台在北京、河南、宁夏、四川、甘肃、安徽、云南、广西、山东、江苏、海南、贵州、江西、青海、上海、山西、湖南17个省份进行基于腹泻症候群的感染性腹泻病原学监测。病例纳入标准为因急性腹泻就诊的门/急诊病例,同时采集粪便标本并进行包括基本人口学信息、临床症状特征等个案调查。急性腹泻病例参照WHO关于急性腹泻的定义,即每日排便≥3次,大便性状有改变,且在发病14 d内就诊者。本文病例排除标准为非急性腹泻的就诊、住院病例或腹泻>14 d的病例。
2.病例类型:将传染病监测技术平台的289家医院逐个进行人工识别,确定医院类型,并将腹泻病例按照就诊医院类型分为:①大型城市病例(选择在直辖市、省会城市三甲医院或中心城区其他医院就诊病例);②传统农村病例(选择乡镇卫生院、村卫生室就诊病例);③中小城镇/城乡过渡带病例(选择在大型城市周边区/县、小型城市、城镇医院、卫生院等就诊病例)。
3.标本采集及病原学检测:根据文献[9]方法对采集的新鲜粪便标本进行17种细菌包括沙门菌、志贺菌,5种致泻性大肠埃希菌[肠产毒性大肠埃希菌(ETEC)、肠黏附聚集性大肠埃希菌(EAggEC)、肠致病性大肠埃希菌(EPEC)、肠侵袭性大肠埃希菌(EIEC)、产志贺毒素大肠埃希菌(STEC)],致病性弧菌(霍乱弧菌、副溶血弧菌、河弧菌、拟态弧菌),致病性耶尔森菌(小肠结肠炎耶尔森菌、假结核耶尔森菌),弯曲菌(空肠弯曲菌、结肠弯曲菌),嗜水气单胞菌及类志贺邻单胞菌分离培养。吸取无菌容器中10 g/10 ml粪便接种于沙门-志贺平板与麦康凯平板,直接分离志贺菌和致泻性大肠埃希菌;使用分型血清对分离到的志贺菌属进行血清分群(痢疾志贺菌、福氏志贺菌、鲍氏志贺菌、宋内志贺菌);使用PCR扩增疑似致泻性大肠埃希菌的毒力基因进行5种致泻性大肠埃希菌分类;将粪便标本分别接种亚硒酸两绿磺胺増菌肉汤(selenite brilliant green sulfa enrichment broth)、耶尔森菌改良增菌液(peptone sorbitol bile broth)、碱性蛋白胨水、Skirrow选择性培养基增菌后,分别接种科玛嘉沙门菌显色培养基、耶尔森菌选择性平板、硫代硫酸盐-枸橼酸盐-胆汁酸盐-蔗糖平板及哥伦比亚血平板分离沙门菌、小肠结肠炎耶尔森菌和假结核耶尔森菌、霍乱弧菌、副溶血弧菌、河弧菌、拟态弧菌、嗜水单胞菌和类志贺邻单胞菌、空肠弯曲菌和结肠弯曲菌。
病原体检测依托于全国腹泻症候群病原学监测网络。该监测网络由中国CDC监测中心实验室、各监测省份的省CDC检测实验室和各哨点医院组成。监测中心实验室负责对各省CDC检测实验室的技术培训、指导及检测结果复核、定期盲法抽样考核和对疑似标本检测。各检测实验室按统一方案并使用相同仪器、试剂检测。
4.统计学分析:比较分析3种类型病例细菌感染阳性率和病原谱,应用非条件logistic回归分析(以每种病原菌是否感染为因变量,季节、性别、年龄、城乡类型为自变量)中小城镇/城乡过渡带、传统农村病例相对于大型城市病例感染各病原菌的风险。以P<0.05为差异有统计学意义。
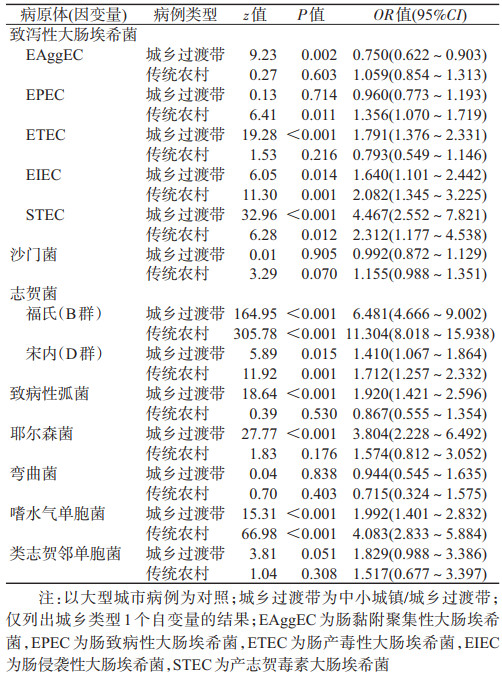
结果1.不同城乡类型病例病原菌阳性率比较:共纳入分析急性腹泻病例28 074例,其中大型城市病例9 253例,传统农村病例5 138例,中小城镇/城乡过渡带病例13 683例。不同城乡类型病例腹泻病原菌阳性率顺位存在较大差异(表 1)。大型城市病例前4位分别是沙门菌(4.55%)、EAggEC(2.88%)、EPEC(1.89%)和志贺菌(1.46%)。中小城镇/城乡过渡带病例感染率首位仍为沙门菌,且与大型城市病例相近;而志贺菌感染升至第2位,阳性率达到4.09%,是大型城市的近3倍;其中福氏志贺菌阳性率是大型城市的6倍;此外,嗜水气单胞菌阳性率也比大型城市高1倍。传统农村地区病例志贺菌感染升至首位,阳性率达7.51%,其中福氏志贺菌阳性率为5.81%,比中小城镇/城乡过渡带的阳性率增长1倍;嗜水气单胞菌阳性率为2.14%,约是大型城市的4倍多。3种类型病例阳性率差异最大的为福氏志贺菌、嗜水气单胞菌,病原菌阳性率依照大型城市、中小城镇/城乡过渡带、传统农村病例呈阶梯式上升。
2.不同城乡类型腹泻病例感染病原菌风险比较:以大型城市为对照,沙门菌、弯曲菌、类志贺邻单胞菌感染的风险在3种地区间差异无统计学意义;中小城镇/城乡过渡带病例相对于大型城市病例感染EPEC风险的差异无统计学意义,但传统农村病例是大型城市病例的1.356倍;传统农村病例相对于大型城市病例感染EAggEC、ETEC、致病性弧菌、耶尔森菌风险的差异无统计学意义,但中小城镇/城乡过渡带病例相对于大型城市病例感染风险差异有统计学意义,其中中小城镇/城乡过渡带病例感染致病性弧菌风险是大型城市病例的1.920倍,感染耶尔森菌风险是大型城市病例的3.804倍。3种城乡类型病例感染EIEC、福氏志贺菌、宋内志贺菌、嗜水气单胞菌的风险从高到低排序均为传统农村病例、中小城镇/城乡过渡带病例、大型城市病例,其中感染风险差异最大的为福氏志贺菌和嗜水气单胞菌。中小城镇/城乡过渡带病例、传统农村病例相对大型城市病例感染福氏志贺菌风险的OR值及其95%CI分别为6.481(4.666~9.002)、11.304(8.018~15.938),感染嗜水气单胞菌风险的OR值及其95%CI分别为1.992(1.401~2.832)、4.083(2.833~5.884)。见表 2。
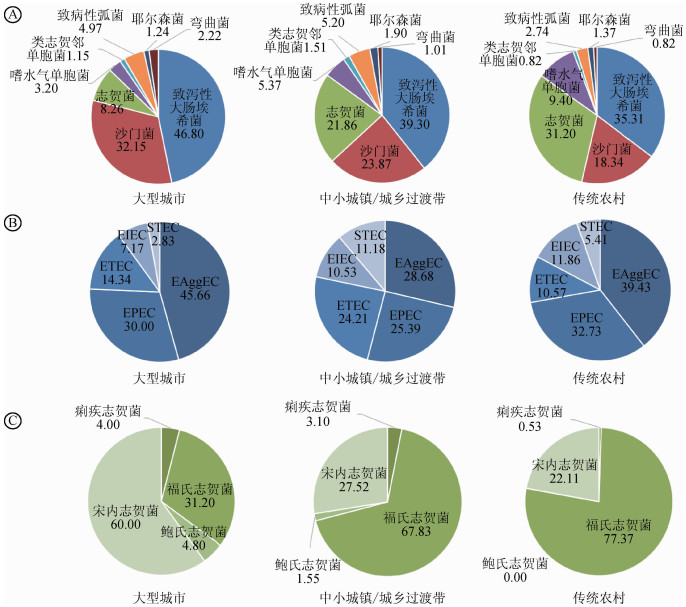
3.不同城乡类型腹泻病例病原谱比较:大型城市病例中有7 259例,中小城镇/城乡过渡带病例中有8 857例,传统农村病例中有4 651例进行了所有致病菌(志贺菌、耶尔森菌、致泻性大肠埃希菌、沙门菌、致病性弧菌、嗜水气单胞菌、类志贺邻单胞菌、弯曲菌)检测。对病原谱进行分析发现:大型城市病例病原谱中致泻性大肠埃希菌(46.80%)、沙门菌(32.15%)所占比例较大,另2类型病例病原谱均为致泻性大肠埃希菌、沙门菌、志贺菌所占比例较大;志贺菌、嗜水气单胞菌所占比例按大型城市病例、中小城镇/城乡过渡带病例、传统农村病例依次升高;致泻性大肠埃希菌、沙门菌所占比例按大型城市病例、中小城镇/城乡过渡带病例、传统农村病例依次降低;其他病原菌无递增递减趋势(图 1A)。3种城乡类型病例中5类致泻性大肠埃希菌所占比例排序一致,由高至低依次为EAggEC、EPEC、ETEC、EIEC、STEC(图 1B),且志贺菌血清型构成比的差异较大。其中大型城市病例中所占比例居前2位的依次为宋内志贺菌(60.00%)、福氏志贺菌(31.20%);中小城镇/城乡过渡带病例和传统农村病例占比例最大的则为福氏志贺菌,其次为宋内志贺菌,而传统农村病例两者差异更为明显(图 1C)。
|
| 注:EAggEC为肠黏附聚集性大肠埃希菌,EPEC为肠致病性大肠埃希菌,ETEC为肠产毒性大肠埃希菌,EIEC为肠侵袭性大肠埃希菌,STEC为产志贺毒素大肠埃希菌 图 1 2010-2014年我国3种城乡类型地区腹泻病例细菌性病原谱(A)、5类致泻性大肠埃希菌(B)和志贺菌血清型(C)构成比(%)比较 |
本次分析发现我国3种城乡类型细菌性腹泻病例的流行特点存在差异,且传统农村病例腹泻病原谱与非洲、南亚国家的腹泻病原谱较为相似,其中志贺菌感染占比例较高[3-4, 9],而大型城市病例腹泻病原谱与发达国家报道较为相似,以致泻性大肠埃希菌、沙门菌为主[9-11]。
分析显示3种类型地区细菌性腹泻病原谱构成差异最为显著的是福氏志贺菌,传统农村病例检出率是大型城市病例的10余倍。志贺菌群构成中,大型城市病例宋内志贺菌的比例明显高于福氏志贺菌,而传统农村的构成比则相反,福氏志贺菌比例明显高于宋内志贺菌。与以往报道我国经济发展水平较高地区宋内志贺菌的比例高于福氏志贺菌相一致[12]。另有相关研究报道,经济较落后地区腹泻儿童粪便标本福氏志贺菌检出率为64.95%,宋内志贺菌检出率为24.22%,而发达地区腹泻儿童粪便标本中志贺菌群中仅能检出宋内志贺菌[13]。
分析还显示嗜水气单胞菌阳性率、感染风险、病原谱构成比中都呈现传统农村病例、中小城镇/城乡过渡带病例、大型城市病例依次降低的趋势,具有明显的城乡差异。先前相关研究也曾报道,经济较落后地区腹泻儿童粪便标本中嗜水气单胞菌阳性率明显高于发达地区[13]。提示嗜水气单胞菌也可作为一种指示当地卫生水平的致泻病原菌,同时也提示应加强对农村地区嗜水气单胞菌的监测力度。近年来已有多国学者认为可将气单胞菌纳入感染性腹泻病原菌范畴[14-15],而在我国该病原菌尚未受到重视,临床检查也未列入感染性腹泻病原菌范畴。根据本文结果建议将嗜水气单胞菌也纳入感染性腹泻的病原检测范围内。
本文表明感染性腹泻与当地社会经济发展水平相关。与大型城市腹泻病例相比,中小城镇/城乡过渡带和传统农村腹泻病例病原菌感染阳性率>1%的病原菌种类均较多;3种城乡类型病例感染EIEC、福氏志贺菌、宋内志贺菌、嗜水气单胞菌的风险均随城市化程度的升高而降低,致泻性大肠埃希菌、沙门菌、志贺菌和嗜水气单胞菌感染在细菌性腹泻病原谱构成上也存在明显城乡差异。
综上所述,我国不同城镇化水平地区细菌性腹泻病原谱流行特征存在明显差异,病原谱构成也有不同,差异最为显著的为福氏志贺菌和嗜水气单胞菌,其检出率均随城镇化、经济发达程度的上升而下降;传统农村病例腹泻病原谱与非洲、南亚国家腹泻病原谱较为相似,而大型城市病例腹泻病原谱与发达国家相近,在腹泻病防控中应采取针对性的防控策略。
利益冲突: 无
| [1] | Zhang SX, Yang CL, Gu WP. Case-control study of diarrheal disease etiology in individuals over 5 years in southwest China[J]. Gut Pathog, 2016, 8: 58. DOI:10.1186/s13099-016-0141-1.eCollection2016 |
| [2] | Saeed A, Abd H, Sandstrom G. Microbial aetiology of acute diarrhoea in childrenunder five years of age in Khartoum, Sudan[J]. J Med Microbiol, 2015, 64: 432–437. DOI:10.1099/jmm.0.000043 |
| [3] | Shrivastava1 AK, Kumar1 S, Mohakud NK, et a1. Multiple etiologies of infectious diarrhea and concurrent infections in a pediatric outpatient-based screening study in Odisha, India[J]. Gut Pathog, 2017, 9: 16. DOI:10.1186/s13099-017-0166-0 |
| [4] | Nhampossa T, Mandomando I, Acacio S, et al. Diarrheal disease in rural Mozambique:burden, risk factors and etiology of diarrheal disease among children aged 0-59 months seeking care at health facilities[J]. PLoS One, 2015, 10(5): e0119824. DOI:10.1371/journal.pone.0119824 |
| [5] | Pinzón-Rondón AM, Zárate-Ardila C, Hoyos-Martínez A, et al. Country characteristics and acute diarrhea in children from developing nations:a multilevel study[J]. BMC Public Health, 2015, 15: 811. DOI:10.1186/s12889-015-2120-8 |
| [6] | Scallan E, Griffin PM, Angulo FJ, et al. Foodborne illness acquired in the United States-unspecified agents[J]. Emerg Infect Dis, 2011, 17(1): 16–22. DOI:10.3201/eid1701.P21101 |
| [7] | Thomas MK, Murray R, Flockhart L, et al. Estimates of foodborne illness-related hospitalizations and deaths in Canada for 30 specified pathogens and unspecified agents[J]. Foodborne Pathog Dis, 2015, 12(10): 820–827. DOI:10.1089/fpd.2015.1966 |
| [8] | Shen HW, Zhang JJ, Li YH, et al. The 12 gastrointestinal pathogens spectrum of acute infectious diarrhea in a sentinel hospital, Shenzhen, China[J]. Front Microbiol, 2016, 7: 1926. DOI:10.3389/fmicb.2016.01926 |
| [9] |
王鑫. 2010-2014年我国感染性腹泻病原流行特征研究[D]. 北京: 北京协和医学院, 2016.
Wang X. The epidemic characteristics of infectious diarrheal pathogens of China during 2010 to 2014[D]. Beijing: Peking Union Medical College, 2016. |
| [10] | DuPont HL. Clinical practice. Bacterial diarrhea[J]. N Engl J Med, 2009, 361(16): 1560–1569. DOI:10.1056/NEJMcp0904162 |
| [11] |
崔恩博, 陈素明, 张成龙, 等. 2009-2013年我国16省市社区获得性细菌性腹泻病原菌分布及临床耐药分析[J]. 传染病信息, 2014, 27(3): 143–147.
Cui EB, Chen SM, Zhang CL, et al. Distribution of the community-acquired bacterial diarrheal pathogens and drug resistance in 16 provinces or cities in China during 2009-2013[J]. Infect Dis Info, 2014, 27(3): 143–147. |
| [12] | Zhang H, Si YL, Wang XF, et al. Patterns of bacillary dysentery in China, 2005-2010[J]. Int J Environ Res Public Health, 2016, 13(2): 164. DOI:10.3390/ijerph13020164 |
| [13] | Wang X, Wang J, Sun H, et al. Etiology of childhood infectious diarrhea in a developed region of China:compared to childhood diarrhea in a developing region and adult diarrhea in a developed region[J]. PLoS One, 2015, 10(11): e0142136. DOI:10.1371/journal.pone.0142136 |
| [14] | Senderovich Y, Ken-Dror S, Vainblat I, et al. A molecular study on the prevalence and virulence potential of Aeromonas spp. recovered from patients suffering from diarrhea in Israel[J]. PLoS One, 2012, 7(2): e30070. DOI:10.1371/journal.pone.0030070 |
| [15] | Puthucheary SD, Puah SM, Chua KH. Molecular characterization of clinical isolates of Aeromonas species from Malaysia[J]. PLoS One, 2012, 7(2): e30205. DOI:10.1371/journal.pone.0030205 |
 2018, Vol. 39
2018, Vol. 39