文章信息
- 郑敏娜, 宁铁林, 周宁, 赵璇, 李龙, 朱静瑾, 程绍辉.
- Zheng Minna, Ning Tielin, Zhou Ning, Zhao Xuan, Li Long, Zhu Jingjin, Cheng Shaohui.
- 天津市2014-2017年男男性行为人群艾滋病病毒感染者原发性耐药分析
- Transmitted drug resistance among HIV infected men who have sex with men in Tianjin, 2014-2017
- 中华流行病学杂志, 2018, 39(5): 619-624
- Chinese Journal of Epidemiology, 2018, 39(5): 619-624
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2018.05.015
-
文章历史
收稿日期: 2017-10-31
MSM人群作为HIV传播流行的重要人群,疫情形势日趋严重。近年来我国MSM人群HIV感染者(MSM感染者)人数呈逐年上升趋势,已成为艾滋病的重点防治人群。2016年1—10月天津市新报告HIV感染者714例,男男性行为感染占71.54%,流行形势不容乐观。了解未经抗病毒治疗的MSM感染者的耐药株流行特点,对有效开展艾滋病防控和抗病毒治疗具有重要的意义[1-2]。原发性耐药(transmitted drug resistance,TDR)也称传播性耐药,相对于继发性耐药来说,TDR主要经HIV耐药基因突变毒株的感染者直接传播给从未接受过抗病毒治疗的新感染者获得,是抗病毒治疗广泛开展后的产物,显著增加了感染者初始治疗的风险。本研究综合分析2014—2017年天津市未经抗病毒治疗的MSM感染者TDR流行特点和相关因素,为天津市艾滋病防控工作提供参考依据。
对象与方法1.研究对象和样本采集:为2014—2017年确证的、现住址为天津市、男男性行为途径感染、未经抗病毒治疗的MSM感染者。按每年10%比例进行分层随机抽样,经过知情同意后采集其血清样本,进行pol区基因序列耐药性检测。未能获得目的基因序列的样本不纳入本研究。
2.核酸提取和基因序列扩增:按照病毒RNA提取试剂盒(Viral RNA Extraction Kit,德国QIAGEN生物技术有限公司)说明书,提取感染者血浆中的病毒RNA。第一轮扩增反应采用一步法RT-PCR(PrimeScriptTM One-step RNA PCR Kit,大连宝生物工程有限公司),以提取的RNA为模板;第二轮反应采用巢式PCR扩增,以第一轮扩增产物为模板,扩增HIV-1的pol区全长为1 300 bp的基因片段。PCR产物经1%琼脂糖凝胶电泳,QIAGEN公司QIA quick gel extraction kit切胶纯化,使用ABI PRISM 3730XL进行测序。
3.基因多态性及耐药性分析:使用SeqScanner软件对获得的序列质量进行初步评价及清理。Vector NTI软件中的Contig Express组件进行序列拼接和编辑,BioEdit软件进行拼接后序列的校对、整理和比对分析。Los Alamos Database HIV数据库中下载各亚型的参考序列。REGA HIV-1 Subtyping Tool-Version 3.0进行亚型的初步鉴定。MEGA 6.0软件Neighbor-Joining方法进行亚型及系统进化分析(Bootstrap分析重复1 000次),Tamura-Nei 93核酸替代模型计算序列间的基因距离,对Bootstrap值≥80%且基因距离<0.015的成簇样本的特点进行分析[1-2]。序列提交美国斯坦福大学HIV耐药数据库中的Calibrated Population Resistance工具进行监测性耐药突变(Surveillance Drug Resistance Mutation,SDRM)分析。
4.统计学分析:采用SPSS 21.0软件对MSM人群HIV感染者的基本资料进行Mann-Whitney U检验(2-tailed)描述性统计分析。用χ2检验对TDR相关因素进行分析。检验水准α=0.05。
结果1.基本情况:
(1)人口学特征:共有205例样本获得pol区基因序列(225例样本进行基因型耐药检测,20例样本未获得目的基因序列)。205例样本的感染者年龄17~75(32±11)岁;未婚者占71.7%(147/205);高中及以上文化程度者占77.1%(158/205);本地户籍占81.0%(166/205);汉族占93.7%(192/205)。
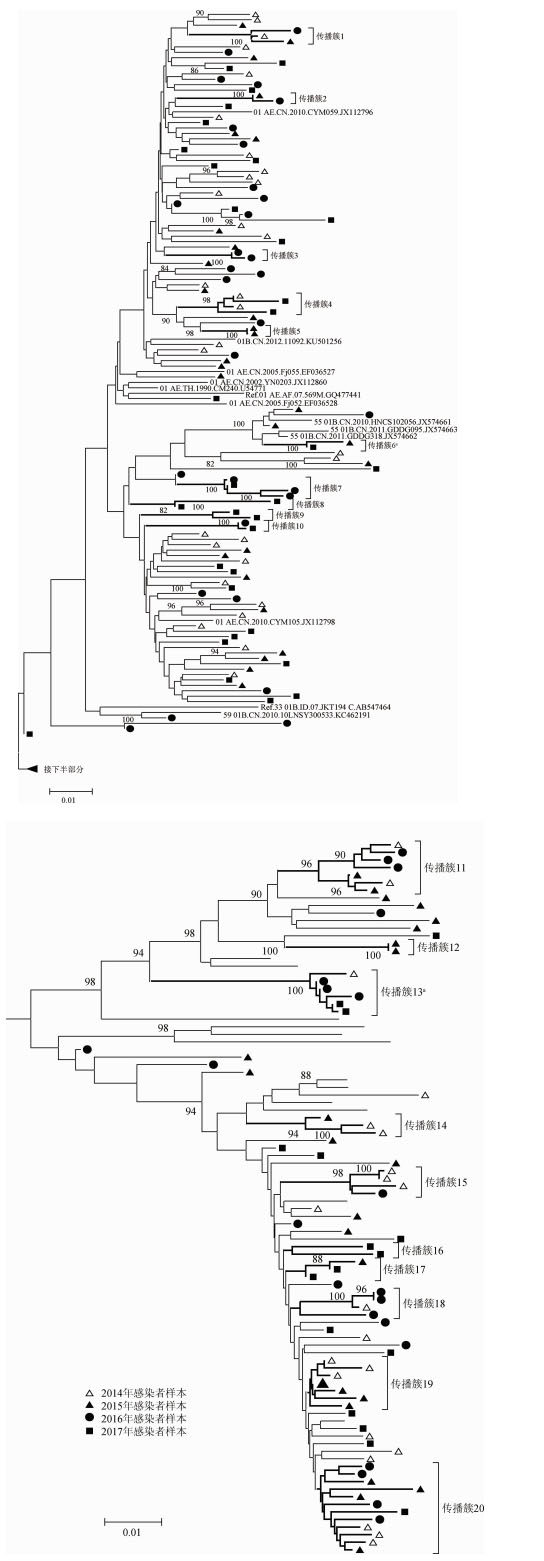
(2)亚型分布特点:HIV感染者流行的亚型依次为CRF01_AE占53.2%(109/205),CRF07_BC占28.8%(59/205),B亚型占10.2%(21/205),CRF55_01B亚型占4.9%(10/205),其他独特型二代重组亚型(Unique recombinant forms,URFs)占2.9%(6/205)。Bootstrap值≥80%且基因距离<0.015的成簇样本75例,占36.6%(75/205),共分布在20个传播簇内,亚型分布以CRF07_BC为主,占46.7%(35/75),其次为CRF01_AE占29.3%(22/75),B亚型占20.0%(15/75)、CRF55_01B占2.7%(2/75)和URFs占1.3%(1/75)。
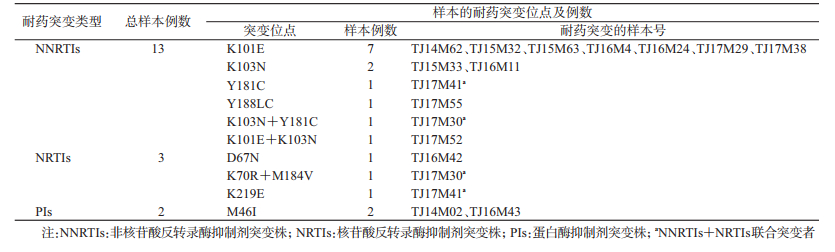
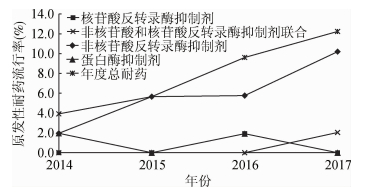
2.耐药毒株流行情况:根据WHO公布的2009版监测性耐药突变名录(http://cpr.standford.edu/cpr.cgi),共发现16例有监测性耐药突变感染者,其TDR流行率为7.8%(16/205),2014—2017年各年度流行率逐年上升,但差异无统计学意义(χ2=2.504,P=0.127),2014—2017年分别为3.9%(2/51)、5.7%(3/53)、9.6%(5/52)和12.2%(6/49)(图 1)。各亚型TDR耐药率CRF01_AE为3.4%(7/205)、B亚型为2.9%(6/205)、CRF55_01B为1.0%(2/205)及URFs为0.5%(1/205),CRF07_BC无TDR突变。62.5%(10/16)耐药突变分布在5个传播簇中,其中13号传播簇内有5例感染者(TJ14M62、TJ16M24、TJ16M40、TJ17M29和TJ17M38)均为CRF07_BC亚型且有相同的K101E突变;6号CRF55_01B亚型传播簇内的2例感染者(TJ15M33和TJ17M30)均为CRF55_01B亚型有相同K103N突变(图 2)。
|
| 图 1 2014—2017年天津市男男性行为人群艾滋病病毒感染者原发性耐药流行率 |
|
| 注:a为有耐药突变的传播簇6和13:13号传播簇内有5例感染者(TJ14M62、TJ16M24、TJ16M40、TJ17M29和TJ17M38)均为CRF07_BC亚型且有相同的K101E突变;6号传播簇内的2例感染者(TJ15M33和TJ17M30))均为CRF55_01B亚型有相同K103N突变 图 2 2014—2017年天津市未经抗病毒治疗的男男性行为人群艾滋病病毒感染者pol区进化树及传播簇分布 |
3. TDR突变位点分析:耐药突变以非核苷酸反转录酶抑制剂(non-nucleoside reverse transcriptase inhibitors,NNRTIs)耐药突变者为主共13例,占6.3%(13/205);核苷酸反转录酶抑制剂(nucleoside reverse transcriptase inhibitors,NRTIs)耐药突变者共3例占1.5%(3/205);蛋白酶抑制剂(protease inhibitors,PIs)耐药突变者2例占1.0%(2/205);其中NNRTIs+NRTIs联合突变者占1.0%(2/205)(表 1)。
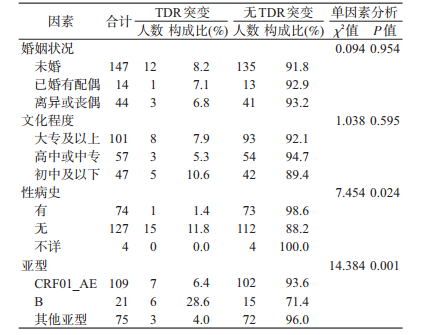
4. TDR突变相关因素分析:TDR突变相关因素分析结果显示,突变与感染者年龄、民族、户籍、婚姻状况及文化程度均无相关性。无性病史的耐药突变者明显高于有性病史者,差异有统计学意义(χ2=7.454,P=0.024);CRF01_AE和B亚型的耐药突变者明显高于其他亚型,差异有统计学意义(χ2=14.384,P=0.001)(表 2)。
我国自2003年全面开展的艾滋病抗病毒治疗工作,有效提高了患者的生存质量,降低了患者的死亡率。但是广泛的抗病毒治疗也会促进耐药突变毒株产生和传播,并影响抗病毒治疗效果。本研究结果显示天津市MSM人群未治疗HIV感染者的TDR流行率为7.8%,略高于WHO提出5%的中度流行警戒线[3],TDR流行率从2014年3.9%的低度流行水平逐步上升为2015年5.7%、2016年9.6%的中度流行和2017年12.2%的高度流行水平,呈逐年上升趋势,且突变位点分布的复杂性逐年增加。2015年天津市的调查结果显示[3],未经治疗的新发感染者的TDR流行率为5.3%,略低于本次针对MSM人群的研究结果,考虑与天津市MSM人群多性伴和频繁的无保护高危性行为等特点有关,这些高危行为极有可能增加了该人群暴露于多来源毒株的风险[4]。
本研究显示NNRTIs突变毒株的流行率最高为6.3%(13/205),NRTIs和PIs次之,此结果与目前国内外研究结果基本一致[4-8]。美国的相关研究发现[5],1996年开展联合抗病毒治疗之前TDR突变主要以NNRTIs为主,而此后NNRTIs的TDR流行率逐年上升,并成为最主要的流行趋势,其中K103N是最常见的突变位点,占所有耐药突变的53.7%,主要原因是与NNRTIs类药物依法韦仑在人群中长期及频繁应用导致的早期抗病毒治疗失败有关。而本研究发现的NNRTIs突变中K101E最多,其次为K103N,是否与我国抗病毒治疗中依曲韦林和利匹韦林等NNRTIs类药物的广泛应用、导致的早期抗病毒失败有关值得深入探讨。本研究中NRTIs突变毒株的流行相对稳定,主要是针对齐多夫定和司他夫定的低度耐药,只有1例(K70R+M184V+K103N+Y181C)联合突变者对恩曲他滨和拉米夫定的高度耐药。齐多夫定和司他夫定是老一代的NRTIs类药物,目前已经较少使用,所以该突变很可能是在早期接受齐多夫定和司他夫定抗病毒治疗的患者体内产生后导致长期稳定的流行,这一结果已经得到了许多研究的证实[6]。目前研究发现PIs突变流行率均低于NNRTIs和NRTIs,可能是PIs突变的高基因屏障所致[7]。
HIV传播过程中,被感染者体内的毒株由于突变时间短且抗病毒选择压力小,因此与供者的序列同源性极高,采用系统进化的方法分析成簇样本能够了解MSM人群HIV耐药传播特点[1-3]。本研究中16例耐药突变者中有10例样本成簇分布,成簇耐药突变者明显高于非成簇者,且其中6号和13号传播簇内样本的突变位点一致,提示这些耐药毒株在MSM人群中可能有较高的传播风险,是否与感染者的亚型有关有待进一步深入研究。Brenner等[9]研究发现成簇样本在传播过程中耐药位点发生回复突变的时间会缩短。本研究发现的20个传播簇中只有5个簇有耐药突变,其中3个传播簇每簇只有1个样本为有耐药突变,考虑可能与成簇样本在传播过程中耐药位点的回复突变或采样偏倚有关。
TDR突变相关因素分析结果显示,感染者耐药突变与其性病史和亚型有关,差异具有统计学意义(P均<0.05)。目前研究发现[10],感染梅毒后HIV感染者会出现病毒载量增加和耐药突变位点的改变,并提示除了生物学的相互作用,可能还与该共感染人群的高危行为及服药依从性有关。因此合并性病感染对HIV感染者耐药突变的影响应该从生物学相互作用机制、行为学和ART等多方面深入研究。CRF01_AE亚型是我国最主要的流行亚型,本研究发现CRF01_AE亚型和B亚型感染者TDR流行率最高,分别为3.4%和2.9%。
综上所述。2014—2017年天津市未经抗病毒治疗的MSM HIV感染者中TDR毒株数量和突变位点分布的复杂性不断增加,给天津市及全国艾滋病抗病毒治疗和药物研发提出了严峻挑战,应引起高度重视。
利益冲突: 无
| [1] | Pines HA, Wertheim JO, Liu L, et al. Concurrency and HIV transmission network characteristics among MSM with recent HIV infection[J]. AIDS, 2016, 30(18): 2875–2883. DOI:10.1097/QAD.0000000000001256 |
| [2] |
张佳峰, 杨介者, 潘晓红, 等. 浙江省男男性行为人群HIV-1新近感染者的毒株亚型和传播簇研究[J]. 中华流行病学杂志, 2015, 36(1): 61–66.
Zhang JF, Yang JZ, Pan XH, et al. HIV-1 subtype diversity and transmission clusters among men having sex with men who recently got HIV-l infection, in Zhejiang province[J]. Chin J Epidemiol, 2015, 36(1): 61–66. DOI:10.3760/cma.j.issn.0254-6450.2015.01.015 |
| [3] |
郑敏娜, 宁铁林, 高永军, 等. 天津市2015年HIV流行和传播的分子流行病学特征分析[J]. 中华流行病学杂志, 2016, 37(8): 1142–1147.
Zheng MN, Ning TL, Gao YJ, et al. Molecular epidemiology and transmission of HIV in Tianjin, 2015[J]. Chin J Epidemiol, 2016, 37(8): 1142–1147. DOI:10.3760/cma.j.issn.0254-6450.2016.08.018 |
| [4] | Jiao Y, Li SM, Li ZP, et al. HIV-1 transmitted drug resistance-associated mutations and mutation co-variation in HIV-1 treatment-naïve MSM from 2011 to 2013 in Beijing, China[J]. BMC Infect Dis, 2014, 14: 689. DOI:10.1186/s12879-014-0689-7 |
| [5] | Günthard HF, Saag MS, Benson CA, et al. Antiretroviral drugs for treatment and prevention of HIV infection in adults:2016 recommendations of the international antiviral society-USA panel[J]. JAMA, 2016, 316(2): 191–210. DOI:10.1001/jama.2016.8900 |
| [6] | Rhee SY, Taylor J, Fessel WJ, et al. HIV-1 protease mutations and protease inhibitor cross-resistance[J]. Antimicrob Agents Chemother, 2010, 54(10): 4253–4261. DOI:10.1128/AAC.00574-10 |
| [7] | Wensing AM, van Maarseveen NM, Nijhuis M. Fifteen years of HIV protease inhibitors:raising the barrier to resistance[J]. Antiviral Res, 2010, 85(1): 59–74. DOI:10.1016/j.antiviral.2009.10.003 |
| [8] | Zhang FD, Liu L, Sun MY, et al. An analysis of drug resistance among people living with HIV/AIDS in Shanghai, China[J]. PLoS One, 2017, 12(2): e0165110. DOI:10.1371/journal.pone.0165110 |
| [9] | Brenner BG, Roger M, Moisi DD, et al. Transmission networks of drug resistance acquired in primary/early stage HIV infection[J]. AIDS, 2008, 22(18): 2509–2515. DOI:10.1097/QAD.0b013e3283121c90 |
| [10] | Kalichman SC, Pellowski J, Turner C. Prevalence of sexually transmitted co-infections in people living with HIV/AIDS:systematic review with implications for using HIV treatments for prevention[J]. Sex Transm Infect, 2011, 87(3): 183–190. DOI:10.1136/sti.2010.047514 |
 2018, Vol. 39
2018, Vol. 39