文章信息
- 吕章艳, 李霓, 王刚, 苏凯, 李放, 郭兰伟, 冯小双, 魏锣沛, 陈宏达, 陈玉恒, 谭锋维, 杨文静, 陈朔华, 任建松, 石菊芳, 崔宏, 代敏, 吴寿岭, 赫捷.
- Lyu Zhangyan, Li Ni, Wang Gang, Su Kai, Li Fang, Guo Lanwei, Feng Xiaoshuang, Wei Luopei, Chen Hongda, Chen Yuheng, Tan Fengwei, Yang Wenjing, Chen Shuohua, Ren Jiansong, Shi Jufang, Cui Hong, Dai Min, Wu Shouling, He Jie.
- 总胆固醇与男性肺癌发病关系的前瞻性队列研究
- Association between total cholesterol and risk of lung cancer incidence in men: a prospective cohort study
- 中华流行病学杂志, 2018, 39(5): 604-608
- Chinese Journal of Epidemiology, 2018, 39(5): 604-608
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2018.05.012
-
文章历史
收稿日期: 2017-09-17
2. 100021 北京, 国家癌症中心/中国医学科学院北京协和医学院肿瘤医院 胸外科;
3. 063000 唐山, 开滦总医院 肿瘤科;
4. 063000 唐山, 开滦总医院 开滦员工健康保健中心;
5. 450008 郑州大学附属肿瘤医院/河南省肿瘤医院 河南省肿瘤防治研究办公室
2. Department of Thoracic Surgery, National Cancer Center/Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021, China;
3. Department of Oncology, Kailuan General Hospital, Tangshan 063000, China;
4. Health Department of Kailuan(group), Kailuan General Hospital, Tangshan 063000, China;
5. Office for Henan Cancer Control and Research, The Affiliated Cancer Hospital of Zhengzhou University, Henan Cancer Hospital, Zhengzhou 450008, China
肺癌是严重威胁人类健康的恶性肿瘤之一,位居世界及中国恶性肿瘤发病及死亡的首位[1-2]。据全国肿瘤登记中心最新数据,2013年中国肺癌发病和死亡率分别为53.86/105和43.41/105,且呈逐年上升趋势[3]。已知的肺癌危险因素包括吸烟、职业暴露、家族史等[4]。随着经济发展和生活方式的改变,中国人群血脂异常患病及相关慢性病的疾病负担继续加重[5]。既往研究显示,TC与部分恶性肿瘤的发生相关[6]。近年来,也有越来越多的研究提示,TC与肺癌的发生可能相关,然而目前的研究结果不尽一致[7-13]。本研究利用唐山市一项前瞻性人群队列研究,探索TC与男性肺癌发生风险的关联及其强度,为肺癌的预防提供流行病学依据。
对象与方法1.研究对象:自2006年5月,以开滦集团全体在职及离退休男性职工为研究对象,建立开滦男性动态队列,并每两年进行一次健康体检,项目具体信息参见文献[14]。纳入标准:年龄≥18岁,签署知情同意书。排除标准:基线调查时已被诊断为恶性肿瘤;缺乏基线TC检测数据。本研究通过了开滦集团有限责任公司医院医学伦理委员会伦理审核。
2.研究方法:基线调查包括问卷调查、体格检查、血样本生化指标检测和影像学检查。问卷调查采用统一设计的《开滦集团公司员工健康体检表》,包括社会人口学信息(年龄、性别和文化程度等)、生活方式(吸烟、饮酒和体力活动等)、既往疾病史(糖尿病、高血脂和高血压等);体格检查指标包括身高、体重和腰围等;血液检测指标包括FPG、TC和HBsAg等;影像学检查包括B超、X线和心电图等。问卷调查采用面对面形式完成后,由录入员双录入并进行逻辑核查。所有调查均由经过系统培训及考核的专业人员完成,调查期间进行定期质量评估。
(1)暴露信息收集:研究对象均在晨起空腹状态下,采集外周静脉血5 ml,在室温下离心后取上层血清,使用胆固醇氧化酶法测量TC(北京北方生物技术研究所)。所有的血标本由专业医务人员参照标准操作程序进行分析。参考《中国成人血脂异常防治指南》中制定的TC异常标准(TC≥200 mg/dl为边缘升高,TC≥240 mg/dl为升高)与本研究人群TC分布特征,采用TC的五分位数进行分组:<160、160~、180~、200~、≥240 mg/dl,并以正常TC组(160~mg/dl)为参比,探讨TC与男性肺癌发病风险的关联。
(2)结局信息收集:基线调查后,研究对象参加后续的健康体检,获得恶性肿瘤发病信息,同时链接唐山市医保系统、开滦集团医保系统和开滦总医院的出院信息系统,收集可能遗漏的肺癌新发病例,进行数据补充。对随访中的新发肿瘤病例,由肿瘤专业临床医生到其诊治的医院检阅病例并摘录病理诊断等诊疗信息,以核实并完善肺癌诊断;对死亡者除搜集病例外,调查人员将通过家属和公安机关进行死因调查。
3.统计学分析:使用SAS 9.4软件进行数据分析。使用精确法计算观察人年数。进入队列时间为首次健康体检的时间,退出队列时间为癌症发生、死亡或随访截止时间。计量资料采用x±s表示,方差分析比较组间差异;计数资料使用频数(百分数)表示,χ2检验比较组间差异。以TC等因素为自变量,肺癌是否发病为因变量,使用单因素和多因素Cox比例风险回归模型分析TC与肺癌发病风险的关系。在计算粗HR值(95%CI)的基础上,逐步调整年龄、文化程度、收入情况、吸烟情况、饮酒情况、FPG、粉尘暴露史和BMI,计算各模型下不同TC水平的肺癌发生风险。将TC的分组等级作为连续性变量纳入模型进行线性分析;采用限制性立方样条曲线(Restricted Cubic Spline,RCS)将TC整体作为连续变量纳入模型进行非线性分析[15]。分别排除参加基线调查后2年内新发肿瘤病例,自报有高血脂病史的研究对象,进行敏感性分析。使用双侧检验,P<0.05为差异有统计学意义。
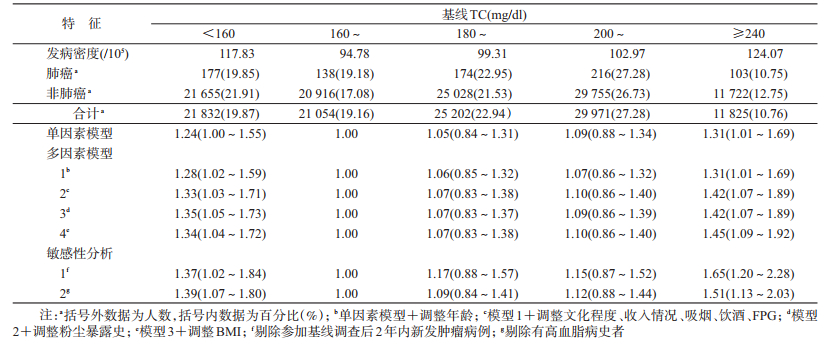
结果1.基本情况:截至2014年12月31日,基线110 619名男性研究对象中,最终纳入分析109 884人;共随访763 819.25人年,随访时间M为7.88年;收集肺癌新发病例808例,肺癌粗发病密度为105.78/10万人年。研究对象的年龄为(51.36±13.61)岁;BMI为(24.32±3.24)kg/m2;FPG为(5.54±1.70)mmol/L;TC为(190.59±44.44)mg/L。初中及以下学历、每月收入不足1 000元、有粉尘暴露史的研究对象分别占75.91%(83 415人)、74.20%(81 539人)和57.73%(63 433人)。吸烟、饮酒的研究对象分别占41.63%(45 746人)和44.36%(48 747人)。见表 1。
2. TC分布:文化程度较低者、经济水平较低、无粉尘暴露史者、吸烟者、饮酒者、BMI较高者、血糖较高者,TC较高(均P<0.05)。见表 2。
3. TC与肺癌发病风险关联:单因素分析结果提示,与TC正常组(160~mg/dl)相比,TC偏低(<160 mg/dl)组与TC升高(≥240 mg/dl)组肺癌发病风险分别升高了24%和31%。逐步调整年龄、文化程度、收入情况、吸烟、饮酒、FPG、粉尘暴露史后,TC偏低与TC升高组的肺癌发病风险是TC正常组的1.35倍(HR=1.35,95%CI:1.05~1.73)及1.42倍(HR=1.42,95%CI:1.07~1.89)。进一步调整BMI后,TC偏低(HR=1.34,95%CI:1.04~1.72)与TC升高(HR=1.45,95%CI:1.09~1.92)与肺癌发病风险关联均有所改变。RCS分析未发现TC水平与男性肺癌发病风险存在剂量反应关联(总体P=0.421,非线性P=0.294)。此外,研究中分别排除参加基线调查后2年内新发肿瘤病例或有高血脂病史的研究对象后,上述关联均未发生明显改变。见表 3。
肺癌患者预后与诊断时临床分期密切相关,局限期、区域累及和远处转移患者的5年生存率分别为49%、16%和2%。由于早期症状隐匿,多数患者就诊时已经进展至中晚期,肺癌病死率高、预后差[16]。因此,探索潜在的肺癌危险因素,识别肺癌高危人群,及早采取干预措施具有重要公共卫生意义。本研究利用近11万人的前瞻性研究数据分析TC与男性肺癌发病的关联,结果显示,与TC较低的人群相比,TC升高或过低人群的肺癌发病风险均升高。
基于由挪威、瑞典和澳大利亚3个国家人群构成的Me-Can队列,Stocks等[17]将TC、TG与BMI等其他代谢指标结合构建代谢评分,研究发现高代谢水平可能与癌症发生相关。Meta分析结果证实,TC水平与癌症发生风险呈正相关[6]。进一步的人群研究提示,TC可能与肺癌发病风险存在关联,然而相关队列研究较少,且结果并不一致[7-13]。美国女性健康研究(Women’s Health Study,WHS)显示,与低TC(72~180 mg/dl)者相比,高TC(235~474 mg/dl)者肺癌发病风险增加77%,进一步调整癌症家族史、基线BMI水平等因素后,该关联差异无统计学意义[7],Me-Can队列也提示相似的研究结果[9]。然而基于韩国男性的队列研究发现,相较于低TC(<160 mg/dl)者,高TC(≥240 mg/dl)者发生肺癌的相对风险降低了11%[10]。研究人群差异(不同性别、种族)和TC分组差异在一定程度上可以解释各研究结果间的不一致性。
大量人群研究已表明,BMI与肺癌发病及死亡风险均呈负相关[18-19]。本研究结果显示,在原有模型的基础上继续调整BMI后,低TC与高TC与肺癌发病风险关联均有所改变,提示BMI可能是TC与男性肺癌关联中的混杂或中间作用因素,确切作用与机制有待进一步深入探究。
为排除临床前期肺癌影响血脂水平从而导致的偏倚,本研究剔除了参加基线调查后2年内的肺癌新发病例;为排除TG、LDL-C及HDL-C水平不同导致的偏倚,本研究剔除了有高血脂病史者,研究结果均无较大改变,提示TC与肺癌发病关联的稳健性。
目前,TC对肺癌发生的具体作用机制尚不清楚。研究表明,TC是胆汁酸和类固醇激素的前体,可以促进肿瘤细胞增殖,抑制肿瘤细胞凋亡及促进肿瘤血管生成[20];或通过干扰细胞通路和肿瘤相关蛋白发挥正常功能[21-22],从而促进恶性肿瘤发生发展。
本研究为前瞻性设计,剔除基线自报患恶性肿瘤者,可避免新发现患偏倚;且血脂水平值来源于血液检测而非自报,避免了信息偏倚的影响。本研究存在局限性。队列随访时间相对较短,肺癌发病例数需要进一步的积累;未深入分析TC与肺癌不同组织病理学类型间关联的差异。
综上所述,TC水平过高或过低均可增加男性肺癌发生风险。因此,个体需控制合适水平的TC;医务及科研人员应关注TC异常人群,从而促进高危人群的早期识别与肺癌的预防控制,降低肺癌疾病负担。
志谢: 感谢所有参加开滦队列项目的成员和参与项目现场调查以及管理的工作人员利益冲突: 无
| [1] | Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide:sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359–386. DOI:10.1002/ijc.29210 |
| [2] | Chen WQ, Zheng RS, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [3] |
陈万青, 郑荣寿, 张思维, 等. 2013年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2017, 26(1): 1–7.
Chen WQ, Zheng RS, Zhang SW, et al. Report of cancer incidence and mortality in China, 2013[J]. Chin Cancer, 2017, 26(1): 1–7. DOI:10.11735/j.issn.1004-0242.2017.01.A001 |
| [4] |
么鸿雁, 施侣元. 中国人群肺癌发病危险因素的Meta分析[J]. 中华流行病学杂志, 2003, 24(1): 45–49.
Yao HY, Shi LY. Meta-analysis of the risk factors on lung cancer in Chinese people[J]. Chin J Epidemiol, 2003, 24(1): 45–49. DOI:10.3760/j.issn:0254-6450.2003.01.013 |
| [5] |
国家卫生和计划生育委员会疾病预防控制局. 中国居民营养与慢性病状况报告(2015年)[M]. 北京: 人民卫生出版社, 2015.
Disease Control and Prevention Bureau of National Health and Family Planning Commission of PRC.Report of Chinese residents' nutrition and chronic diseases (2015)[M]. Beijing: People's Medical Publishing House, 2015. |
| [6] | Melvin JC, Holmberg L, Rohrmann S, et al. Serum lipid profiles and cancer risk in the context of obesity:four Meta-analyses[J]. J Cancer Epidemiol, 2013, 2013: 823849. DOI:10.1155/2013/823849 |
| [7] | Chandler PD, Song Y, Lin J, et al. Lipid biomarkers and long-term risk of cancer in the Women's Health Study[J]. Am J Clin Nutr, 2016, 103(6): 1397–1407. DOI:10.3945/ajcn.115.124321 |
| [8] | Everatt R, Virvičiūtė D, Kuzmickienė I, et al. Body mass index, cholesterol level and risk of lung cancer in Lithuanian men[J]. Lung Cancer, 2014, 85(3): 361–365. DOI:10.1016/j.lungcan.2014.07.009 |
| [9] | Strohmaier S, Edlinger M, Manjer J, et al. Total serum cholesterol and cancer incidence in the metabolic syndrome and cancer project (Me-Can)[J]. PLoS One, 2013, 8(1): e54242. DOI:10.1371/journal.pone.0054242 |
| [10] | Kitahara CM, Berrington de González A, Freedman ND, et al. Total cholesterol and cancer risk in a large prospective study in Korea[J]. J Clin Oncol, 2011, 29(12): 1592–1598. DOI:10.1200/jco.2010.31.5200 |
| [11] | Iso H, Ikeda A, Inoue M, et al. Serum cholesterol levels in relation to the incidence of cancer:the JPHC study cohorts[J]. Int J Cancer, 2009, 125(11): 2679–2686. DOI:10.1002/ijc.24668 |
| [12] | Ahn J, Lim U, Weinstein SJ, et al. Prediagnostic total and high-density lipoprotein cholesterol and risk of cancer[J]. Cancer Epidemiol Biomarkers Prev, 2009, 18(11): 2814–2821. DOI:10.1158/1055-9965.EPI-08-1248 |
| [13] | Steenland K, Nowlin S, Palu S. Cancer incidence in the National Health and Nutrition Survey Ⅰ. Follow-up data:diabetes, cholesterol, pulse and physical activity[J]. Cancer Epidemiol Biomarkers Prev, 1995, 4(8): 807–811. |
| [14] | Wang G, Li N, Chang S, et al. A prospective follow-up study of the relationship between C-reactive protein and human cancer risk in the Chinese Kailuan Female Cohort[J]. Cancer Epidemiol Biomarkers Prev, 2015, 24(2): 459–465. DOI:10.1158/1055-9965.EPI-14-1112 |
| [15] | Desquilbet L, Mariotti F. Dose-response analyses using restricted cubic spline functions in public health research[J]. Stat Med, 2010, 29(9): 1037–1057. DOI:10.1002/sim.3841 |
| [16] |
钱桂生, 余时沧. 肺癌流行病学最新资料与启示[J]. 中华结核和呼吸杂志, 2012, 35(2): 86–89.
Qian GS, Yu SC. Latest information and enlightenment of lung cancer epidemiology[J]. Chin J Tuberc Respir Dis, 2012, 35(2): 86–89. DOI:10.3760/cma.j.issn.1001-0939.2012.02.003 |
| [17] | Stocks T, Bjørge T, Ulmer H, et al. Metabolic risk score and cancer risk:pooled analysis of seven cohorts[J]. Int J Epidemiol, 2015, 44(4): 1353–1363. DOI:10.1093/ije/dyv001 |
| [18] | Gupta A, Majumder K, Arora N, et al. Premorbid body mass index and mortality in patients with lung cancer:a systematic review and Meta-analysis[J]. Lung Cancer, 2016, 102: 49–59. DOI:10.1016/j.lungcan.2016.10.017 |
| [19] | Yang Y, Dong JY, Sun KK, et al. Obesity and incidence of lung cancer:a Meta-analysis[J]. Int J Cancer, 2013, 132(5): 1162–1169. DOI:10.1002/ijc.27719 |
| [20] | Cruz P, Torres C, Ramírez ME, et al. Proliferation of human mammary cancer cells exposed to 27-hydroxycholesterol[J]. Exp Ther Med, 2010, 1(3): 531–536. DOI:10.3892/etm_00000084 |
| [21] | Mondul AM, Weinstein SJ, Virtamo J, et al. Serum total and HDL cholesterol and risk of prostate cancer[J]. Cancer Causes Control, 2011, 22(11): 1545–1552. DOI:10.1007/s10552-011-9831-7 |
| [22] | Oh HY, Lee EJ, Yoon S, et al. Cholesterol level of lipid raft microdomains regulates apoptotic cell death in prostate cancer cells through EGFR-mediated Akt and ERK signal transduction[J]. Prostate, 2007, 67(10): 1061–1069. DOI:10.1002/pros.20593 |
 2018, Vol. 39
2018, Vol. 39