文章信息
- 洪翔, 于红, 王蓓.
- Hong Xiang, Yu Hong, Wang Bei.
- 新生儿B族链球菌感染相关疾病影响因素的研究进展
- Progress on influencing factors regarding the neonatal group B streptococcal infectious diseases
- 中华流行病学杂志, 2018, 39(2): 249-252
- Chinese Journal of Epidemiology, 2018, 39(2): 249-252
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2018.02.022
-
文章历史
收稿日期: 2017-07-20
2. 210009 南京, 东南大学附属中大医院妇产科
2. Department of Obstetrics, Southeast University Affiliated Zhongda Hospital, Nanjing 210009, China
B族链球菌(group B streptococcus,GBS)是一种寄生于人类下消化道及泌尿生殖道的革兰阳性β-溶血性链球菌,在国内又称为B组链球菌、无乳链球菌等[1]。其在健康人群中的带菌率因人种和地域不同略有差异,国内报道的中国孕妇带菌率可达10.1%~32.4%[2],而欧美国家的带菌率略高于中国。20世纪70年代以来,GBS所致的妇女生殖道感染,尤其是围产期感染呈上升趋势。在美国,GBS是围产期严重感染性疾病的主要致病菌之一,已将其作为孕期常规检查的项目之一[3],但在国内仍没有明确的筛查及诊治妊娠期GBS感染的临床指南。新生儿感染GBS可能没有任何临床症状,也有可能引起GBS相关疾病,甚至死亡。本文对近年来新生儿GBS相关疾病的病因研究进展做一综述,为进一步研究新生儿GBS相关疾病的危险因素提供思路,为我国探讨落实围产期母婴GBS感染的筛查和诊疗工作提供理论依据。
一、新生儿GBS相关疾病流行病学特征一项大型Meta分析结果提示,全球0~89 d的婴儿GBS相关疾病的发病率估计为0.53‰[4],且在出生后的前3个月是GBS相关疾病的高发期,此后发病率下降。新生儿GBS相关疾病分为早发型和晚发型。早发型GBS疾病(Early-onset GBS disease,GBS-EOD)的定义是在新生儿出生后6 d内发生的,目前较为公认的发病原因是母亲生殖道的GBS逆行性感染,或者分娩时,胎儿经过有GBS定植的产道而发生的感染[5]。晚发型GBS疾病(Late-onset GBS disease,GBS-LOD)的定义是新生儿出生后7~89 d内发生的GBS相关疾病,目前较为公认的发病原因是水平传播[6]。
新生儿的GBS相关疾病主要表现为:高热、抽搐、肺炎、败血症、脑膜炎、骨关节炎等,如果不及时治疗,可能导致器官衰竭而死亡[3]。国内的病例报道显示,新生儿GBS脑膜炎治愈出院后,存在一定程度的预后不良,包括语言发育及运动发育落后等[7]。有研究的数据表明,感染了GBS的孕妇所产的新生儿中,约50%能够检测到GBS感染,其中约1%~2%的会发展成为GBS-EOD疾病[8],而GBS-LOD疾病的发生率则更低。这提示,新生儿GBS感染并不是导致GBS相关疾病的充分病因,必然还有其他因素共同作用。
二、新生儿GBS疾病发病的危险因素1.妊娠相关因素:传统的流行病学研究主要围绕妊娠期孕妇以及妊娠结局对新生儿GBS相关疾病发生的影响。对于GBS-EOD,首当其冲的危险因素是孕妇生殖道的GBS定植,即通过阴道分泌物的采集能够检测到GBS的存在[9];其次,孕妇在妊娠期间菌尿、早产儿、绒毛膜羊膜炎、妊娠期高热、> 18 h的胎膜早破(premature rupture of membranes)[10]、孕妇GBS抗体滴度低[11]以及之前妊娠的新生儿中有GBS疾病史等均为确认的危险因素[3]。有学者认为,生殖道定植的GBS对绒毛膜的吸附及穿透力强,因而能够上行感染胎膜,通过炎症细胞的吞噬作用及细菌产生的蛋白水解酶的直接侵袭,使胎膜局部张力减低,从而导致胎膜早破[5]。但同时,胎膜早破增加了新生儿与产道内GBS接触的机会,胎膜早破被认为是新生儿GBS感染的危险因素之一[12],即可认为胎膜早破是阴道GBS定植与新生儿GBS疾病发病的一个中介变量,但产道内GBS感染与胎膜早破的因果关系尚未被证实。Valkenburg-Van Den Berg等[13]的Meta分析结果提示,孕妇阴道内GBS定植与早产的关系仍不明确,但早产儿免疫力较低可能是新生儿GBS定植并引发感染的危险因素[14]。
应该注意到,Heath等[15]的研究发现约42%的GBS-EOD病例发生在出生时健康的足月儿中,且大部分GBS-LOD患儿没有上述提到的任何危险因素。所以用这些危险因素去预测新生儿GBS相关疾病的发生,特别是在个体水平,显然是不够的。
2.病原体因素:Berardi等[6]认为孕妇的GBS细菌载量是新生儿感染GBS并且发病的主要影响因素之一,不能单纯地以孕妇是否感染GBS作为危险因素。其次,血清学的研究发现,GBS共有Ⅰa、Ⅰb、Ⅰ~Ⅸ10种血清分型。在GBS-EOD患者中,GBS以Ⅰa、Ⅰb、Ⅱ、Ⅲ和Ⅴ型较为常见;在GBS-LOD和脑膜炎患者中,Ⅲ型较为常见[16]。GBS的毒力与荚膜多糖抗原、脂磷壁酸、神经氨酸酶等有关,而荚膜多糖的多样性可能是其躲避机体免疫系统,从而致病的原因[3, 17]。通过高通量测序对GBS的基因序列分析发现,GBS可分为CC1、CC10、CC17、CC19、CC23、CC26六种致病株,其中CC17是新生儿GBS脑膜炎的主要致病株,但对成年人的致病性较为少见[18]。因此,感染不同的菌株及不同的细菌载量可能是新生儿GBS感染者是否发病的主要因素。
许苏容[19]研究提示,GBS感染会导致阴道菌群失衡,改变阴道菌群结构。阴道菌群结构的改变与不良妊娠结局有关[20]。但这样阴道菌群改变是否是后期新生儿GBS相关疾病的发病危险因素,尚不明确。GBS与其他细菌(包括正常菌群与致病菌)以及阴道常见的病原体(如HPV、支原体、衣原体等)的相互作用值得进一步研究。
3.宿主免疫学因素:流行病学研究关注于环境因素,没有考虑到宿主(即新生儿自身)的情况。在细胞实验和小鼠动物模型中发现,GBS感染过程中,TLR和IL-1受体在细菌清除、TNF介导的炎症反应、感染性休克、小胶质细胞激活、神经病变等生化反应中起着主导作用[21-22]。Cusumano等[23]、Mancuso等[24]的研究提示IL-6、10、12、18等细胞因子也会随着GBS的感染而被激活。然而,对于细胞因子的研究更多采用的是体外或者动物实验,对于复杂的人体情况,细胞因子的特异性往往较差,难以说明某些因子水平的变化是由于GBS感染还是其他因素导致的。
有学者认为孕妇在妊娠期激素水平的变化会导致机体免疫状况改变,从而影响GBS的定植和感染状态,这种状态与新生儿GBS定植关系密切[5]。Freitas等[25]通过研究发现,女性在妊娠期阴道菌群丰度有所降低,但是乳酸菌含量增加,其中一个可能的因素是妊娠期女性雌激素水平的变化从而导致机体免疫水平变化。妊娠期阴道菌群和GBS定植的关系尚不明确,有待进一步研究[19]。近年来,有研究提示作为妊娠期特异性的人体绒毛膜促性腺激素(human chorionic gonadotropin,HCG)与免疫系统有密切的关系,可作为抗免疫排斥的因子进一步研究[26]。Koldehoff等[27]研究发现HCG可以降低IL-17水平,而增加IL-27和IL-10因子水平。其次,妊娠期甲状腺激素、雌激素、孕激素水平均有不同程度的变化,其与免疫力的关系,有待进一步研究。
近年研究发现在严重病原体感染的成年人或者婴儿中,存在一种抗细胞因子“自身抗体”(neutralizing anticytokine auto-Abs),能够抑制一些免疫因子的产生,从而“助长”某些特定病原体的感染[28]。例如抗IL-17和抗IL-22“自身抗体”与黏膜和皮肤念珠菌感染有关,抗IL-6“自身抗体”与皮肤感染有关[29]。而这种“自身抗体”的出现很可能与单基因缺陷有关[3]。但是这种“自身抗体”与GBS的感染关系暂无研究。Borghesi等[3]猜测孕妇体内的“自身抗体”存在可能是GBS其生殖道定植、乳腺炎的危险因素,且这种“抗体”能够通过胎盘垂直传播给新生儿,由于新生儿免疫系统尚未发育健全,当其接触到GBS时,会引发更为严重的GBS相关疾病。这在一定程度上解释了垂直传播的分子机制。但该假说尚未得到实验证实。
4.宿主基因缺陷:近年来研究发现,单基因缺陷可能导致新生儿免疫缺陷疾病(primary immunodeficiencies,PIDs),使其更易于被病原体感染。传统的PIDs是以单基因缺陷为主的典型的孟德尔遗传病。例如MYD88、IRAK4基因缺陷可能导致机体多细菌易感[30];IL-12/IFN-γ环相关基因缺陷可能导致机体分歧杆菌易感[31];TLR3相关基因缺陷可能是单纯疱疹病毒脑炎的危险因素[32];在新生儿中,IFIH1基因突变可能增加其呼吸系统的RNA病毒易感性,从而导致肺炎、支气管炎等[33]。包括“自身抗体”也有可能是单基因缺陷引起的。然而,目前仍无证据提示GBS相关疾病的发生是否与PIDs有关,但可以推测免疫相关的基因缺陷可能导致新生儿免疫力下降,引起各种机会致病菌致病的机会增加。
Borghesi等[3]运用Alcaïs等[34]在2010年提出的“新生儿感染性疾病的单基因缺陷模型”,构造新生儿GBS相关疾病的“基因贡献”模型(human genetic architecture of infections),图 1。
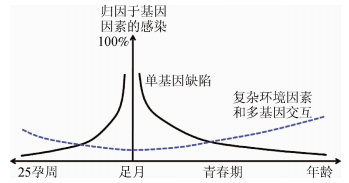
|
| 图 1 新生儿感染性疾病“基因贡献”模型 |
单基因缺陷主要指的是传统的PIDs复杂环境因素包括孕妇生殖道GBS定植、母亲乳腺炎、生活习惯、其他基础疾病、GBS细菌株不同、细菌载量等。这个假说认为,在新生儿及婴幼儿时期,GBS感染且发病的主要原因是单基因缺陷引起的免疫缺陷。随着年龄的增长和身体发育,感染性疾病的发生原因将更加复杂,基因与社会环境因素的交互作用更加明显,且出生前后这样的关系呈现镜面对称,即妊娠早期感染性疾病受环境和多基因交互作用的影响更大,而在妊娠后期,感染发生的主要原因是PIDs[3]。
三、总结与展望许多机会致病菌在人群中的感染率往往较高,但却没有临床症状,如GBS、支原体、大肠埃希菌等。但在某些特定的环境中,这些病原体感染却会导致严重的后果,如新生儿GBS败血症和GBS脑炎,支原体脑炎等,可能造成严重的预后不良,甚至威胁新生儿的生命。目前虽然有较为准确的检测技术诊断母婴是否携带GBS,但对于携带状态与感染的区分,以及如何有针对地治疗GBS感染仍然存争议,主要是对于新生儿GBS相关疾病的发病病因暂不明确。目前的研究提示其发病与不良妊娠结局、细菌菌株、宿主免疫水平以及宿主基因型有关,但这四者之间的主次关系和相互作用仍不明确。“基因贡献”模型假说在一定程度上整合了四方面的因素,解释了新生儿GBS疾病发生的两个矛盾现象:①在健康、足月且没有相关危险因素的新生儿中,GBS相关疾病仍然会发生;②许多新生儿有GBS定植,但是却没有发病。这样的假说是否成立,仍需要进一步的研究加以证实。
利益冲突: 无
| [1] |
苏锦珍, 吴伟元, 丁璐, 等. 围生期孕产妇感染或定植的B族链球菌耐药情况、血清型、毒力基因及基因型分析[J]. 中华妇幼临床医学杂志:电子版, 2016, 12(5): 583–589.
Su JZ, Wu WY, Ding L, et al. Drug resistance, serotypes, virulence-associated genes and genotypes of infection or colonization of group B streptococcus in perinatal pregnant women[J]. Chin J Obstet Gynecol Pediatr:Electron Ed, 2016, 12(5): 583–589. DOI:10.3877/cma.j.issn.1673-5250.2016.05.017 |
| [2] |
宋丹, 张亚昱, 梅花. B族链球菌感染与早产儿相关性研究进展[J]. 临床儿科杂志, 2015, 33(12): 1065–1067.
Song D, Zhang YY, Mei H. Progress in research of group B streptococcus infection and premature birth[J]. J Chin Pediatr, 2015, 33(12): 1065–1067. DOI:10.3969/j.issn.1000-3606.2015.12.016 |
| [3] | Borghesi A, Stronati M, Fellay J. Neonatal Group B streptococcal disease in otherwise healthy infants:failure of specific neonatal immune responses[J]. Front Immunol, 2017, 8(4): 215. DOI:10.3389/fimmu.2017.00215 |
| [4] | Edmond KM, Kortsalioudaki C, Scott S, et al. Group B streptococcal disease in infants aged younger than 3 months:systematic review and meta-analysis[J]. Lancet, 2012, 379(9815): 547–556. DOI:10.1016/S0140-6736(11)61651-6 |
| [5] | Vornhagen J, Adams Waldorf K M, Rajagopal L. Perinatal group B streptococcal infections:virulence factors, immunity, and prevention strategies[J]. Trends Microbiol, 2017, 25(1): 919–931. DOI:10.1016/j.tim.2017.05.013 |
| [6] | Berardi A, Rossi C, Lugli L, et al. Group B streptococcus late-onset disease:2003-2010[J]. Pediatrics, 2013, 131(2): e361–368. DOI:10.1542/peds.2012-1231 |
| [7] |
杨欢欢, 李菁. 新生儿无乳链球菌败血症合并脑膜炎12例临床分析[J]. 临床儿科杂志, 2016, 34(3): 181–184.
Yang HH, Li J. Clinical and prognostic analysis of sepsis caused by Streptococcus agalactiae combined with purulent meningitis in 12 neonates[J]. J Chin Pediatr, 2016, 34(3): 181–184. DOI:10.3969/j.issn.1000-3606.2016.03.006 |
| [8] | Verani JR, McGee L, Schrag SJ. Prevention of perinatal group B streptococcal disease: revised guidelines from CDC(US), 2010[EB/OL]. MMWR. (2017-05-10)[2017-06-10]. https://www.cdc.gov/mmwr/preview/mmwrhtml/rr5910a1.htm. |
| [9] |
林新祝, 吴健宁, 张雪芹, 等. 晚孕期阴道B族链球菌定植与新生儿感染的关系[J]. 中华围产医学杂志, 2016, 19(7): 491–496.
Lin XZ, Wu JN, Zhang XQ, et al. Relationship between group B streptococcus colonization in late pregnancies and neonatal infection[J]. Chin J Perinat Med, 2016, 19(7): 491–496. DOI:10.3760/cma.j.issn.1007-9408.2016.07.003 |
| [10] | Shane AL, Stoll BJ. Neonatal sepsis:progress towards improved outcomes[J]. J Infect, 2014, 68(Suppl 1): S24–32. DOI:10.1016/j.jinf.2013.09.011 |
| [11] | Baker CJ, Carey VJ, Rench MA, et al. Maternal antibody at delivery protects neonates from early onset group B streptococcal disease[J]. J Infect Dis, 2014, 209(5): 781–788. DOI:10.1093/infdis/jit549 |
| [12] |
彭兰, 柴利强, 陈大立, 等. 预防胎膜早破孕妇B族链球菌感染的临床方案效果分析[J]. 国际生殖健康/计划生育杂志, 2016, 35(5): 387–389.
Peng L, Chai LQ, Chen DL, et al. Effectiveness of clinical protocol for prevention of group B streptococcal infection in women with premature rupture of membranes[J]. J Int Reprod Health/Fam Plan, 2016, 35(5): 387–389. |
| [13] | Valkenburg-Van Den Berg AW, Sprij AJ, Dekker FW, et al. Association between colonization with group B streptococcus and preterm delivery:A systematic review[J]. Acta Obstetr Gynecol Scandin, 2009, 88(9): 958–967. DOI:10.1080/00016340903176800 |
| [14] | Collado MC, Cernada M, Neu J, et al. Factors influencing gastrointestinal tract and microbiota immune interaction in preterm infants[J]. Pediat Res, 2015, 77(6): 726–731. DOI:10.1038/pr.2015.54 |
| [15] | Heath PT, Balfour G, Weisner AM, et al. Group B streptococcal disease in UK and Irish infants younger than 90 days[J]. Lancet, 2004, 363(9405): 292–294. DOI:10.1016/S0140-6736(03)15389-5 |
| [16] | Alhhazmi A, Hurteau D, Tyrrell GJ. Epidemiology of invasive group B streptococcal disease in Alberta, Canada, from 2003 to 2013[J]. J Clin Microbiol, 2016, 54(7): 1774–1781. DOI:10.1128/JCM.00355-16 |
| [17] |
高坎坎, 钟华敏, 梁绮华, 等. B族链球菌相关疫苗的研究进展[J]. 中华妇幼临床医学杂志:电子版, 2017, 13(1): 116–119.
Gao KK, Zhong HM, Liang QH, et al. Research progress on group B streptococcal vaccines[J]. Chin J Obstet Gynecol Pediatr:Electron Ed, 2017, 13(1): 116–119. DOI:10.3877/cma.j.issn.1673-5250.2017.01.022 |
| [18] | Tazi A, Bellais S, Tardieux I, et al. Group B streptococcus surface proteins as major determinants for meningeal tropism[J]. Curr Opin Microbiol, 2012, 15(1): 44–49. DOI:10.1016/j.mib.2011.12.002 |
| [19] |
许苏容. 第二代高通量测序分析VVC及BV患者阴道菌群多样性[D]. 广州: 南方医科大学, 2013. DOI: 10.7666/d.Y2405572.
Xu SR. The next generation high throughput sequencing reveals diverse vaginal microbiomes associated with bacterial vaginosis or vulvovaginal candidiasis[D]. Guangzhou: Southern Medical University, 2013. DOI: 10.7666/d.Y2405572. |
| [20] |
何一宁, 熊海燕, 郑英杰. 阴道乳杆菌与早产关系的研究进展[J]. 中华流行病学杂志, 2017, 38(3): 406–410.
He YN, Xiong HY, Zheng YJ. Progress in research of relationship between vaginal Lactobacillus and preterm delivery[J]. Chin J Epidemiol, 2017, 38(3): 406–410. DOI:10.3760/cma.j.issn.0254-6450.2017.03.026 |
| [21] | Costa A, Gupta R, Signorino G, et al. Activation of the NLRP3 inflammasome by group B streptococci[J]. J Immunol, 2012, 188(4): 1953–1960. DOI:10.4049/jimmunol.1102543 |
| [22] | Biondo C, Mancuso G, Midiri A, et al. Essential role of interleukin-1 signaling in host defenses against group B streptococcus[J]. MBio, 2014, 5(5): e1428–14. DOI:10.1128/mBio.01428-14 |
| [23] | Cusumano V, Midiri A, Cusumano VV, et al. Interleukin-18 is an essential element in host resistance to experimental group B streptococcal disease in neonates[J]. Infect Immun, 2004, 72(1): 295–300. DOI:10.1128/IAI.72.1.295-300.2004 |
| [24] | Mancuso G, Cusumano V, Genovese F, et al. Role of interleukin 12 in experimental neonatal sepsis caused by group B streptococci[J]. Infect Immun, 1997, 65(9): 3731–3735. |
| [25] | Freitas AC, Chaban B, Bocking A, et al. The vaginal microbiome of pregnant women is less rich and diverse, with lower prevalence of Mollicutes, compared to non-pregnant women[J]. Sci Rep, 2017, 7(1): 9212. DOI:10.1038/s41598-017-07790-9 |
| [26] | Theofanakis C, Drakakis P, Besharat A, et al. Human chorionic gonadotropin:the pregnancy hormone and more[J]. Int J Mol Sci, 2017, 18(5): 1059. DOI:10.3390/ijms18051059 |
| [27] | Koldehoff M, Katzorke T, Wisbrun NC, et al. Modulating impact of human chorionic gonadotropin hormone on the maturation and function of hematopoietic cells[J]. J Leukoc Biol, 2011, 90(5): 1017–1026. DOI:10.1189/jlb.0910520 |
| [28] | Puel A, Döffinger R, Natividad A, et al. Autoantibodies against IL-17A, IL-17F, and IL-22 in patients with chronic mucocutaneous candidiasis and autoimmune polyendocrine syndrome type Ⅰ[J]. J Exp Med, 2010, 207(2): 291–297. DOI:10.1084/jem.20091983 |
| [29] | Bousfiha A, Jeddane L, Al-Herz W, et al. The 2015 IUIS phenotypic classification for primary immunodeficiencies[J]. J Clin Immunol, 2015, 35(8): 727–738. DOI:10.1007/s10875-015-0198-5 |
| [30] | Casanova JL, Abel L. Primary immunodeficiencies:a field in its infancy[J]. Science, 2007, 317(5838): 617–619. DOI:10.1126/science.1142963 |
| [31] | Bousfiha A, Picard C, Boisson-Dupuis S, et al. Primary immunodeficiencies of protective immunity to primary infections[J]. Clin Immunol, 2010, 135(2): 204–209. DOI:10.1016/j.clim.2010.02.001 |
| [32] | Bustamante J, Boisson-Dupuis S, Jouanguy E, et al. Novel primary immunodeficiencies revealed by the investigation of paediatric infectious diseases[J]. Curr Opin Immunol, 2008, 20(1): 39–48. DOI:10.1016/j.coi.2007.10.005 |
| [33] | Asgari S, Schlapbach LJ, Anchisi S, et al. Severe viral respiratory infections in children with IFIH1 loss-of-function mutations.[J]. Proc Natl Acad Sci USA, 2017, 114(31): 8342–8347. DOI:10.1073/pnas.1704259114 |
| [34] | Alcaïs A, Quintana-Murci L, Thaler DS, et al. Life-threatening infectious diseases of childhood:single-gene inborn errors of immunity?[J]. Ann N Y Acad Sci, 2010, 1214(1): 18–33. DOI:10.1111/j.1749-6632.2010.05834.x |
 2018, Vol. 39
2018, Vol. 39


