文章信息
- 段鹭茜, 李杏莉, 胡佩武, 罗芮, 罗希, 陈颖怡.
- Duan Luxi, Li Xingli, Hu Peiwu, Luo Rui, Luo Xi, Chen Yingyi.
- DRD2基因多态性与美沙酮维持治疗剂量的关联性研究
- Association between DRD2 gene polymorphisms and the dosage used on methadone maintenance treatment program
- 中华流行病学杂志, 2018, 39(2): 194-198
- Chinese Journal of Epidemiology, 2018, 39(2): 194-198
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2018.02.011
-
文章历史
收稿日期: 2017-08-10
2. 410008 长沙, 中南大学湘雅医院科研部
2. Department of Scientific Research, Xiangya Hospital, Central South University, Changsha 410008, China
阿片类物质依赖给患者的身心健康、家庭以及社会带来巨大影响, 已成为重大公共卫生问题。美沙酮作为阿片类物质依赖的维持治疗药物, 可通过模拟内源性阿片肽并影响体内多巴胺等其他神经递质, 以减轻戒断症状, 减少觅药行为, 从而改善患者的生活质量[1]。
但美沙酮维持治疗的效果并不理想, 存在着高脱失率、高偷吸率、疗效个体差异大的现象[2-3]。多项研究均表明[4-5], 确定个体所需的美沙酮维持治疗剂量对降低脱失率有着至关重要的影响。且基因的多态性可通过影响美沙酮的药物代谢、信号转导过程导致药物反应的个体差异[6-7], 故近来美沙酮代谢、转运过程相关的基因受到了广泛的关注。多巴胺环路构成的奖赏通路是物质成瘾的重要神经生物学基础, 海洛因等多种成瘾物质均通过作用于患者中脑边缘的多巴胺能神经元, 促使其突触间隙的多巴胺水平升高, 从而产生奖赏及觅药行为[8]。多巴胺D2受体基因(dopamine receptor D2gene, DRD2基因)其基因编码产物DRD2受体作为多巴胺的主要受体, 在多巴胺奖赏通路中发挥着重要的作用, 因此DRD2基因也成为阿片类物质依赖以及美沙酮维持治疗等相关研究的重要候选基因。但目前美沙酮维持治疗剂量需求的研究多限于国外[9-10], 国内相关研究较为少见。本研究针对中国人群中DRD2基因的3个单核苷酸多态性(single nucleotide polymorphism, SNP)位点(rs1800497、rs6275和rs1799978)与美沙酮维持治疗剂量之间的关联性进行探讨。
对象与方法1.研究对象:湖南省开设的美沙酮维持治疗门诊中随机抽取6所(长沙市天心区CDC、长沙市自愿戒毒中心、益阳市第五人民医院、邵阳市精神病医院、娄底市CDC、怀化市溆浦县CDC)作为研究现场。选择2013年2-8月期间参与治疗且符合纳入标准的门诊患者作为研究对象。纳入标准:符合美国DSM-Ⅳ阿片类物质依赖诊断标准; 接受美沙酮维持治疗≥2个月且进入剂量稳定期; 服用美沙酮期间无其他合并用药; 签署知情同意书。排除标准:患有其他严重器质性疾病或精神疾病者; 孕妇或哺乳期女性。所有研究对象随访观察6个月, 定期测量受试者治疗反应。
2.样本量的估算:使用Quanto 1.2.4软件估算样本量, 本研究所选取的SNPs位点中, rs1799978的最小等位基因频率最低为0.199, 根据文献[11]可知, 我国美沙酮维持治疗的高剂量者(≥90 mg/d)约占总体的30.5%, 即P0=0.305。按照OR=2.5, α=0.05, 1-β=0.8, 样本量至少为180人。
3.治疗结局的判定:“治疗反应好”:①治疗期间未使用其他违禁药品(自我报告未偷吸且多次随机尿检阳性结果次数<2次); ②自述无戒断症状; ③治疗期间有稳定的治疗频率及剂量。“治疗反应差”:①治疗期间自我报告有偷吸海洛因等违禁药品, 或≥2次随机尿检结果为阳性; ②自述有明显的戒断症状; ③无稳定的治疗频率及剂量。
4.治疗剂量分组:将美沙酮维持治疗反应结合稳定剂量进行分组, 分为低剂量对照组和高剂量病例组。我国美沙酮维持治疗稳定剂量<60 mg/d者占总体的37.1%, 稳定剂量≥90 mg/d的治疗者占30.5%[11]。具体分组:①低剂量对照组即稳定剂量≤60 mg/d且对治疗反应好者; ②高剂量病例组即稳定剂量≥90 mg/d且对治疗反应差或反应好者。
5.资料的收集:采用病例对照研究设计。研究对象的社会人口学特征、吸毒情况等通过社区药物维持治疗评估调查表由调查员进行资料收集。美沙酮维持治疗情况从门诊电子病历导出, 其内容包括服药剂量、戒断症状等。
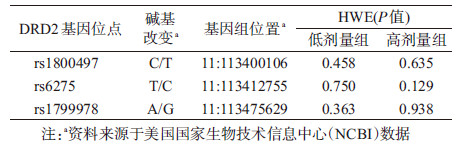
6.SNPs的筛选:将NCBI的dbSNP数据库中国北京汉族数据库作为数据源头, 按照以下原则进行SNPs的筛选:最小等位基因频率(MAF)>0.1;经查阅相关文献, SNPs已被证实与美沙酮治疗或海洛因成瘾相关。
7.DRD2基因多态性位点的测量:入组时在美沙酮维持治疗门诊, 用EDTA抗凝真空采血管采集空腹外周静脉血5 ml, 使用DP318-03血液基因组DNA提取试剂盒Relax Gene Blood DNA System(北京天根生化科技有限公司)提取研究对象的基因组DNA。使用多重PCR技术和Mass ARRAY i PLEX单碱基延伸技术对目标基因扩增后, 借助基质辅助激光解吸附电离飞行时间质谱(MALDI-TOF-MS)分析技术进行SNP基因分型。
8.统计学分析:运用SPSS 22.0软件进行统计分析, 连续性变量用t检验或Mann-Whitney U检验进行组间均值的比较; 分类变量用χ2检验或Fisher精确检验进行组间率的比较。采用多因素logistic回归分析美沙酮维持治疗剂量与DRD2基因多态性之间的关联。运用SHEsis在线软件(http://analysis.bio-x.cn/myAnalysis.php)对DRD2基因型分布进行H-W平衡检验[12]。采用双侧检验, P<0.05判断差异有统计学意义。
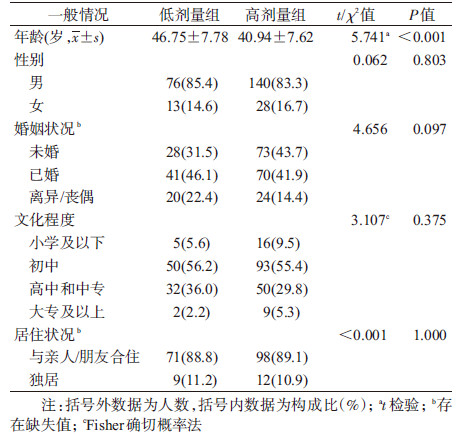
结果1.一般情况:共纳入研究对象257人, 男性216人, 女性41人, 年龄26~65(42.95±8.15)岁。低剂量组89人, 年龄(46.75±7.78)岁, 男性76人, 女性13人; 高剂量组168人, 年龄(40.94±7.62)岁, 男性140人, 女性28人。年龄在不同治疗剂量组间分布的差异有统计学意义(t=5.741, P<0.001)。见表 1。
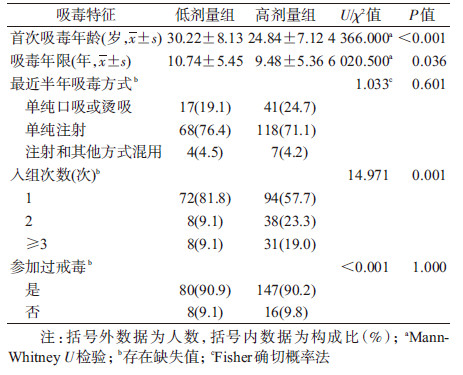
2.吸毒特征:在不同的美沙酮维持治疗剂量组间, 首次吸毒年龄(U=4 366.000, P<0.001)、吸毒年限(U=6 020.500, P=0.036)、入组次数(χ2=14.971, P=0.001)的差异有统计学意义。而最近半年吸毒方式(χ2=1.033, P=0.601)以及是否参加过戒毒(χ2<0.001, P=1.000)在组间的分布的差异无统计学意义。见表 2。
3.美沙酮维持治疗剂量水平:257名研究对象维持剂量最小值为15 mg/d, 最大值为280 mg/d, 低剂量组剂量为(47.53±11.73)mg/d, 高剂量组剂量为(107.53±23.32)mg/d。
4.H-W平衡检验:在不同治疗剂量组内DRD2基因rs1800497、rs6275以及rs1799978的基因型频率分布差异均无统计学意义, 提示本研究对象来源于随机婚配的源人群, 资料代表性好。见表 3。
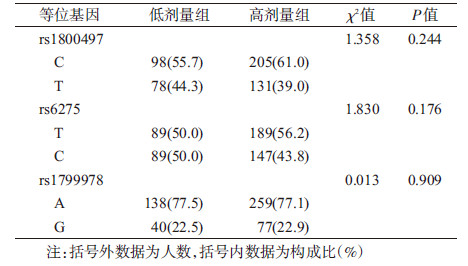
5.美沙酮维持治疗剂量与DRD2基因多态性的关联性分析:rs1800497、rs6257和rs1799978的等位基因在不同的治疗剂量组间的分布差异均无统计学意义。见表 4。
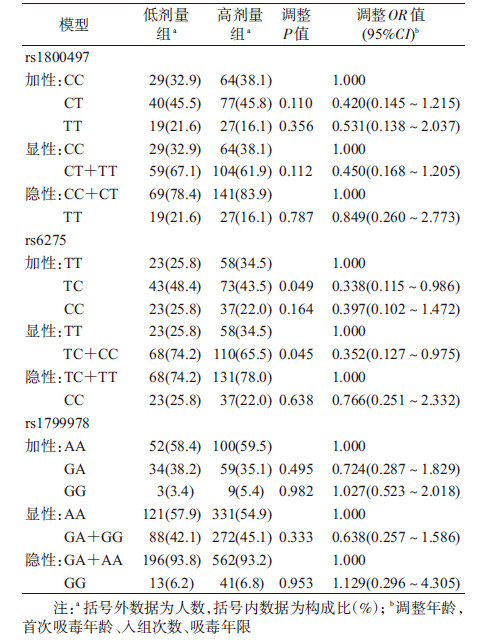
分别在各基因模型(加性、显性以及隐性模型)下对DRD2基因和美沙酮维持治疗剂量的关联性进行检验, 调整年龄、首次吸毒年龄、入组次数、吸毒年限后, rs6275位点在加性模型、显性模型下, 其基因型在不同治疗剂量组间的分布差异有统计学意义。rs6275 TC基因携带者相较于TT基因携带者需要更高的美沙酮维持剂量的风险较低(OR=0.338, 95%CI:0.115~0.986);TC+CC基因型携带者相较于TT基因型携带者, 需要更高的美沙酮维持剂量的风险更低(OR=0.352, 95%CI:0.127~0.975)。尚未发现其他的多态性位点在不同的基因模型之下与美沙酮维持剂量有关联。见表 5。
美沙酮有效治疗剂量范围较广[13], 考虑到遗传因素对治疗剂量的影响, 探讨基因多态性与美沙酮剂量的关联性, 开展个体化治疗已经逐步成为研究的焦点。DRD2受体作为多巴胺的主要受体, 也是物质滥用奖赏效应的关键受体, 其编码基因-DRD2基因可能通过影响多巴胺奖赏通路从而对美沙酮维持治疗的剂量造成影响。涉及DRD2基因的成瘾相关研究多集中于rs1800497, 曾有研究发现rs1800497位点的T等位基因携带者的纹状体内DRD2受体密度较低[14], 提示该等位基因携带者可能会通过使用阿片类物质或需求更高剂量的美沙酮以升高脑内的多巴胺水平从而补偿天生的低奖赏状态。此外, DRD2基因的其他多态性位点也有受到研究者关注的, 如Duan等[15]发现rs6275位点的T等位基因与多巴胺表达水平降低相关; Morton等[16]发现rs1799978位点与尼古丁物质滥用相关。
本研究探讨了DRD2基因多态性(rs1800497、rs6257以及rs1799978)与美沙酮维持治疗剂量之间的关联性。结果显示, rs6275与治疗剂量之间存在关联。调整年龄、首次吸毒年龄、入组次数、吸毒年限之后, 不同剂量组间的rs6275位点的基因型分布差异有统计学意义。rs6275 TC基因携带者需要更高的美沙酮治疗剂量的风险是TT基因携带者的0.338倍, TC+CC基因型携带者需要更高的美沙酮治疗剂量的风险是TT基因型携带者的0.352倍。尚未发现DRD2基因rs1800497及rs1799978与美沙酮维持治疗剂量有关联。
以上结果与之前研究结论不完全一致。Hung等[17]在台湾地区治疗患者中发现DRD2基因多态性位点rs6275、rs1799978与美沙酮维持治疗剂量相关联, 并未发现rs1800497多态性与治疗剂量的相关性, 携带rs6275位点T等位基因的患者相较于未携带T等位基因患者所需的治疗剂量更低(OR=0.50, 95%CI:0.32~30.76)。Doehring等[18]对85名高加索美沙酮维持治疗患者进行研究后得出了不同的结论, 受试者中rs6275位点CC基因型携带者相较于T等位基因携带者所需剂量更低, 未发现rs1800497、rs1799978多态性与美沙酮治疗剂量的相关性。提示DRD2基因rs6275位点多态性可能与美沙酮治疗剂量有关联, 但具体关联仍有争议。上述研究结果存在差异可能由于研究涉及的种群不同, 种群之间遗传变异的差异性较大。且不同研究的剂量分组也大相径庭, 这也可能导致研究结果的不一致。
本研究存在不足。鉴于海洛因成瘾是一个受多基因影响的复杂疾病, 多基因之间的交互作用可能对美沙酮治疗的剂量需求造成影响, 研究中尚未考虑其他基因与DRD2基因之间的交互作用对美沙酮治疗剂量的影响, 可能导致混杂偏倚。
综上所述, 本研究结果初步提示DRD2基因rs6275位点多态性与美沙酮维持治疗的剂量需求存在关联, 尚未发现rs1800497及rs1799978与治疗剂量的关联性。
利益冲突: 无
| [1] | Lobmaier P, Gossop M, Waal H, et al. The pharmacological treatment of opioid addiction-a clinical perspective[J]. Eur J Clin Pharmacol, 2010, 66(6): 537–545. DOI:10.1007/s00228-010-0793-6 |
| [2] | Bell J, Burrell T, Indig D, et al. Cycling in and out of treatment; participation in methadone treatment in NSW, 1990-2002[J]. Drug Alcohol Depend, 2006, 81(1): 55–61. DOI:10.1016/j.drugalcdep.2005.05.010 |
| [3] | Ren JM, Ning Z, Asche CV, et al. Trends and predictors in methadone maintenance treatment dropout in Shanghai, China:2005-2011[J]. Curr Med Res Opin, 2013, 29(7): 731–738. DOI:10.1185/03007995.2013.796284 |
| [4] | Baumeister M, Vogel M, Dürsteler-Macfarland KM, et al. Association between methadone dose and concomitant cocaine use in methadone maintenance treatment:a register-based study[J]. Subst Abuse Treat Prev Policy, 2014, 9(1): 46. DOI:10.1186/1747-597X-9-46 |
| [5] | Booth RE, Corsi KF, Mikulich-Gilbertson SK. Factors associated with methadone maintenance treatment retention among street-recruited injection drug users[J]. Drug Alcohol Depend, 2004, 74(2): 177–185. DOI:10.1016/j.drugalcdep.2003.12.009 |
| [6] | Levran O, Peles E, Randesi M, et al. Association of genetic variation in pharmacodynamic factors with methadone dose required for effective treatment of opioid addiction[J]. Pharmacogenomics, 2013, 14(7): 755–768. DOI:10.2217/pgs.13.58 |
| [7] |
罗芮, 冯湘玲, 罗希, 等. β-arrestin2基因多态性与湖南省汉族海洛因成瘾者美沙酮维持治疗反应的关联分析[J]. 中华流行病学杂志, 2016, 37(6): 872–875.
Luo R, Feng XL, Luo X, et al. Association between β-arrestin2 genetic polymorphism and response to methadone maintenance treatment in heroin-dependent patients in Han population in Hunan province[J]. Chin J of Epidemiol, 2016, 37(6): 872–875. DOI:10.3760/cma.j.issn.0254-6450.2016.06.026 |
| [8] | Dackis C, O'Brien C. Neurobiology of addiction:treatment and public policy ramifications[J]. Nat Neurosci, 2005, 8(11): 1431–1436. DOI:10.1038/nn1105-1431 |
| [9] | Levran O, O'Hara K, Peles E, et al. ABCB1(MDR1) genetic variants are associated with methadone doses required for effective treatment of heroin dependence[J]. Hum Mol Genet, 2008, 17(14): 2219–2227. DOI:10.1093/hmg/ddn122 |
| [10] | Mouly S, Bloch V, Peoc'h K, et al. Methadone dose in heroin-dependent patients:role of clinical factors, comedications, genetic polymorphisms and enzyme activity[J]. Br J Clin Pharmacol, 2015, 79(6): 967–977. DOI:10.1111/bcp.12576 |
| [11] | Marienfeld C, Liu PL, Wang X, et al. Evaluation of an implementation of methadone maintenance treatment in China[J]. Drug Alcohol Depend, 2015, 157: 60–67. DOI:10.1016/j.drugalcdep.2015.10.001 |
| [12] |
陶金辉, 唐江平, 程苗, 等. P2X7R基因rs1621388多态性与痛风易感性的关联研究[J]. 中华疾病控制杂志, 2017, 21(7): 698–701.
Tao JH, Tang JP, Cheng M, et al. Study on the association between P2X7R gene rs1621388 polymorphism and gout susceptibility[J]. Chin J Dis Control Prev, 2017, 21(7): 698–701. DOI:10.16462/j.cnki.zhjbkz.2017.07.012 |
| [13] | Kreek MJ, Borg L, Ducat E, et al. Pharmacotherapy in the treatment of addiction:methadone[J]. J Addict Dis, 2010, 29(2): 200–216. DOI:10.1080/10550881003684798 |
| [14] | Pohjalainen T, Rinne JO, Någren K, et al. The A1 allele of the human D2 dopamine receptor gene predicts low D2 receptor availability in healthy volunteers[J]. Mol Psych, 1998, 3(3): 256–260. DOI:10.1038/sj.mp.4000350 |
| [15] | Duan JB, Wainwright MS, Comeron JM, et al. Synonymous mutations in the human dopamine receptor D2(DRD2) affect mRNA stability and synthesis of the receptor[J]. Hum Mol Genet, 2003, 12(3): 205–216. DOI:10.1093/hmg/ddg055 |
| [16] | Morton LM, Wang SS, Bergen AW, et al. DRD2 genetic variation in relation to smoking and obesity in the prostate, lung, colorectal, and ovarian cancer screening trial[J]. Pharmacogenet Genomics, 2006, 16(12): 901–910. DOI:10.1097/01.fpc.0000230417.20468.d0 |
| [17] | Hung CC, Chiou MH, Huang BH, et al. Impact of genetic polymorphisms in ABCB1, CYP2B6, OPRM1, ANKK1 and DRD2 genes on methadone therapy in Han Chinese patients[J]. Pharmacogenomics, 2011, 12(11): 1525–1533. DOI:10.2217/pgs.11.96 |
| [18] | Doehring A, Hentig NV, Graff J, et al. Genetic variants altering dopamine D2 receptor expression or function modulate the risk of opiate addiction and the dosage requirements of methadone substitution[J]. Pharmacogenet Genomics, 2009, 19(6): 407–414. DOI:10.1097/FPC.0b013e328320a3fd |
 2018, Vol. 39
2018, Vol. 39