文章信息
- 司佳卉, 孟若谷, 余灿清, 郭彧, 卞铮, 谭云龙, 裴培, 陈君石, 陈铮鸣, 吕筠, 李立明, 代表中国慢性病前瞻性研究项目协作组.
- Si Jiahui, Meng Ruogu, Yu Canqing, Guo Yu, Bian Zheng, Tan Yunlong, Pei Pei, Chen Junshi, Chen Zhengming, Lyu Jun, Li Liming, for the China Kadoorie Biobank(CKB) Collaborative Group.
- 疾病家族史与冠心病发生风险的关联研究
- Family history and risk of coronary heart disease
- 中华流行病学杂志, 2018, 39(2): 173-178
- Chinese Journal of Epidemiology, 2018, 39(2): 173-178
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2018.02.007
-
文章历史
收稿日期: 2017-05-05
2. 100010 北京, 中国医学科学院;
3. 100020 北京, 国家食品安全风险评估中心;
4. 英国牛津大学
2. Chinese Academy of Medical Sciences, Beijing 100010, China; China National Center for Food Safety Risk Assessment, Beijing 100020, China;
3. Clinical Trial Service Unit and Epidemiological Studies Unit;
4. Nuffield Department of Population Health, University of Oxford, Oxford OX1 3QR, UK
2010年全球冠心病(coronary heart disease, CHD)死亡人数超过700万, 预测显示直到2020年, CHD将持续成为全球死亡的首位原因[1]。在人群中早期识别未来发病风险高的人群, 针对生活方式、基础疾病等采取有针对性的措施, 可以有效降低人群的CHD发病率[2]。其中, 通过收集家族史信息识别高危人群最为简单、快捷。早在2002年, 美国心脏病协会就建议将家族史信息的收集作为心血管疾病一级预防措施之一[3]。有阳性家族史者发生CHD的风险会显著升高[4-5], 但是不同一级亲属(亲生父亲、母亲或同胞)的疾病史对个体CHD发病风险的影响是否一致, 仍有争议[6-9]。另外, 个体的成年生活方式特征对家族史作用有无效应修饰作用也不明确[10-13]。CHD起病隐匿, 多数慢性CHD患者缺乏典型症状, 所以目前常用急性冠心病事件(major coronary events, MCE)进行病因学研究[14]。本研究利用中国慢性病前瞻性研究(China Kadoorie Biobank, CKB)的长期随访数据分析疾病家族史(种类、数量)对MCE和更广泛的缺血性心脏病(ischemic heart disease, IHD)发病风险的影响, 同时探究个体生活方式及基础疾病对二者之间关联的效应修饰作用。
对象与方法1.研究对象:CKB项目于2004-2008年在5个城市和5个农村项目地区招募调查对象并完成基线调查, 项目具体信息可参见文献[15-16]。排除基线时自报患有恶性肿瘤者2 577人、心脏病15 472人及脑卒中8 884人, 进一步排除父亲、母亲或同胞急性心肌梗死(acute myocardial infarction, AMI)病史缺失者1 707人及BMI信息缺失者2人, 基线调查完成后即失访者1人, 最终纳入485 784人进行分析。
2.研究内容:一般人口社会学信息(出生日期、项目地区、文化程度及婚姻状况)、生活方式特征(吸烟、饮酒、膳食及体力活动)、同胞数、女性绝经史、AMI家族史及个人疾病史信息(高血压、糖尿病、恶性肿瘤、CHD及脑卒中)通过调查员面对面询问获得。身高(身高仪)、腰围、臀围及体重(TANITA TBF-300GS体质构成分析仪)等体格指标由经过统一培训的调查员采用统一工具测量获得。测量指标读数分别以cm或kg为单位, 具体数值精确到0.1。
问卷调查中询问研究对象生父、生母及亲生兄弟姐妹是否有AMI病史, 上述一级亲属有任一人有AMI病史, 则认为该研究对象具有阳性家族史。进一步按照有AMI病史的亲属属性分为母亲病史、父亲病史及同胞病史(只要母亲患病即定义为母亲型, 其他同理), 将生父和/或生母有病史者定义为双亲病史。BMI(kg/m2)即体重(kg)与身高(m)平方的比值。腰围(cm)与臀围(cm)的比值为腰臀比。将基线自报患有糖尿病、现场抽血检测FPG≥7.0 mmol/L或随意血糖≥11.1 mmol/L者定义为现患糖尿病患者; 自报患有高血压、或平均SBP≥140 mmHg(1 mmHg=0.133 kPa)、或平均DBP≥90 mmHg或自报服用降压药物者定义为现患高血压患者。
发病信息通过当地的死亡和常规疾病监测系统、全民医疗保险数据库以及主动的定向监测获得。疾病分类采用国际疾病分类(International Classification of Diseases, ICD)第十版(ICD-10)。本研究结局:①MCE, 包括IHD(I20~I25)导致的死亡, 以及非致死性的心肌梗死(I21~I23);②IHD发病。
3.统计学分析:数据分析采用Stata 13.1软件, 使用双侧检验, 显著性水平为α=0.05。比较有无AMI家族史的研究对象的社会人口学特征、生活方式等分布, 连续型变量采用协方差分析, 分类变量采用logistic回归, 报告调整年龄、性别及地区后的均数或构成比。随访人年的计算从基线调查开始, 到出现研究结局、死亡、失访或2013年12月31日为止。采用Cox比例风险模型分析家族史与MCE和IHD发病风险间的关联, 以年龄作为时间尺度, 并按年龄(5岁一组)和项目地区(10个地区)分层, 计算控制了多种可能混杂因素的风险比(HR)及其95%CI。
进一步分析:①家族史与早发[17](男性<55岁, 女性<65岁)及晚发(男性≥55岁, 女性≥65岁)MCE、IHD的关联。②具有疾病史的亲属数量(1名, ≥2名)与MCE、IHD发病风险间的关联, 并以数量的连续变量形式进行线性趋势检验。③不同家族史类型(母亲、父亲或同胞病史)与MCE、IHD发病风险间的关联。另外, 分析性别、年龄、吸烟、饮酒、体力活动、BMI、腰臀比、现患糖尿病及高血压对家族史与MCE、IHD间关联的效应修饰作用; 采用似然比检验, 比较有交互项模型和无交互项模型的差异。
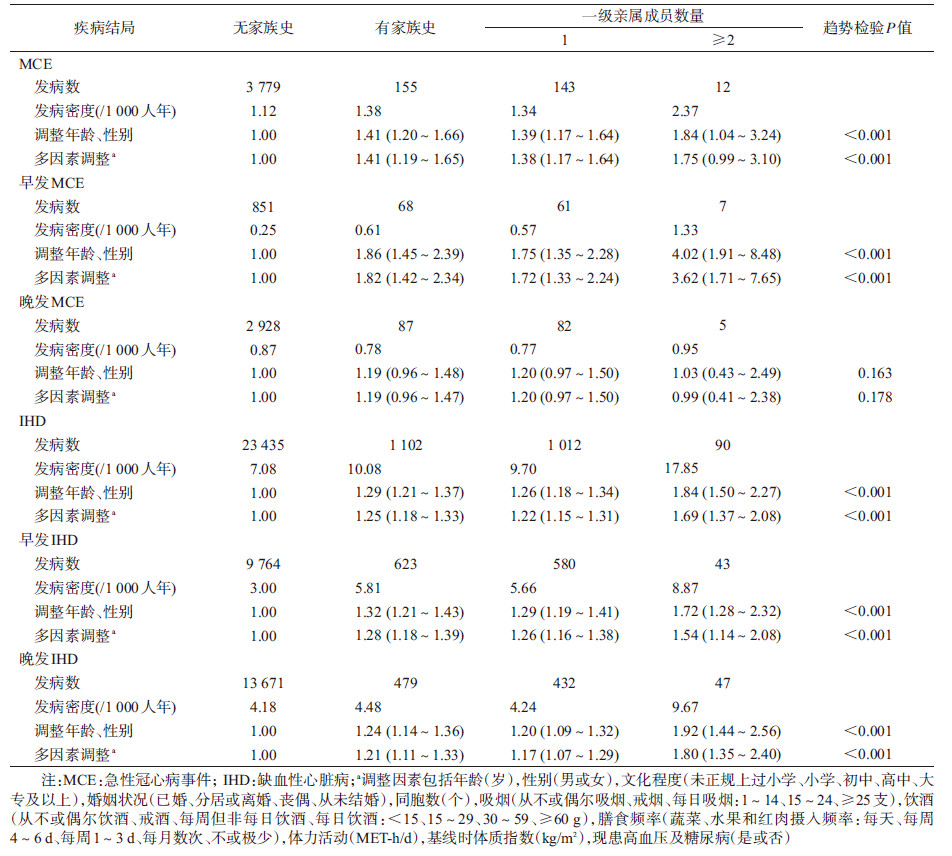
结果1.基本情况:共纳入分析485 784名研究对象, 年龄(51.0±10.5)岁, 15 386人(3.2%)有AMI家族史, 其中父亲、母亲或同胞有疾病史者分别为7 369、6 320和2 369人。仅1名亲属有疾病史者为14 658人, ≥2名为728人。调整年龄、性别及项目地区后, 有无AMI家族史研究对象的基本特征, 见表 1。总体来看, 与没有AMI家族史的研究对象相比, 有家族史者每日吸烟者更多, BMI更大, 且糖尿病、高血压患病率较高。
2.疾病家族史与冠心病的发生风险:研究对象随访M=7.2年, 随访期间共观察到新发MCE 3 934例, IHD 24 537例。多因素调整后(模型2), 与无家族史者相比, 有家族史者发生MCE和IHD的风险均较高, HR值(95%CI)分别为1.41(1.19~1.65)和1.25(1.18~1.33), 这种关联在男女性间差异无统计学意义(交互作用P>0.05), 见表 2。个体具有AMI病史的一级亲属越多, 发生MCE和IHD的风险越高(线性趋势检验均P<0.001)。另外, 以早发MCE为结局时发现家族史与早发MCE的关联更强, HR值(95%CI)为1.82(1.42~2.34);有≥2名一级亲属具有AMI病史时, 个体早发MCE的HR值为3.62(1.71~7.65);与双亲型家族史相比, 同胞型家族史与早发MCE的关联更强(图 1)。
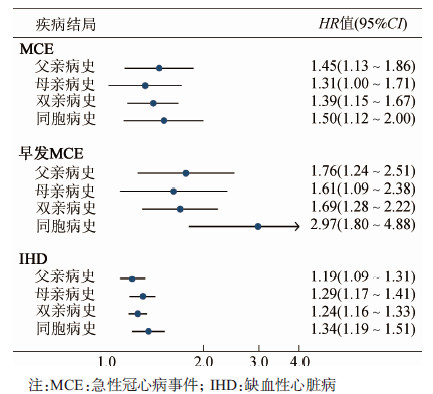
|
| 图 1 不同类型家族史与MCE及IHD的关联分析 |
亚组分析发现, 超重/肥胖者中家族史与MCE、IHD的关联更强, 吸烟者中家族史与MCE的关联更强。但未发现年龄、生活方式(饮酒、体力活动)及基础慢性病(糖尿病、高血压)对家族史与MCE及IHD间的关联存在效应修饰作用(图 2)。
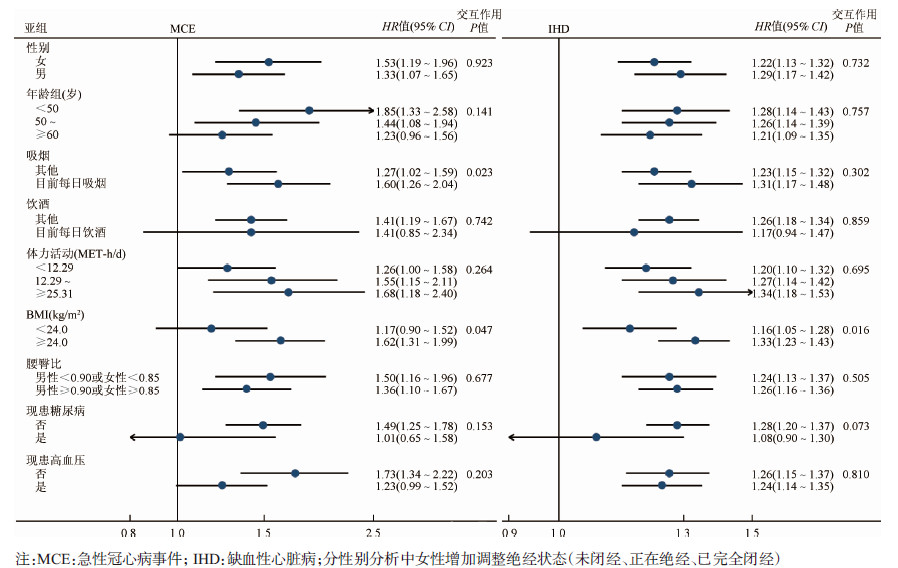
|
| 图 2 家族史与MCE及IHD关联的基线特征亚组分析 |
本研究利用覆盖我国10个地区近50万规模的人群随访数据, 分析AMI家族史与MCE及IHD间的关联。结果显示有家族史者发生MCE及IHD的风险比无家族史者分别高41%、25%。与双亲型家族史相比, 同胞型家族史与早发MCE的关联更强。研究中还发现, 有家族史者, 且超重肥胖或吸烟的个体, 未来发病风险更高。
本研究结果与既往研究基本一致。已有的队列研究集中于欧洲及美国, 关联效应值在1.2~4.3之间[18-21]。一项纳入1989-2012年26篇相关文章的Meta分析显示, 合并RR值(95%CI)为1.54(1.33~1.77)[6]。有研究发现, 研究对象具有AMI病史的一级亲属越多, 发生MCE的风险越高[7, 9, 22]。例如, 在芬兰开展的回顾性病例对照研究发现, 只有1名一级亲属有家族史时OR值(95%CI)为3.0(1.1~7.9), 而有≥2名时OR值(95%CI)为9.7(1.3~73.0)[22]。既往研究发现早发CHD的家族聚集性更强[23-24], 与本研究结果一致。这可能是因为随着年龄的增长, 个体成年期生活方式等环境因素产生的影响不断累积。相对于晚发CHD, 早发CHD中遗传因素所占的比重更大。
部分研究者认为同胞型家族史与双亲型家族史相比, 除了遗传背景外, 还能更多的反映家庭共同生活环境、子宫内及儿童早期教养环境; 因此, 同胞型家族史与疾病的关联可能强于双亲型[25]。既往有一些结局为心血管疾病的研究证实了这一观点[26-27], 但是也有一些研究并未发现二者之间有明显差异[7, 9, 28-29]。除此之外, 有研究发现由于线粒体效应及子宫内环境等因素, 母亲型家族史对CHD的预测作用比父亲型家族史更强[27, 30], 但是Meta分析结果显示两者差异无统计学意义[6]。本研究在亚洲人群中进行此类分析, 结果发现与双亲型家族史相比, 同胞型家族史与早发MCE的关联更强, 但是父亲与母亲型家族史的预测作用相近。
本研究发现, 有家族史的吸烟者发生MCE的风险更高, 既往研究也报告过相似结果[10, 12, 31]。这可能是因为吸烟会引起DNA甲基化状态的改变[32], 继而影响CHD相关易感基因的表达活性, 从而显著增加CHD的发生风险。其他可能的解释还包括家族史代理的家庭共同生活环境与吸烟存在交互作用。同理可推, 超重/肥胖与家族史的交互作用是具有生物学合理性的。
本研究为前瞻性设计, 剔除基线自报患有心脏病者, 可避免新发现患偏倚; 同时剔除其他重大疾病者, 可避免与基线生活方式因素相关的混杂控制和效应修饰分析时可能存在的因果倒置问题。另外, 研究样本量大, 个体信息采集较为全面, 可有效控制多种可能的混杂因素。本研究也有一定的局限性。首先, 研究对象家族史信息是通过自报获得的, 可能存在一定的信息偏倚。既往研究显示研究对象自报家族史时通常会漏报家族成员的疾病史[33-34]。但是, 作为前瞻性队列研究, 个体报告家族史早于疾病发生, 漏报更可能是非差异性的, 进而低估HR值。第二, 本研究未收集发病家族成员的发病年龄, 信息收集也只限于一级亲属。如果有机会收集更详细的信息, 可以进一步量化家族史信息, 更好反映多基因遗传背景强度。
本研究利用CKB项目近50万研究对象的随访数据, 发现具有AMI家族史的研究对象发生MCE及IHD的风险更高。在疾病预防实践中, 应加强对疾病家族史的询问, 并依据这个简单的信息指导个体的健康管理, 对于有家族史的个体, 及早开展生活方式干预和相关基础疾病的治疗管理。
志谢: 感谢所有参加CKB项目的队列成员和各项目地区的现场调查队调查员以及项目管理委员会、国家项目办公室、牛津协作中心和10个项目地区办公室的工作人员利益冲突: 无
| [1] | Lozano R, Naghavi M, Foreman K, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010:a systematic analysis for the Global Burden of Disease Study 2010[J]. Lancet Lond Engl, 2012, 380: 2095–2128. DOI:10.1016/S0140-6736(12)61728-0 |
| [2] | Valdez R, Yoon PW, Qureshi N, et al. Family history in public health practice:a genomic tool for disease prevention and health promotion[J]. Annu Rev Public Health, 2010, 31(1): 69–87. DOI:10.1146/annurev.publhealth.012809.103621 |
| [3] | Pearson TA, Blair SN, Daniels SR, et al. AHA guidelines for primary prevention of cardiovascular disease and stroke:2002 update:consensus panel guide to comprehensive risk reduction for adult patients without coronary or other atherosclerotic vascular diseases[J]. Circulation, 2002, 106(3): 388–391. DOI:10.1161/01.CIR.0000020190.45892.75 |
| [4] | Kashani M, Eliasson A, Vernalis M, et al. Improving assessment of cardiovascular disease risk by using family history:an integrative literature review[J]. J Cardiovasc Nurs, 2013, 28: E18–27. DOI:10.1097/JCN.0b013e318294b206 |
| [5] | Khera A, Joshi P. What's a malignant family history?:You'll know it when you see it[J]. JACC Cardiovasc Imaging, 2017, 10(10): 1136–1138. DOI:10.1016/j.jcmg.2016.11.014 |
| [6] | Weijmans M, van der Graaf Y, Reitsma JB, et al. Paternal or maternal history of cardiovascular disease and the risk of cardiovascular disease in offspring[J]. Int J Cardiol, 2015, 179: 409–416. DOI:10.1016/j.ijcard.2014.11.017 |
| [7] | Pandey AK, Blaha MJ, Sharma K, et al. Family history of coronary heart disease and the incidence and progression of coronary artery calcification:multi-ethnic study of atherosclerosis (MESA)[J]. Atherosclerosis, 2014, 232(2): 369–376. DOI:10.1016/j.atherosclerosis.2013.11.042 |
| [8] | Fiskå BS, Ariansen I, Graff-Iversen S, et al. Family history of premature myocardial infarction, life course socioeconomic position and coronary heart disease mortality-A Cohort of Norway (CONOR) study[J]. Int J Cardiol, 2015, 190: 302–307. DOI:10.1016/j.ijcard.2015.04.160 |
| [9] | Bertuzzi M, Negri E, Tavani A, et al. Family history of ischemic heart disease and risk of acute myocardial infarction[J]. Prev Med, 2003, 37(3): 183–187. DOI:10.1016/S0091-7435(03)00094-X |
| [10] |
姜昆, 崔荣, 赵景波, 等. 长期被动吸烟与冠心病家族史的交互作用对早发冠心病的影响[J]. 中华疾病控制杂志, 2015, 19(9): 867–870.
Jiang K, Cui R, Zhao JB, et al. Interaction of long term passive smoking with family history of coronary heart disease:an impact on premature coronary heart disease[J]. Chin J Dis Control Prev, 2015, 19(9): 867–870. DOI:10.16462/j.cnki.zhjbkz.2015.09.002 |
| [11] | Moskowitz WB, Schwartz PF, Schieken RM. Childhood passive smoking, race, and coronary artery disease risk:the MCV Twin Study[J]. Arch Pediatr Adolesc Med, 1999, 153(3): 446–453. DOI:10.1001/archpedi.153.5.446 |
| [12] | Khaw KT, Barrett-Connor E. Family history of heart attack:a modifiable risk factor?[J]. Circulation, 1986, 74(2): 239–244. DOI:10.1161/01.CIR.74.2.239 |
| [13] | Leander K, Hallqvist J, Reuterwall C, et al. Family history of coronary heart disease, a strong risk factor for myocardial infarction interacting with other cardiovascular risk factors:results from the Stockholm Heart Epidemiology Program (SHEEP)[J]. Epidemiology, 2001, 12(2): 215–221. DOI:10.1097/00001648-200103000-00014 |
| [14] |
赵冬, 吴兆苏, 王薇. 北京地区1984-1997年急性冠心病事件发病率变化趋势(中国MONICA方案的研究)[J]. 中华心血管病杂志, 2000, 28(1): 14–17.
Zhao D, Wu ZS, Wang W. The trend of incidence rate of acute coronary events from 1984 to 1997 in Beijing area:Sino-MONICA Project[J]. Chin J Cardiol, 2000, 28(1): 14–17. |
| [15] | Chen ZM, Chen JS, Collins R, et al. China Kadoorie Biobank of 0.5 million people:survey methods, baseline characteristics and long-term follow-up[J]. Int J Epidemiol, 2011, 40(6): 1652–1666. DOI:10.1093/ije/dyr120 |
| [16] | Chen ZM, Lee LM, Chen JS, et al. Cohort profile:the Kadoorie Study of Chronic Disease in China (KSCDC)[J]. Int J Epidemiol, 2005, 34: 1243–1249. DOI:10.1093/ije/dyi174 |
| [17] | Genest JJ, Martin-Munley SS, McNamara JR, et al. Familial lipoprotein disorders in patients with premature coronary artery disease[J]. Circulation, 1992, 85(6): 2025–2033. DOI:10.1161/01.CIR.85.6.2025 |
| [18] | Boer JM, Feskens EJM, Verschuren WM, et al. The joint impact of family history of myocardial infarction and other risk factors on 12-year coronary heart disease mortality[J]. Epidemiol Camb Mass, 1999, 10(6): 767–770. DOI:10.1097/00001648-199911000-00020 |
| [19] | Lloyd-Jones DM, Nam B-H, D'Agostino RB, et al. Parental cardiovascular disease as a risk factor for cardiovascular disease in middle-aged adults:a prospective study of parents and offspring[J]. JAMA, 2004, 291(18): 2204–2211. DOI:10.1001/jama.291.18.2204 |
| [20] | Hopkins PN, Williams RR, Kuida H, et al. Family history as an independent risk factor for incident coronary artery disease in a high-risk cohort in Utah[J]. Am J Cardiol, 1988, 62(10): 703–707. DOI:10.1016/0002-9149(88)91206-4 |
| [21] | Barrett-Connor E, Khaw K. Family history of heart attack as an independent predictor of death due to cardiovascular disease[J]. Circulation, 1984, 69(6): 1065–1069. DOI:10.1161/01.CIR.69.6.1065 |
| [22] | Kaikkonen KS, Kortelainen ML, Linna E, et al. Family history and the risk of sudden cardiac death as a manifestation of an acute coronary event[J]. Circulation, 2006, 114(14): 1462–1467. DOI:10.1161/CIRCULATIONAHA.106.624593 |
| [23] | Cipriani V, Mannucci PM, Ardissino D, et al. Familial aggregation of early-onset myocardial infarction[J]. Eur J Intern Med, 2010, 21(6): 511–515. DOI:10.1016/j.ejim.2010.07.017 |
| [24] | Nora JJ, Lortscher RH, Spangler RD, et al. Genetic-epidemiologic study of early-onset ischemic heart disease[J]. Circulation, 1980, 61(3): 503–508. DOI:10.1161/01.CIR.61.3.503 |
| [25] | Knuiman MW, Divitini ML, Welborn TA, et al. Familial correlations, cohabitation effects, and heritability for cardiovascular risk factors[J]. Ann Epidemiol, 1996, 6(3): 188–194. DOI:10.1016/1047-2797(96)00004-X |
| [26] | Murabito JM, Pencina MJ, Nam BH, et al. Sibling cardiovascular disease as a risk factor for cardiovascular disease in middle-aged adults[J]. JAMA, 2005, 294(24): 3117–3123. DOI:10.1001/jama.294.24.3117 |
| [27] | Nielsen M, Andersson C, Gerds TA, et al. Familial clustering of myocardial infarction in first-degree relatives:a nationwide study[J]. Eur Heart J, 2013, 34: 1198–1203. DOI:10.1093/eurheartj/ehs475 |
| [28] | Argentine FRICAS (Factores de Riesgo Coronario en América del Sur) Investigators, Ciruzzi M, Schargrodsky H, et al. Frequency of family history of acute myocardial infarction in patients with acute myocardial infarction[J]. Am J Cardiol, 1997, 80(2): 122–127. DOI:10.1016/S0002-9149(97)00304-4 |
| [29] | Friedlander Y, Siscovick DS, Weinmann S, et al. Family history as a risk factor for primary cardiac arrest[J]. Circulation, 1998, 97(2): 155–160. DOI:10.1161/01.CIR.97.2.155 |
| [30] | Banerjee A, Silver LE, Heneghan C, et al. Sex-specific familial clustering of myocardial infarction in patients with acute coronary syndromes[J]. CIRC Cardiovasc Genet, 2009, 2(2): 98–105. DOI:10.1161/CIRCGENETICS.108.806562 |
| [31] | Veronesi G, Gianfagna F, Giampaoli S, et al. Improving long-term prediction of first cardiovascular event:the contribution of family history of coronary heart disease and social status[J]. Prev Med, 2014, 64: 75–80. DOI:10.1016/j.ypmed.2014.04.007 |
| [32] | Zhang Y, Florath I, Saum KU, et al. Self-reported smoking, serum cotinine, and blood DNA methylation[J]. Environ Res, 2016, 146: 395–403. DOI:10.1016/j.envres.2016.01.026 |
| [33] | Bensen JT, Liese AD, Rushing JT, et al. Accuracy of proband reported family history:the NHLBI Family Heart Study (FHS)[J]. Genet Epidemiol, 1999, 17(2): 141–150. DOI:10.1002/(SICI)1098-2272(1999)17:2 |
| [34] | Silberberg JS, Wlodarczyk J, Fryer J, et al. Correction for biases in a population-based study of family history and coronary heart disease.The Newcastle Family History StudyI[J]. Am J Epidemiol, 1998, 147(12): 1123–1132. DOI:10.1093/oxfordjournals.aje.a009410 |
 2018, Vol. 39
2018, Vol. 39