文章信息
- 贾斯月, 李靖欣, 朱凤才.
- Jia Siyue, Li Jingxin, Zhu Fengcai.
- 癌症患者疫苗接种研究进展
- Progress in research of vaccination for patients with cancer
- 中华流行病学杂志, 2018, 39(1): 98-101
- Chinese journal of Epidemiology, 2018, 39(1): 98-101
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2018.01.021
-
文章历史
收稿日期: 2017-05-18
2. 210009 南京, 江苏省疾病预防控制中心疫苗临床评价所
2. Department of Vaccine Clinical Evaluation, Jiangsu Provincial Center for Disease Control and Prevention, Nanjing 210009, China
国家癌症中心公布的2015年癌症统计数据显示,2015年中国癌症总发病429.16万例,总死亡281.42万例[1]。癌症不仅严重威胁着我国居民的生命与健康,而且给家庭、社会和国家造成了沉重的负担。
与一般健康人群相比,癌症患者因恶性肿瘤本身或免疫抑制治疗而导致患疫苗可预防疾病的风险增加[2]。接受化疗、放疗等免疫抑制治疗的癌症患者易并发流感、侵袭性肺炎等感染性疾病[3-5],甚至可直接因感染而导致死亡[6],某些类型的癌症患者中流感并发症的病死率高达33%[7]。国内研究报道,带状疱疹的发病率在非癌症治疗住院患者中仅为0.22%,而在恶性淋巴瘤的住院患者中为9%,在白血病患者中为2%,在大量接受放疗和化疗的骨髓移植患者中高达50%[8]。因此,在适当的时机为癌症患者进行疫苗接种是降低感染性疾病发病风险、获得疫苗保护的关键。目前,我国极少开展针对癌症患者的疫苗临床试验。本文旨在对国外癌症患者疫苗接种的推荐指南及相关临床研究结果进行总结,以期为我国癌症患者免疫提供借鉴。
1.各国癌症患者疫苗接种推荐情况:
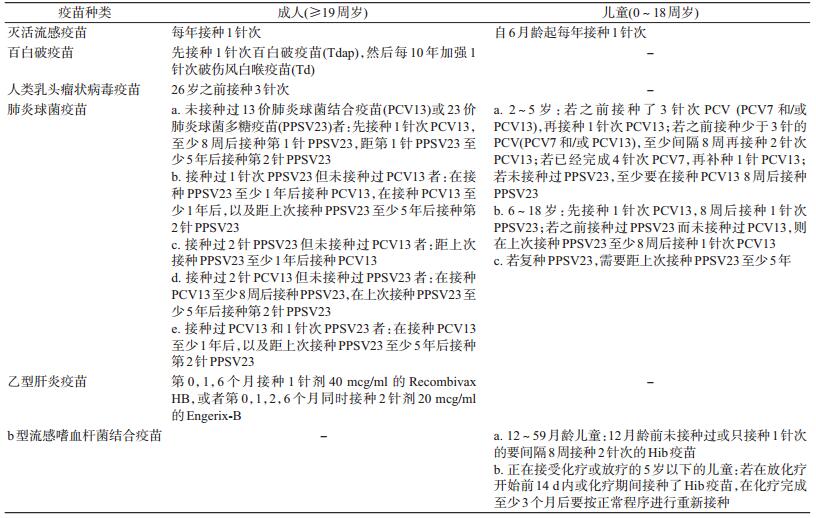
2016年美国CDC发布了成年人和儿童推荐免疫接种程序[9-10],其中涉及到了包括癌症患者在内的免疫功能低下患者的推荐疫苗接种程序。该指南中推荐接种的疫苗主要为流感疫苗、肺炎球菌疫苗等灭活疫苗(表 1),而水痘带状疱疹疫苗和麻疹、腮腺炎、风疹疫苗等减毒活疫苗则不推荐接种。
此外,英国国家医疗服务体系更新的2016年常规免疫程序中推荐[11]:因疾病或治疗导致免疫抑制的患者应接种肺炎球菌多糖疫苗(PPSV)和13价肺炎球菌结合疫苗(PCV13);每年接种流感疫苗。2017年澳大利亚卫生部修订的澳大利亚免疫手册第十版中推荐[12]:6个月及以上的免疫功能低下者应接种肺炎球菌疫苗;每年接种流感疫苗。2014年韩国传染病学会修订的成人免疫接种指南中写道[13]:推荐18岁及以上的白血病、淋巴瘤、霍奇金病、全身恶性肿瘤以及需要接受免疫抑制药物治疗的患者接种肺炎球菌疫苗。尚未检索到其他国家关于癌症患者免疫接种的推荐指南。
2.癌症患者的疫苗接种临床研究:
(1) 流感疫苗:目前,在预防癌症患者感染方面所开展的多为流感疫苗试验。灭活流感疫苗在癌症患者或免疫抑制患者中具有较好的免疫原性和安全性,被美国、英国等普遍推荐使用,但免疫紊乱可能同时会影响疫苗的免疫应答和有效性[14]。Meerveld-Eggink等[15]在38名乳腺癌患者和21名健康对照中进行的试验表明:接种1针次15 μg三价灭活流感疫苗后,癌症患者的应答率明显低于对照组。目前,提高疫苗接种效果的最常用的方法有两种:一是加大疫苗剂量,二是增加接种针次。Mcmanus等[16]在50名急性淋巴细胞白血病儿童中进行的Ⅰ期试验表明:癌症患者接种高剂量三价灭活流感疫苗是安全的,但高剂量组(60 μg)与标准剂量组(15 μg)的免疫应答率差异无统计学意义,这一结果也可能是样本量不足所致,还需进行进一步验证。Matsuzaki等[17]在44名癌症儿童中进行的试验显示:间隔2~4周接种2针次三价灭活流感疫苗4周后,甲型H1N1、H3N2和乙型流感保护率(抗体滴度≥40 IU/L)和应答率(抗体增长≥4倍)分别为72%、60%、38%和65%、40%、46%,疫苗诱导产生的免疫反应与健康儿童相当,且无严重不良反应发生。但正在化疗的儿童甲型流感的免疫应答率低于已经完成化疗的儿童。
另外,在2009新型H1N1甲型流感流行期间,加拿大、意大利、巴西等国在癌症患者中开展了数十项针对2009 H1N1单价灭活流感疫苗的临床研究。结果提示癌症患者接种1针次H1N1灭活流感疫苗的效果欠佳[18],接种2针次H1N1流感疫苗后的保护率和阳转率均高于1针次[19]。接种2针次H1N1疫苗与健康成人接种1针次该疫苗后产生的保护率和GMT相似[20]。
综上所述,癌症患者应每年接种2针次三价灭活流感疫苗,间隔2~4周,并尽量避免在化疗期间接种。此外,患者家属以及癌症患者密切接触者也应该接种流感疫苗以预防流感。
(2) 肺炎球菌疫苗:癌症患者侵袭性肺炎球菌感染的风险较高,特别是多发性骨髓瘤、肺癌、慢性淋巴细胞性白血病和淋巴瘤患者感染肺炎链球菌后可能会引起严重的并发症[21]。目前普遍应用的预防肺炎链球菌疾病的疫苗主要有两类:多糖疫苗(PPSV23)和结合疫苗(PCV7或PCV13)。Berglund等[22]在96名正在接受化疗的成年人癌症患者中进行的研究表明:接种1针次PPSV23后,49%的患者至少对7种血清型(共检测14种血清型)产生应答,并无严重不良事件发生。同时,研究发现近期接受了利妥昔单抗治疗的癌症患者免疫应答效果较差(18名无应答者中,8名接受了利妥昔单抗治疗)。Nord?y等[23]在35名正在接受轻度至中度免疫抑制治疗的成年人癌症患者和38名患有其他疾病的非癌症患者或健康人中进行的试验显示:在化疗间期为癌症患者接种1针次PPSV23后4周,其产生的6B、18C、19F和23F型肺炎球菌IgG抗体水平与对照组差异无统计学意义,4型与14型肺炎球菌IgG抗体水平低于对照组(P<0.05);除4型肺炎球菌抗体外,两组免后各型肺炎球菌抗体达到保护性水平(>1 μg /ml)的比例均无统计学差异。Cheng等[24]在中国癌症儿童中进行了一项试验:为44名1~18岁已经完成化疗至少3个月的癌症儿童接种PCV7,间隔4周接种2针次。对于疫苗所包含的7种型别肺炎球菌,癌症儿童达到保护性抗体水平(0.35 μg /ml)的比例范围为86%~100%。
因此,为了预防癌症患者中的肺炎球菌感染,成年人癌症患者应接种1针次PPSV23,并尽量避免在化疗期间接种;癌症儿童应间隔4周接种2针次PCV7,理想的情况是在化疗前或完成化疗3个月后接种肺炎球菌疫苗[25]。
(3) 乙型肝炎(乙肝)疫苗:癌症患者中乙肝病毒感染相关的病死率高达5%[26]。Pullukcu等[27]在42名土耳其血液系统恶性肿瘤患者中进行的试验显示:按0,14,28 d免疫程序接种3针次20 μg乙肝疫苗1个月和3个月后抗体滴度>10 IU/L的比例分别为23.8%和19.0%。结果表明:常规的乙肝疫苗剂量可能并不能在癌症患者中产生良好的保护效果。Sodhi等[28]在印度开展了一项纳入967名5月龄至85岁乙肝血清学标志物阴性的准备接受化疗的癌症患者的临床试验,结果表明与按常规免疫接种程序(0,1,6月)接种20 μg乙肝疫苗的癌症患者相比,多次接种(0,1,化疗前3周各1次,化疗完成后接种3次)双倍剂量(40 μg)乙肝疫苗的癌症患者在免后9个月的血清保护率更高(75.9%比49%)。Ghosh等[29]在60名2~15岁处于化疗维持期的HBsAg阴性且无乙肝疫苗接种史的孟加拉国癌症儿童中进行的试验显示:按0,1,2月免疫程序为其接种40 μg每针剂乙肝疫苗后6周,超过70%的受试者达到了保护性抗体水平(>10 mIU/ml)。此外,Weitberg等[30]的研究表明按0,1,6月免疫程序为接受化疗的成年人癌症患者接种40 μg乙肝疫苗的应答率超过70%。研究结果提示癌症患者应按0,1,6月免疫程序接种双倍剂量的乙肝疫苗。
(4) 水痘减毒活疫苗:癌症患者因恶性肿瘤本身或免疫抑制治疗而导致免疫水平较弱,考虑到疫苗免疫的安全性,一般不建议其接种减毒活疫苗。Leung等[31]在中国香港地区进行的一项癌症患者接种水痘减毒活疫苗的研究表明:17名癌症儿童接种第1针次水痘疫苗(Varivax,默克,美国)后的血清阳转率为88%,接种第2针次后为98%,但其中1名儿童在接种后5周出现可能由水痘减毒活疫苗引起的水痘和肝脏损伤。因此,考虑到癌症患者接种减毒活疫苗的安全风险问题,癌症患者应忌用水痘减毒活疫苗。
3.问题与展望:
目前,国内极少开展癌症患者的相关疫苗接种试验,缺乏癌症患者疫苗接种推荐指南。国家相关政策的缺乏、癌症患者疫苗接种试验数量相对较少、医务人员的推动不足等都是制约癌症患者疫苗接种率的主要因素。每年仍有许多癌症患者因无法接种相应疫苗而患疫苗可预防疾病,甚至因感染而导致死亡。
美国在癌症患者疫苗接种方面开展的临床研究相对较多,在降低癌症患者的疫苗可预防疾病发病率上也取得了一定成效。2013年,美国CDC和疫苗接种咨询委员会颁布了免疫力低下患者的疫苗接种推荐指南,使临床医生在为癌症患者进行疫苗接种时有证可循。
国内外癌症患者疫苗接种研究仍十分局限。虽然美国的疫苗接种推荐指南上推荐癌症患者或免疫抑制人群接种人乳头瘤病毒疫苗、百白破疫苗、b型流感嗜血杆菌结合疫苗等,但目前尚无癌症患者接种这些疫苗的临床研究,亦无证据表明其接种此类疫苗的安全性与免疫原性。
美国等其他国家在癌症患者疫苗接种方面的研究成果为我国提供了良好的借鉴。然而,考虑到癌症患者的特殊性,我们在探索免疫策略的道路上必然会遇到诸多难题与阻碍,应吸取国外疫苗临床试验的经验和教训,将其更好的应用到我国的具体国情中,从以下几个方面来推进癌症患者的疫苗接种:①政府应当制定癌症患者疫苗接种的相关政策和法规。国家政策的推动作用是巨大的,具有强大的引导性。因此,我们希望政府能够考虑到广大癌症患者所面临的感染风险和沉重的疾病负担,使癌症患者的疫苗接种可以在国家和政府的支持下得以继续。②研究机构要积极地在癌症患者中进行相关疫苗的临床试验。在政府的支持和鼓励,符合要求的研究机构要努力在癌症患者中进行疫苗临床试验,为医务人员提供依据。③癌症患者的主治医生应该鼓励并确保患者及其家属进行适当的疫苗接种。医生的建议对于患者来说十分具有影响力。负责癌症患者的医务人员应当耐心地与患者及其家属沟通,使其接种适当的疫苗以降低癌症患者的感染率,从而延长患者生存期并提高生活质量。④鼓励医务人员进行癌症患者感染的流行病学调查。为了解癌症患者的常见感染,以便采取相应的预防措施,医务人员可针对癌症患者的感染现况进行流行病学调查,这也将为相关疫苗的研发起到一定的促进作用。⑤鼓励研发机构对相关疫苗进行改造。对于免疫低下的癌症患者来说,接种减毒活疫苗的风险较高,因此有必要对相关疫苗进行改造,使其适用于癌症患者,从而预防感染、延长患者生命。⑥癌症患者疫苗接种的推进需要多个部门的通力合作。卫生部门要根据国内外的研究进展对疫苗接种指南进行及时更新;科技部门要大力扶持立项、鼓励相关研究的申报,从而推进国内癌症患者的疫苗接种试验;在医疗卫生领域,业内可以尝试标签外使用,若标签外使用的效果经过了长时间的验证而达成共识,这将加快国内特殊人群疫苗接种的规范化进程。
利益冲突: 无
| [1] | Chen WQ, Zheng RS, Baade PD, et al. Cancer statistics in China, 2015[J]. Ca A Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [2] | Ariza-Heredia EJ, Chemaly RF. Practical review of immunizations in adult patients with cancer[J]. Human Vaccines & Immunotherapeutics, 2015, 11(11): 2606–2614. DOI:10.1080/21645515 |
| [3] | Meisel R, Toschke AM, Heiligensetzer C, et al. Increased risk for invasive pneumococcal diseases in children with acute lymphoblastic leukaemia[J]. British J Haematol, 2007, 137(5): 457–460. DOI:10.1111/j.1365-2141.2007.06601.x |
| [4] | Wong A, Marrie TJ, Garg S, et al. Increased risk of invasive pneumococcal disease in haematological and solid-organ malignancies[J]. Epidemiology & Infection, 2010, 138(12): 1804–1810. DOI:10.1017/S0950268810000919 |
| [5] | Chemaly RF, Vigil KJ, Saad M, et al. A multicenter study of pandemic influenza A (H1N1) infection in patients with solid tumors in 3 countries:early therapy improves outcomes[J]. Cancer, 2012, 118(18): 4627–4633. DOI:10.1002/cncr.27447 |
| [6] |
石引久弥, 王福年.
癌症合并感染[J]. 日本医学介绍, 1984, 5(9): 16.
Shi YJM, Wang FN. Combined infection of cancer[J]. Progress in Japanese Medicine, 1984, 5(9): 16. |
| [7] | Schepetiuk S, Papanaoum K, Qiao M. Spread of influenza A virus infection in hospitalised patients with cancer[J]. Austral New Zealand J Med, 1998, 28(4): 475–476. DOI:10.1111/j.1445-5994.1998.tb02089.x |
| [8] |
李刚.
干扰素、无环鸟苷、激素联合治疗带状疱疹临床分析[J]. 生物技术世界, 2015(7): 78.
Li G. Clinical analysis of combined treatment of herpes zoster with interferon, no cGMP and hormone[J]. A world of Biotechnol, 2015(7): 78. |
| [9] | Recommended Adult Immunization Schedule United States-2016[EB/OL].(2016-02-02)[2017-05-08]. http://www.cdc.gov/vaccines/schedules/hcp/adult.html. |
| [10] | Recommended Immunization Schedules for Persons Aged 0 Through 18 Years UNITED STATES[Z]. 2016. |
| [11] | The routine immunisation schedule from summer 2016[EB/OL].(2016-05-07)[2017-05-18]. http://www.gov.uk/government/uploads/system/uploads/attachment_data/file/533829/9699_PHE_2016_Complete_Immunisation_Schedule_SUMMER16_A4_16.pdf. |
| [12] | Australian Government Department of Health. Welcome to The Australian Immunisation Handbook 10th Edition website[EB/OL].(2017-03-01)[2017-05-18]. http://www.health.gov.au/interner/immunise/publishing.nsf/Content/Handbook10-home. |
| [13] | Choi WS, Choi JH, Kwon KT, et al. Erratum:Revised Adult Immunization Guideline Recommended by the Korean Society of Infectious Diseases, 2014[J]. Infect Chemother, 2015, 47(2): 154. DOI:10.3947/ic.2015.47.2.154 |
| [14] | Kunisaki KM, Janoff EN. Influenza in immunosuppressed populations:a review of infection frequency, morbidity, mortality, and vaccine responses[J]. Lancet Infect Dis, 2009, 9(8): 493–504. DOI:10.1016/S1473-3099(09)70175-6 |
| [15] | Meerveld-Eggink A, de Weerdt O, van der Velden AMT, et al. Response to influenza virus vaccination during chemotherapy in patients with breast cancer[J]. Ann Oncol, 2011, 22(9): 2031–2035. DOI:10.1093/annonc/mdq728 |
| [16] | Mcmanus M, Frangoul H, Mccullers JA, et al. Safety of high dose trivalent inactivated influenza vaccine in pediatric patients with acute lymphoblastic leukemia[J]. Ped Blood Cancer, 2014, 61(5): 815–820. DOI:10.1002/pbc.24863 |
| [17] | Matsuzaki A, Suminoe A, Kinukawa N, et al. Immune response after influenza vaccination in children with cancer[J]. Ped Blood Cancer, 2005, 45(6): 831–837. DOI:10.1002/pbc.20470 |
| [18] | Miraglia JL, Abdala E, Hoff PM, et al. Immunogenicity and reactogenicity of 2009 influenza A (H1N1) inactivated monovalent non-adjuvanted vaccine in elderly and immunocompromised patients[J]. PLoS One, 2011, 6(11): e27214. DOI:10.1371/journal.pone.0027214 |
| [19] | Rousseau B, Loulergue P, Mir O, et al. Immunogenicity and safety of the influenza A H1N1v 2009 vaccine in cancer patients treated with cytotoxic chemotherapy and/or targeted therapy:the VACANCE study[J]. Ann Oncol, 2012, 23(2): 450–457. DOI:10.1093/annonc/mdr141 |
| [20] | Hottinger AF, George AC, Bel M, et al. A prospective study of the factors shaping antibody responses to the AS03-adjuvanted influenza A/H1N1 vaccine in cancer outpatients[J]. Oncologist, 2012, 17(3): 436–445. DOI:10.1634/theoncologist.2011-0342 |
| [21] | Lipsky BA, Boyko EJ, Inui TS, et al. Risk factors for acquiring pneumococcal infections[J]. Arch Int Med, 1986, 146(11): 2179–2185. DOI:10.1001/archinte.1986.00360230105016 |
| [22] | Berglund A, Willen L, Grodeberg L, et al. The response to vaccination against influenza A(H1N1) 2009, seasonal influenza and Streptococcus pneumoniae in adult outpatients with ongoing treatment for cancer with and without rituximab[J]. Acta Oncol, 2014, 53(9): 1212–1220. DOI:10.3109/0284186X.2014.914243 |
| [23] | Nordøy T, Aaberge IS, Husebekk A, et al. Cancer patients undergoing chemotherapy show adequate serological response to vaccinations against influenza virus and Streptococcus pneumoniae[J]. Med Oncol, 2002, 19(2): 71–78. DOI:10.1385/MO:19:2:71 |
| [24] | Cheng FWT, Ip M, Chu YYL, et al. Humoral response to conjugate pneumococcal vaccine in paediatric oncology patients[J]. Arch Dis Childhood, 2012, 97(4): 358–360. DOI:10.1136/adc.2010.198416 |
| [25] | Rubin LG, Levin MJ, Ljungman P, et al. 2013 IDSA clinical practice guideline for vaccination of the immunocompromised host[J]. Clin Infect Dis, 2014, 58(3): e44–100. DOI:10.1093/cid/cit684 |
| [26] | Yeo W, Chan PK, Zhong S, et al. Frequency of hepatitis B virus reactivation in cancer patients undergoing cytotoxic chemotherapy:a prospective study of 626 patients with identification of risk factors[J]. J Med Virol, 2000, 62(3): 299–307. DOI:10.1002/1096-9071(200011)62:3<299::AID-JMV1>3.0.CO;2-0 |
| [27] | Pullukcu H, Ertem E, Karaca Y, et al. Efficacy of accelerated hepatitis B vaccination program in patients being actively treated for hematologic malignancies[J]. Int J Infect Dis, 2008, 12(2): 166–170. DOI:10.1016/j.ijid.2007.06.004 |
| [28] | Sodhi JS, Raja W, Wani MA, et al. The efficacy of accelerated, multiple, double-dose hepatitis B virus infection in cancer patients receiving chemotherapy[J]. Indian J Gastroenterol, 2015, 34(5): 372–379. DOI:10.1007/s12664-015-0595-y |
| [29] | Ghosh N, Mannan MA, Monjur F, et al. Escalated regimen of hepatitis B vaccine in childhood hematological malignancies while on chemotherapy[J]. Southeast Asian J Trop Med Public Health, 2010, 41(3): 555–561. |
| [30] | Weitberg AB, Weitzman SA, Watkins E, et al. Immunogenicity of hepatitis B vaccine in oncology patients receiving chemotherapy[J]. J Clin Oncol Off J Am Soci Clin Oncol, 1985, 3(5): 718–722. DOI:10.1200/JCO.1985.3.5.718 |
| [31] | Leung TF, Li CK, Hung EC, et al. Immunogenicity of a two-dose regime of varicella vaccine in children with cancers[J]. Europ J Haematol, 2004, 72(5): 353–357. DOI:10.1111/j.1600-0609.2004.00216.x |
 2018, Vol. 39
2018, Vol. 39