文章信息
- 高利旺, 张美仙, 吴丽君, 付利万, 赵小元, 米杰.
- Gao Liwang, Zhang Meixian, Wu Lijun, Fu Liwan, Zhao Xiaoyuan, Mi Jie.
- GNPDA2基因rs10938397多态性与不同发育阶段儿童肥胖关联的差异分析
- Association between rs10938397 polymorphism in GNPDA2 and obesity in children at different stages of development
- 中华流行病学杂志, 2018, 39(1): 75-80
- Chinese journal of Epidemiology, 2018, 39(1): 75-80
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2018.01.016
-
文章历史
收稿日期: 2017-06-22
儿童肥胖患病率的日益增加对全球人口健康具有重大影响[1]。与正常体重者相比,肥胖儿童将较早发生高血压、脂代谢异常、2型糖尿病等疾病,进而导致早期死亡和机体残疾。此外,儿童肥胖与成年人肥胖、2型糖尿病、心脑血管疾病和部分恶性肿瘤等疾病发生具有显著关联[2]。有证据表明,超过50%的超重/肥胖儿童将持续发展为超重/肥胖的成年人[3]。
肥胖与饮食习惯、运动方式及遗传因素有关,是一个连续动态的过程。遗传因素在肥胖发生中约占40%~70%[4-5]。研究显示,遗传因素对于BMI的影响从儿童到青少年呈不同变化[6]。全基因组关联研究(genome-wide association study,GWAS)发现了大量肥胖相关基因位点[7-9]。位于葡萄糖胺-6-磷酸盐脱氨酶-2基因(GNPDA2)上的单核苷酸多态性位点rs10938397最初由Willer等[10]在欧洲成年人中发现与肥胖存在关联。此后,本研究团队利用北京市儿童青少年代谢综合征研究(Beijing Child and Adolescent Metabolic Syndrome,BCAMS)资源首次在中国学龄儿童中验证表明,GNPDA2 rs10938397与儿童一般性肥胖发生风险具有关联[11]。该研究虽然调整了性别和年龄,但人群年龄跨度较大,且无法回避青春发育期的影响。而随着青春期发育,儿童BMI和体脂含量发育规律不同[12-13],且存在性别差异[14]。鉴此,本研究旨在分析rs10938397与不同发育阶段儿童肥胖的关联性,并分析差异原因。
对象与方法1.研究对象:来自BCAMS基线调查6~18岁人群[15],以采用BMI评价指标筛查出的肥胖并同意接受静脉采血者为肥胖(病例)组(1 229人,男生占64.0%);同时按成组1 : 2比例,从非肥胖人群中选取同意接受静脉采血者为非肥胖(对照)组(2 274人,男生占43.8%)。研究样本总计为3 503人。本研究获得所有研究对象和/或监护人的书面知情同意,研究方案通过首都儿科研究所伦理委员会评审。
2.体格检查:以标准测量法测定身高和体重[15]。生物电阻抗法测定体脂百分比(FMP)、脂肪质量(FM)和非脂肪质量(FFM)。计算BMI=体重/身高2(kg/m2),脂肪指数(FMI)=FM/身高2(kg/m2),非脂肪指数(FFMI)=FFM/身高2(kg/m2)。采用《2000年中国学生体质与健康调研报告》中全国城乡男女生年龄别BMI数据对本研究BMI数据标准化[16],采用本人群数据对FMP、FMI和FFMI数据进行标准化。青春发育采用男童睾丸容积(TV)和女童乳房发育水平的Tanner分期方法进行评价,其测量和评估方法见文献[17-18]。
3.问卷调查:包括一般人口学情况,课外从事中等强度及以上体育活动的时间及频率,静态活动(电视、计算机、游戏机)时间。静态活动时间赋值:l=偶有,2=≥0.5 h/d,3=≥1 h/d,4=≥2 h/d,5=≥3 h/d。体育活动定义为从事规定的体育课以外的中等强度运动项目,如跑、跳、快走、球类、踢毽子、游泳、滑冰/雪、放风筝、健身等,以每天至少运动30 min为基本计算单位,询问每周运动的天数,赋值:l=每天运动,2=≥3 d/周,3=≥l d/周,4=≥l d/2周,5=很少运动。
4.基因多态性检测:采用盐析法从外周血白细胞中提取基因组DNA。使用ABI PrismsTM-7900型实时荧光定量PCR仪进行分型检测。本研究rs10938397基因型检测成功率>98%。对100例随机样本基因型的复测表明错误率<1%。
5.评价标准:①一般性肥胖:采用中国肥胖问题工作组推荐的“中国学龄儿童青少年超重、肥胖筛查BMI值分类标准”对7~18岁判定[19];采用美国CDC 2000年生长发育BMI曲线的第85和第95百分位值(P85、P95)对6岁组判定[20]。②体脂肥胖:男生FMP≥20%;女生≤14岁FMP≥25%,≥15岁FMP≥30%为肥胖[21]。③青春发育期:分为发育前、中、后期[22]。男生:TV<4 ml为前期,4 ml≤TV<20 ml为中期,TV≥20 ml为后期;女生:乳房发育TannerⅠ期为前期,TannerⅡ~Ⅳ期为中期,TannerⅤ期为后期。
6.统计学分析:BMI、FMP、FMI和FFMI均采用校正x±s表示其平均水平和离散度;静态活动时间、体育活动强度采用百分比表示。基因型和等位基因分布的Hardy-Weinberg(H-W)平衡检验采用χ2检验。以加性遗传模型(additive genetic model),分别采用多元线性回归和非条件logistic回归分析rs10938397与BMI、FMP、FMI、FFMI和肥胖的关系。为了控制体力活动的混杂作用,进一步分析调整静态活动时间和体育活动强度后rs10938397多态性与BMI、FMP、FMI、FFMI和肥胖关联。采用错误发现率(false discovery rate,FDR)方法校正多重检验。以P<0.05为差异有统计学意义。采用SPSS 19.0(IBM Corp,Armonk,NY,USA)软件进行统计分析。使用Quanto软件计算基因多态性与表型(BMI、FMP、FMI、FFMI和肥胖)关联分析的power值(http://hydra.usc.edu/gxe/)。
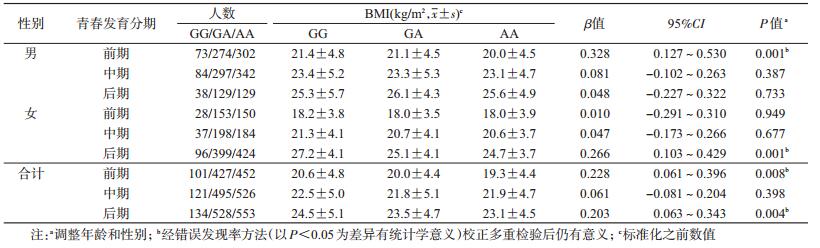
结果1.基本情况:3 503名调查对象年龄(12.4±3.1)岁。以FMP评价体脂肥胖,男、女生组分别缺失38(2%)和95(5%)人(表 1)。总人群中,等位基因G的频率为0.325;总人群及各亚组SNP rs10938397基因型频率均满足H-W平衡定律(χ2=1.088~2.534,P=0.111~0.992)。
2. rs10938397与BMI的关系:以标准化BMI为因变量,rs10938397为自变量,运用多元线性回归模型,分析rs10938397和BMI的关系(表 2)。结果显示GNPDA2 rs10938397与BMI的关联见于儿童青春发育前期和后期;分性别分析,男生rs10938397与BMI的关联见于青春发育前期,女生该位点与BMI关联见于青春发育后期。进一步调整静态活动时间和体育活动强度后,以上关联依然存在(P<0.05)。校正多重检验后,以上关联仍然存在。
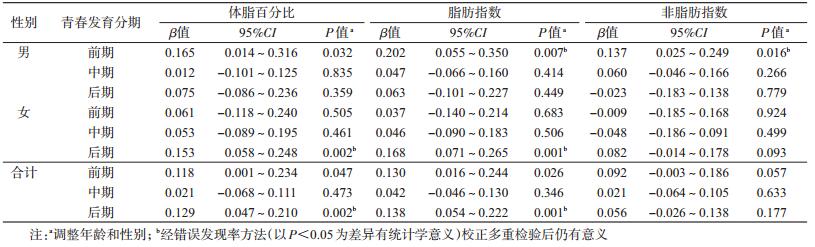
3. rs10938397与FMP、FMI和FFMI的关系:分别以标准化FMP、FMI和FFMI为因变量,rs10938397为自变量,运用多元线性回归模型,分析rs10938397与FMP、FMI和FFMI的关系(表 3)。结果显示,GNPDA2 rs10938397与FMP和FMI的关联见于儿童青春发育前期和后期,与FFMI的关联为边缘P值见于儿童青春发育前期;分性别分析,男生rs10938397与FMP、FMI和FFMI的关联见于青春发育前期,女生该位点与FMP和FMI关联见于青春发育后期,与FFMI关联未见统计学意义。进一步调整静态活动时间和体育活动强度后,以上关联依然存在(P<0.05)。校正多重检验后,在青春发育前期总人群中位点与FMP和FMI关联消失,在青春发育前期男生组位点与FMP关联消失。
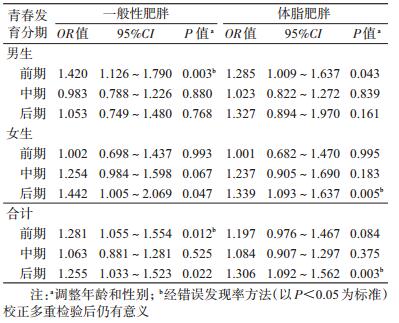
4. rs10938397与肥胖的关系:分别以一般性肥胖和体脂肥胖为因变量(0=非肥胖,1=肥胖),rs10938397为自变量(0=AA,1=GA,2=GG),采用非条件logistic回归模型计算位点预测肥胖的OR值。由表 4可见,GNPDA2 rs10938397与一般性肥胖和体脂肥胖的关联见于儿童青春发育前期和后期;分性别分析,男生rs10938397与一般性肥胖和体脂肥胖的关联见于青春发育前期,女生该位点与一般性肥胖和体脂肥胖关联见于青春发育后期。进一步调整静态活动时间和体育活动强度后,以上关联依然存在(P<0.05)。校正多重检验后,在青春发育后期总人群和女生组rs10938397与一般性肥胖关联消失。
GNPDA2位于4号染色体(4p12),包含8个外显子,编码使D-葡糖胺-6-磷酸逆转化为D-果糖-6-磷酸的变构酶。该基因主要在下丘脑表达,与糖代谢有关[23],主要参与氨基糖和核苷酸糖代谢[24]。GNPDA2在己糖胺信号通路中起重要作用,而己糖胺信号通路是生物体内主要的营养感受途径之一[25]。研究禽类动物发现,GNPDA2基因主要在下丘脑、脂肪组织和十二指肠中表达,在调控鸡的体重、脂肪和能量代谢方面具有潜在的作用[26]。此外,研究表明大鼠在高脂饮食下,下丘脑中GNPDA2的mRNA水平下降,GNPDA2表达可能受营养状况及膳食成分影响[27]。人体内GNPDA2功能尚未阐明,但目前发现与人类肥胖相关的基因很多在下丘脑表达,且大多通过调控中枢神经系统和能量代谢调节体重。
在前期研究基础上,本研究按青春发育阶段分层分析表明,rs10938397与BMI关联见于青春发育前期和后期,与一般性肥胖关联见于青春发育前期。本文中处于青春发育前期儿童平均年龄为9.0岁,与墨西哥研究发现GNPDA2 rs10938397增加儿童一般性肥胖风险所纳入儿童的平均年龄(9.5岁)较为一致[28]。分性别分析显示,在男生的青春发育前期,rs10938397位点G等位基因与BMI和一般性肥胖罹患风险密切关联;在女生的青春发育后期,rs10938397与BMI关联具有统计学意义。本研究发现rs10938397与儿童青少年一般性肥胖关联具有性别和青春发育阶段的差异,分析关联差异出现的原因可能与男、女生体脂分布差异及发育过程中脂肪增加特点不同有关。BMI与青少年皮下脂肪以及总的体脂含量明显相关,是一个判断儿童青少年肥胖的良好指标[29]。但是当BMI作为反映体脂含量的间接指标时存在局限性,可能存在性别间的差异[14]。
为进一步探讨rs10938397与儿童一般性肥胖关联出现性别和青春发育差异的原因,本研究分析了该位点与反映身体脂肪含量(FMP、FMI)和FFMI的关联。结果表明rs10938397与FMP和FMI的关联在青春发育前期和后期的总人群中有统计学意义。分性别分析,位点与青春发育前期男生的FMI、FFMI关联有统计学意义,与青春发育后期女生的FMP、FMI关联有统计学意义。此外,本研究发现rs10938397与青春发育后期女生体脂肥胖有关。以上结果提示,rs10938397与女生肥胖的关联更多的是增加脂肪含量而与非脂肪含量无关。在儿童青少年阶段BMI与身体脂肪发育的轨迹存在较大差别,青春期间,男生BMI增长过程中非脂肪组织增加超过脂肪组织,女生BMI增长过程中脂肪组织的增加超过非脂肪组织[30]。通过用非条件logistic回归模型分析rs10938397与不同肥胖表型的关系,结果显示经过多重检验后位点与不同肥胖表型的相关性有差异。尽管BMI被公认为是衡量体内脂肪含量的实用指标[31],但与直接反映脂肪含量的指标相比,关联研究结果仍然存在差异。
本研究以青春发育期为分层标准分析了GNPDA2 rs10938397多态性与不同发育阶段儿童肥胖关联差异原因,但由于分层研究亚组样本量小,需要扩大样本进一步研究。此外,还需细胞水平实验以及相应动物模型实验进行相关机制的阐述。
总之,不同青春发育期,基因多态性与肥胖的关联差异,提示在分析基因与儿童肥胖关联时要考虑到青春期发育的效应修正作用;此外,rs10938397与评价肥胖的不同指标的关联差异,提示对于揭露基因与肥胖的真实关联,更准确地评价肥胖状况十分重要。
利益冲突: 无
| [1] | Lobstein T, Baur L, Uauy R. Obesity in children and young people:a crisis in public health[J]. Obes Rev, 2004, 5(Suppl 1): 4–85. DOI:10.1111/j.1467-789X.2004.00133.x |
| [2] | Juonala M, Magnussen CG, Berenson GS, et al. Childhood adiposity, adult adiposity, and cardiovascular risk factors[J]. N Engl J Med, 2011, 365(20): 1876–1885. DOI:10.1056/NEJMoa1010112 |
| [3] | Herman KM, Craig CL, Gauvin L, et al. Tracking of obesity and physical activity from childhood to adulthood:the Physical Activity Longitudinal Study[J]. Int J Pediatr Obes, 2009, 4(4): 281–288. DOI:10.3109/17477160802596171 |
| [4] | Allison DB, Kaprio J, Korkeila M, et al. The heritability of body mass index among an international sample of monozygotic twins reared apart[J]. Int J Obes Relat Metab Disord, 1996, 20(6): 501–506. |
| [5] | Maes HH, Neale MC, Eaves LJ. Genetic and environmental factors in relative body weight and human adiposity[J]. Behav Genet, 1997, 27(4): 325–351. DOI:10.1023/A:1025635913927 |
| [6] | Elks CE, Den Hoed M, Zhao JH, et al. Variability in the heritability of body mass index:a systematic review and meta-regression[J]. Front Endocrinol (Lausanne), 2012, 3: 29. DOI:10.3389/fendo.2012.00029 |
| [7] | Frayling TM, Timpson NJ, Weedon MN, et al. A common variant in the FTO gene is associated with body mass index and predisposes to childhood and adult obesity[J]. Science, 2007, 316(5826): 889–894. DOI:10.1126/science.1141634 |
| [8] | Loos RJ, Lindgren CM, Li SX, et al. Common variants near MC4R are associated with fat mass, weight and risk of obesity[J]. Nat Genet, 2008, 40(6): 768–775. DOI:10.1038/ng.140 |
| [9] | Locke AE, Kahali B, Berndt SI, et al. Genetic studies of body mass index yield new insights for obesity biology[J]. Nature, 2015, 518(7538): 197–206. DOI:10.1038/nature14177 |
| [10] | Willer CJ, Speliotes EK, Loos RJ, et al. Six new loci associated with body mass index highlight a neuronal influence on body weight regulation[J]. Nat Genet, 2009, 41(1): 25–34. DOI:10.1038/ng.287 |
| [11] | Wu LJ, Xi B, Zhang MX, et al. Associations of six single nucleotide polymorphisms in obesity-related genes with BMI and risk of obesity in Chinese children[J]. Diabetes, 2010, 59(12): 3085–3089. DOI:10.2337/db10-0273 |
| [12] | Gam SM, LaVelle M, Rosenberg KR, et al. Maturational timing as a factor in female fatness and obesity[J]. Am J Clin Nutr, 1986, 43(6): 879–883. DOI:10.1093/ajcn/43.6.879 |
| [13] | Kaplowitz PB, Slora EJ, Wasserman R, et al. Earlier onset of puberty in girls:relation to increased body mass index and race[J]. Pediatrics, 2001, 108(2): 347–353. DOI:10.1542/peds.108.2.347 |
| [14] |
陈芳芳, 米杰, 王天有, 等.
北京市儿童青少年青春期发育与肥胖相关关系的研究[J]. 中国循证儿科杂志, 2007, 2(1): 14–20.
Chen FF, Mi J, Wang TY, et al. Relationship between precosious puberty and obese status in Beijing children and adolescents[J]. Chin J Evid Base Pediatr, 2007, 2(1): 14–20. DOI:10.3969/j.issn.1673-5501.2007.01.003 |
| [15] |
米杰, 程红, 侯冬青, 等.
北京市2004年2~18岁儿童青少年超重和肥胖流行现状[J]. 中华流行病学杂志, 2006, 27(6): 469–474.
Mi J, Cheng H, Hou DQ, et al. Prevalence of overweight and obesity among children and adolescents in Beijing in 2004[J]. Chin J Epidemiol, 2006, 27(6): 469–474. DOI:10.3760/j.issn:0254-6450.2006.06.003 |
| [16] |
中国学生体质与健康研究组.2000年中国学生体质与健康调研报告[M]. 北京: 高等教育出版社, 2002: 266.
Research Group of Chinese Students' Physique and Health.Report on the physical fitness and health surveillance of Chinese school students[M]. Beijing: Higher Education Press, 2002: 266. |
| [17] |
宗心南, 李辉, 程红, 等.
男性青春期体格发育和性征发育的关系研究[J]. 中国儿童保健杂志, 2014, 22(5): 455–458.
Zong XN, Li H, Cheng H, et al. Relationship of physical growth and sexual characteristics for males at puberty[J]. Chin J Child Health Care, 2014, 22(5): 455–458. DOI:10.11852/zgetbjzz2014-22-05-03 |
| [18] | Marshall WA, Tanner JM. Variations in pattern of pubertal changes in girls[J]. Arch Dis Child, 1969, 44(235): 291–303. DOI:10.1136/adc.44.235.291 |
| [19] |
中国肥胖问题工作组.
中国学龄儿童青少年超重、肥胖筛查体重指数值分类标准[J]. 中华流行病学杂志, 2004, 25(2): 97–102.
Group of China Obesity Task Force. Body mass index reference norm for screening overweight and obesity in Chinese children and adolescents[J]. Chin J Epidemiol, 2004, 25(2): 97–102. DOI:10.3760/j.issn:0254-6450.2004.02.003 |
| [20] | Kuczmarshi RJ, Ogden CL, Grummer-Strawn LM, et al. CDC growth chart:United States[J]. Adv Data, 2000(314): 1–27. |
| [21] |
叶广俊.现代儿童少年卫生学[M]. 北京: 人民卫生出版社, 1999: 473.
Ye GJ.Modern child and adolescent health[M]. Beijing: People's Medical Publishing House, 1999: 473. |
| [22] | Wright CM, Ahmed L, Dunger DB, et al. Can we characterise growth in puberty more accurately? Validation of a new Puberty Phase Specific (PPS) growth chart[J]. Arch Dis Child, 2012, 97(S1): A100. DOI:10.1136/archdischild-2012-301885.236 |
| [23] | Oikari S, Makkonen K, Deen AJ, et al. Hexosamine biosynthesis in keratinocytes:roles of GFAT and GNPDA enzymes in the maintenance of UDP-GlcNAc content and hyaluronan synthesis[J]. Glycobiology, 2016, 26(7): 710–722. DOI:10.1093/glycob/cww019 |
| [24] | Kanehisa M, Goto S. KEGG:Kyoto encyclopedia of genes and Genomes[J]. Nucleic Acids Res, 2000, 28(1): 27–30. DOI:10.1093/nar/28.1.27 |
| [25] | Marshall S. Role of insulin, adipocyte hormones, and nutrient-sensing pathways in regulating fuel metabolism and energy homeostasis:a nutritional perspective of diabetes, obesity, and cancer[J]. Sci STKE, 2006, 2006(346): re7. DOI:10.1126/stke.3462006re7 |
| [26] | Ouyang HJ, Zhang H, Li WM, et al. Identification, expression and variation of the GNPDA2 gene, and its association with body weight and fatness traits in chicken[J]. Peer J, 2016, 4(1): e2129. DOI:10.7717/peerj.2129 |
| [27] | Gutierrez-Aguilar R, Kim DH, Woods SC, et al. Expression of new loci associated with obesity in diet-induced obese rats:from genetics to physiology[J]. Obesity, 2011, 20(2): 306–312. DOI:10.1038/oby.2011.236 |
| [28] | Mejía-Benítez A, Klünder-Klünder M, Yengo L, et al. Analysis of the contribution of FTO, NPC1, ENPP1, NEGR1, GNPDA2 and MC4R genes to obesity in Mexican children[J]. BMC Med Genet, 2013, 14: 21. DOI:10.1186/1471-2350-14-21 |
| [29] | Himes JH, Dietz WH. Guidelines for overweight in adolescent preventive services:recommendations from an expert committee. The expert committee on clinical guidelines for overweight in adolescent preventive services[J]. Am J Clin Nutr, 1994, 59(2): 307–316. DOI:10.1093/ajcn/59.2.307 |
| [30] | Rutters F, Nieuwenhuizen AG, Verhoef SPM, et al. The relationship between leptin, gonadotropic hormones, and body composition during puberty in a Dutch children cohort[J]. Eur J Endocrinol, 2009, 160(6): 973–978. DOI:10.1530/EJE-08-0762 |
| [31] | World Health Organization. Physical status:the use and interpretation of anthropometry. Report of a WHO expert committee[R]. Geneva:World Health Organ, 1995. |
 2018, Vol. 39
2018, Vol. 39