文章信息
- 柯碧霞, 曾洪辉, 何冬梅, 谭海玲, 李柏生, 梁宇恒, 柯昌文.
- Ke Bixia, Zeng Honghui, He Dongmei, Tan Hailing, Li Bosheng, Liang Yuheng, Ke Changwen.
- 广东省2007-2016年人源沙门菌流行现状及病原学特征
- Circulation and etiological characterization of Salmonella enterica serotype in human in Guangdong province, 2007-2016
- 中华流行病学杂志, 2018, 39(1): 63-66
- Chinese journal of Epidemiology, 2018, 39(1): 63-66
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2018.01.013
-
文章历史
收稿日期: 2017-05-19
2. 510440 广州, 广东省生物制品与药物研究所耐药监测室
2. Guangdong Provincial Institute of Biological Products and Material Medicine, Guangzhou 510440, China
沙门菌1,4,[5],12:i:-是鼠伤寒沙门菌变种的单相沙门菌,其O抗原和H抗原第一相均与鼠伤寒沙门菌相同,但缺少H抗原第二相。广东省从2007年起在全省选择哨点医院开展腹泻病例沙门菌监测,发现血清型4,5,12:i:-沙门菌的数量逐年增多,现已成为广东省人源沙门菌中最主要的血清型。为此本研究对2007-2016年广东省腹泻病例沙门菌监测中分离的沙门菌1,4,[5],12:i:-进行分析,以了解该血清型沙门菌在广东省的流行现状及其病原学特征。
材料与方法1.菌株:来自广东省东莞、佛山、广州、河源、惠州、江门、揭阳、茂名、韶关、阳江、湛江、中山、珠海13个市的沙门菌监测哨点医院2007-2016年检测到的沙门菌1,4,[5],12:i:-。
2.仪器与试剂:药敏纸片为英国OXOID公司产品;革兰阴性菌药敏板为赛默飞公司和上海星佰公司产品;XbaⅠ酶购自美国Promega公司;SeaKem Gold Agarose琼脂糖为美国Cambrex公司生产;蛋白酶K为MERCK公司产品。
3.研究方法:①药敏试验:2009-2014年采用纸片法,抗菌药物包括氨苄西林(10 μg)、头孢他啶(30 μg)、环丙沙星(5 μg)、氯霉素(30 μg)、头孢噻肟(30 μg)、头孢吡肟(30 μg)、庆大霉素(10 μg)、萘啶酸(30 μg)、磺胺甲二唑(200 μg)、链霉素(10 μg)、四环素(30 μg)和甲氧苄啶(5 μg)共12种;2015-2016年采用微量肉汤稀释法,包括氨苄西林(2~64 μg/ml)、氨苄西林/舒巴坦(2~64/1~32 μg/ml)、头孢唑林(0.5~16.0 μg/ml)、头孢噻肟(0.25~8.00 μg/ml)、头孢他啶(1~32 μg/ml)、头孢西丁(2~64 μg/ml)、亚胺培南(0.25~8.00 μg/ml)、萘啶酸(2~64 μg/ml)、环丙沙星(0.03~8.00 μg/ml)、阿奇霉素(4~64 μg/ml)、四环素(1~32 μg/ml)、氯霉素(2~64 μg/ml)、复方新诺明(0.25~8.00 μg/ml)、庆大霉素(1~32 μg/ml)。②菌株分子检测:fljB、fljA、hin、iroB、STM2740、STM2757基因检测方法见文献[1],PFGE操作见文献[2]。
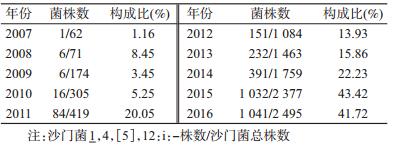
结果1.流行概况:从2007年起广东省腹泻病例沙门菌监测中每年均检出沙门菌1,4,[5],12:i:-,且呈逐年增多(表 1),至2015年已成为沙门菌中最主要的血清型(42.95%)。2007-2016年共分离到2 960株沙门菌1,4,[5],12:i:-。其中男性1 780例,女性1 126例(54例性别不详),性别比例为1.58 : 1。发病年龄以婴幼儿为主,0~6岁组占总病例数的79.27%。病例分别来自广州市612例(20.68%),中山市463例(15.64%),珠海市370例(12.50%),阳江市355例(11.99%),东莞市342例(11.55%),江门市204例(6.89%),茂名市191例(6.45%),河源市140例(4.73%),佛山市124例(4.19%),揭阳市103例(3.48%),韶关市51例(1.72%),湛江市3例(0.10%)和惠州市2例(0.06%)。47.23%(1 398/2 960)的菌株分离自住院病例,其余分离自门诊病例。
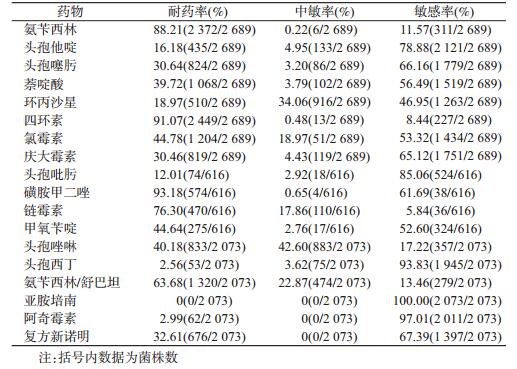
2.耐药情况:2 689株沙门菌1,4,[5],12:i:-对18种抗生素药物敏感试验中除对亚胺培南100%敏感外,对其他17种抗生素均有不同程度耐药(表 2)。2011-2016年沙门菌1,4,[5],12:i:-对头孢他啶、头孢噻肟和环丙沙星的耐药总体呈上升趋势,耐药菌株占3.05%(82/2 689),并产生严重的多重耐药现象,具有ASSuT(即同时对氨苄西林、磺胺甲二唑、链霉素、四环素耐药)多重耐药菌株占70.62%(435/616),具有ACSuGSTTm(即同时对氨苄西林、氯霉素、链霉素、庆大霉素、磺胺甲二唑、四环素和甲氧苄啶耐药)多重耐药菌株占27.11%(167/616)。
3.菌株分子特征:选取2013-2016年187株沙门菌1,4,[5],12:i:-检测STM2740、STM2757、fljA、fljB、hin和iroB 6个基因,全部实验菌株均保留了STM2740和STM2757基因,而fljA、fljB、hin、iroB基因均有不同方式的缺失。根据fljA、fljB、hin和iroB基因缺失的组合,共有8种不同的缺失方式(表 3)。其中以缺失方式1(缺失fljA、fljB和hin基因)为主(75.9%),有9株菌(4.8%)保留了全部6个基因。
对2 347株沙门菌1,4,[5],12:i:-用XbaⅠ酶切进行PFGE分子分型。沙门菌1,4,[5],12:i:-的PFGE型别分布多样,共有934种不同PFGE谱型别,表现出较大的指纹图谱多态性。934种谱型中有637种(68.20%)只有1株菌。最主要的优势PFGE谱型为JPXX01.GD0226型,排在前20位的优势谱型见表 4。优势谱型均分散在全省各地,如JPXX01.GD0226型分布于广州、佛山、东莞、珠海、中山、河源、江门、茂名、阳江、揭阳10个市。沙门菌1,4,[5],12:i:-的聚集性病例追踪调查均未发现病例间有共同的饮食暴露史。与广东省CDC的PFGE数据库中鼠伤寒沙门菌PFGE图谱比对,发现有168种沙门菌1,4,[5],12:i:-的PFGE图谱与鼠伤寒沙门菌PFGE图谱一致。
在20世纪90年代以前一直将沙门菌1,4,[5],12:i:-归为鼠伤寒沙门菌,称为鼠伤寒变种沙门菌,很少有沙门菌1,4,[5],12:i:-的报道。近20年来沙门菌1,4,[5],12:i:-在全球各地检出大幅度增加。如泰国和美国,该血清型沙门菌已被列为引起人类沙门菌病的6种最主要的血清型之一[3-4];在西班牙,沙门菌1,4,[5],12:i:-是猪体最常见和猪肉制品中第二常见的血清型[5]。该型菌自2007年在我国广东省监测中检出后,每年检出率不断上升,至2015年已成为人源沙门菌中第一常见的血清型,且从广东省牛肉制品中也有检出[6]。但我国其他省份沙门菌1,4,[5],12:i:-检出较少,未见报道,福建省虽有报道,但检出仅占0.45%[7]。
近20年,欧洲地区存在两种主要的沙门菌1,4,[5],12:i:-MDR菌株。一种是20世纪90年代末出现的以质粒介导的ACSuGSTTm耐药特性的1,4,[5],12:i:-菌株[8-9],即西班牙株系(Spanish clone),主要是噬菌体U302型;另一种是21世纪以来,在欧洲地区多国出现染色体介导的ASSuT耐药特性1,4,[5],12:i:-菌株[10-11],为欧洲株系(European clone),主要是DT193型和一些DT120型。本研究发现我国广东省人源沙门菌1,4,[5],12:i:-多重耐药菌株中,西班牙株系占70.62%,欧洲株系占27.11%,说明多重耐药现象严重。
多项研究显示,沙门菌1,4,[5],12:i:-具有和鼠伤寒沙门菌相同或相似的PFGE图谱[1, 3]、MLST序列型[1, 12]及MLVA图谱[13]。根据这些研究结果推测,1,4,[5],12:i:-菌株属于鼠伤寒沙门菌的一个变种,且起源于鼠伤寒沙门菌的进化发展。本研究也发现有168种沙门菌1,4,[5],12:i:-的PFGE图谱与广东省鼠伤寒沙门菌PFGE图谱完全相同。
沙门菌的H抗原主要由fliC和fljB基因编码,fliC基因编码H第一相抗原,fljB基因编码H第二相抗原。fljA基因的表达产物可以与基因fliC操纵子结合,抑制fliC表达。沙门菌鞭毛相变是由一段可逆倒转的DNA序列(H片段)引起的。H片段上的hin基因编码的DNA转化酶反式作用于H片段,使位于两端的倒转重复序列发生倒位[14]。iroB基因是编码葡萄糖转移酶同系蛋白;STM2740基因是编码整合酶;STM2757基因是编码与细胞质相关的蛋白[1]。因此,在fljB、fljA、hin、iroB、STM2740、STM2757任何一个位点发生的缺失、插入和突变都可能导致第二相鞭毛蛋白不表达。本研究发现广东省人源沙门菌1,4,[5],12:i:-不表达第二相鞭毛蛋白主要(75.53%)是缺失fljA、fljB和hin基因,但保留了iroB、STM2740、STM2757基因,这种缺失方式与意大利菌株相同[2]。有7.45%菌株的缺失方式与西班牙菌株[15](丢失fljA、fljB、hin、iroB基因,保留了STM2757)相同,没有和美国菌株(丢失fljA、fljB、STM2757基因,hin、iroB基因仍存在)一样的缺失方式。本研究还发现有9株菌是保留全部检测的6个基因,这可能是还存在其他基因的缺失或突变,还有待进一步用全基因组测序的方法分析。
利益冲突: 无
| [1] | Soyer Y, Switt AM, Davis MA, et al. Salmonella enterica serotype 4, 5, 12:i:-, an emerging Salmonella serotype that represents multiple distinct clones[J]. J Clin Microbiol, 2009, 47(11): 3546–3556. DOI:10.1128/JCM.00546-09 |
| [2] | Standard Operating Procedure for PulseNet PFGE of Escherichia coli O157:H7, Escherichia coli non-O157(STEC), Salmonella serotypes, Shigella sonnei and Shigella flexneri[EB/OL].[2017-05-10] https://www.cdc.gov/pulsenet/pdf/ecoli-shigella-salmonella-pfge-protocol-508c.pdf. |
| [3] | Amavisit P, Boonyawiwat W, Bangtrakulnont A. Characterization of Salmonella entericserovar typhimurium and monophasic Salmonella serovar 1, 4, [5], 12:i:-isolates in Thailand[J]. J Clin Microbiol, 2005, 43(6): 2736–2740. DOI:10.1128/JCM.43.6.2736-2740.2005 |
| [4] | Centers for Disease Control and Prevention.Investigation of outbreak of human infections caused by Salmonella serotype 1, 4, [5], 12:i:-, 2007[M]. Atlanta, GA: Centers for Disease Control and Prevention, 2007. |
| [5] | de La Torre E, Zapata D, Tello M, et al. Several Salmonella enteric subsp. enterica serotype 4, 5, 12:i:-phage types isolated from swine samples originate from serotype typhimurium DT U302[J]. J Clin Microbiol, 2003, 41(6): 2395–2400. DOI:10.1128/JCM.41.6.2395-2400.2003 |
| [6] | Yang XJ, Wu QP, Zhang JM, et al. Prevalence and characterization of monophasic Salmonella serovar 1, 4, [5], 12:i:-of food origin in China[J]. PLoS One, 2015, 9(11): e0137967. DOI:10.1371/journal.pone.0137967 |
| [7] |
陈建辉, 欧剑鸣, 杨劲松, 等.
2006-2011年福建省沙门菌监测菌株血清型分布及耐药性分析[J]. 预防医学论坛, 2014, 20(2): 81–83, 87.
Chen JH, Ou JM, Yang JS, et al. Analysis on the distribution of serotypes and drug resistance with Salmonella strains, Fujian province, 2006-2011[J]. Prev Med Trib, 2014, 20(2): 81–83, 87. DOI:10.16406/j.pmt.issn.1672-9153.2014.02.014 |
| [8] | Echeita M, Aladueña A, Cruchaga S, et al. Emergence and spread of an atypical Salmonella enteric subsp. serotype 4, 5, 12:i:-strain in Spain[J]. J Clin Microbiol, 1999, 37(10): 3425. |
| [9] | Echeita MA, Herrera S, Usera MA. Atypical, fljB negative Salmonella enteric subsp. enterica strain of serovar 4, 5, 12:i:-appears to be a monophasic variant of serovar typhimurium[J]. J Clin Microbiol, 2001, 39(8): 2981–2983. DOI:10.1128/JCM.39.8.2981-2983.2001 |
| [10] | Bone A, Noel H, Le Hello S, et al. Nationwide outbreak of Salmonella enterica serotype 4, 12:i:-infections in France, linked to dried pork sausage, March-May 2010[J]. Euro Surveill, 2010, 15(24): 19592. |
| [11] | Hopkins KL, Kirchner M, Guerra B, et al. Multiresistant Salmonella entericaserovar 4, [5], 12:i:-in Europe:a new pandemic strain[J]. Euro Surveill, 2010, 15(22): 19580. |
| [12] | Alcaine SD, Soyer Y, Warnick LD, et al. Multilocus sequence typing supports the hypothesis that cow-and human associated Salmonella isolates represent distinct and overlapping populations[J]. Appl Environ Microbiol, 2006, 72(12): 7575–7585. DOI:10.1128/AEM.01174-06 |
| [13] | Kurosawa A, Imamura T, Tanaka K, et al. Molecular typing of Salmonella enterica serotype typhimurium and serotype 4, 5, 12:i:-isolates from cattle by multiple-locus variable-number-tandem-repeats analysis[J]. Vet Microbiol, 2012, 160(1/2): 264–268. DOI:10.1016/j.vetmic.2012.05.023 |
| [14] |
杨小鹃, 吴清平, 张菊梅, 等.
沙门菌1, 4, [5], 12:i:-耐药性和遗传特征研究进展[J]. 微生物学报, 2014, 54(11): 1248–1255.
Yang XJ, Wu QP, Zhang JM, et al. Phenotypic and molecular characteristics of Salmonella enteric serotype 1, 4, [5], 12:i:-a review[J]. Acta Microbiol Sin, 2014, 54(11): 1248–1255. DOI:10.13343/j.cnki.wsxb.2014.11.002 |
| [15] | Lucarelli C, Dionisi AM, Filetici E, et al. Nucleotide sequence of the chromosomal region conferring multidrug resistance (R-type ASSuT) in Salmonella typhimurium and monophasic Salmonella typhimurium strains[J]. J Antim Chemoth, 2012, 67(1): 111–114. DOI:10.1093/jac/dkr391 |
 2018, Vol. 39
2018, Vol. 39