文章信息
- 黄育北, 杨雷, 宋丰举, 陈可欣.
- Huang Yubei, Yang Lei, Song Fengju, Chen Kexin.
- 乳腺X线筛查乳腺癌引起过度诊断的研究进展
- Overdiagnosis in mammography screening for breast cancer
- 中华流行病学杂志, 2017, 38(11): 1574-1578
- Chinese Journal of Epidemiology, 2017, 38(11): 1574-1578
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2017.11.027
-
文章历史
收稿日期: 2017-05-05
2. 100142 北京大学肿瘤医院肿瘤研究所 北京市肿瘤防治办公室
2. Beijing Office for Cancer Prevention and Control, Peking University Cancer Hospital and Institute, Beijing 100142, China
筛查历来就是一把双刃剑。癌症筛查因为能够早期发现恶性肿瘤,延长生存期而被推广,但同时也因为会带来过度诊断(对永远不会导致症状出现或威胁生命的癌症的诊断)及过度检查(由于假阳性,对非癌症患者进行的不必要的进一步影像学或有创的病理检查)等问题而备受争议[1]。过度诊断的直接后果是导致被诊断的乳腺癌患者接受不必要的治疗以及终身监测,从而造成不必要的经济负担,以及身体及心理上的伤害[2]。过度检查的后果是为求证未患乳腺癌而同样花费的不必要的经济负担,以及造成不必要的心理负担。由于过度诊断的对象是乳腺癌患者,因而成为乳腺癌筛查利弊之争的主要焦点之一[3-7]。
在众多癌症中,乳腺癌的生存期相对较长;同时,在传统乳腺癌X线筛查方法(钼靶)基础上发展起来的新型乳腺癌筛查方法,如数字化乳腺断层合成技术(DBT检查或乳腺3D检查)以及全自动超声成像技术(ABUS)[8-9],对于微小肿瘤(<2 cm)诊断能力的提高,导致乳腺癌筛查中过度诊断问题尤为明显。尽管存在这些不利影响,2015年6月,国际癌症研究机构(IARC)在系统回顾所有钼靶筛查乳腺癌证据之后称:这些不利影响实际都不及筛查所带来的乳腺癌死亡率整体下降的收益[4]。然而,2016年10月,Welch等[10]发表的一项研究表明:在美国实施钼靶筛查后的30年,假定美国乳腺癌的潜在疾病负担相对稳定的话,每10万人诊断的162例乳腺癌中,仅30例是可能会进展为威胁生命的恶性肿瘤,剩下的132例很可能为过度诊断,也就是说美国有超过80%的乳腺癌是被过度诊断的。如此高的过度诊断比例再次引发国内外对于乳腺癌筛查总体收益的争议。本文将在系统总结既往相关研究基础上详细阐述过度诊断产生的原因、评价方法,及可能避免过度诊断的方法。
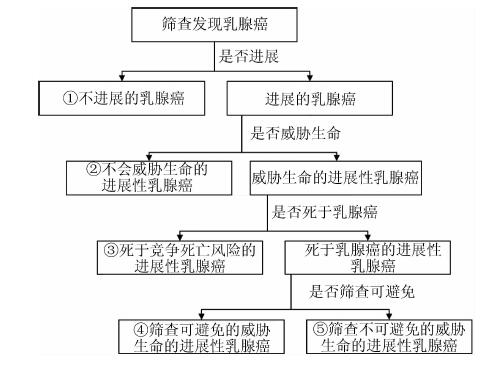
(1) 乳腺癌筛查过度诊断的原因根据过度诊断的定义,过度诊断的产生需要两个基础:①乳腺癌终身不进展;②不会威胁生命。根据是否进展,可以将所有筛查发现的乳腺癌分为两类:进展的乳腺癌和不进展的乳腺癌[1, 11-12]。在进展的乳腺癌中,根据是否会死亡分为:威胁生命的进展性乳腺癌和不会威胁生命的进展性乳腺癌。而威胁生命的进展性乳腺癌,根据是否死于乳腺癌再分为:死于乳腺癌的进展性乳腺癌和不会死于乳腺癌(但会死于其他竞争死亡风险)的进展性乳腺癌[11]。而死于乳腺癌的进展性乳腺癌再根据是否会因为筛查而避免乳腺癌死亡再次分为:筛查可避免的威胁生命的进展性乳腺癌和筛查不可避免的威胁生命的进展性乳腺癌,而后者也即是Welch等[13]提出的注定要发生远端转移并威胁生命的乳腺癌,筛查将不会对它们起作用。见图 1。
|
| 图 1 基于进展及死亡状态的筛查发现乳腺癌分类 |
因此,严格意义上来讲,筛查的收益只有针对图 1中的第④类乳腺癌患者才有意义。因为早期筛查出这些肿瘤,并进行干预,可以避免其进展,进而避免死于乳腺癌。相反,对于不进展的乳腺癌(第①类)和不会威胁生命的进展性乳腺癌(第②类)的诊断都可归结为过度诊断,因为筛查不会带来收益。而对于死于竞争死亡风险的进展性乳腺癌(第③类)和筛查不可避免的且会死于乳腺癌本身的进展性乳腺癌(第⑤类),筛查既不会带来收益,也不会带来过度诊断。因为这些乳腺癌患者,不论筛查与否,都会因为竞争死亡风险或不可避免的乳腺癌本身而死亡。
在此基础上,要想准确地估计过度诊断,首先需要明确乳腺癌的进展时间,进而区分进展乳腺癌和终身都不会进展的乳腺癌。但目前还没有科学的方法来记录肿瘤患者体内稳定克隆的形成时间,因此,也就很难测量从体内出现稳定肿瘤克隆发展到症状明显的乳腺癌的进展时间。间接方法是采用可测量的领先时间来评估[11],即筛查发现的乳腺癌患者相比临床自然就诊乳腺癌患者表现出的平均相对更长的生存期,也即超过领先时间仍然不进展的乳腺癌即可粗略定义为不进展的乳腺癌。但领先时间的计算基础是生存时间,且在生存时间内会发生竞争死亡风险。因此,领先时间并不完全对应肿瘤从体内出现稳定克隆到症状明显的乳腺癌的进展时间,也即肿瘤的“潜伏期”。于是采用调整领先时间的方法来估计过度诊断仍然是不足的[14-15]。
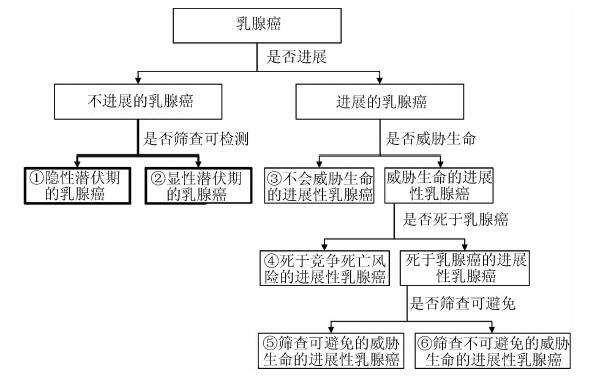
如果能在体内出现稳定肿瘤克隆到出现临床症状之间找到一个时间点,则可以相对近似地估计肿瘤的潜伏期。于是“逗留时间”的概念显得尤为重要[16-18],逗留时间是指从筛查可发现乳腺癌进展至症状明显的乳腺癌的时间。由此,可以简单将乳腺癌疾病自然史划分为4种状态:健康期、临床前期(筛查可发现的乳腺癌)、临床期(症状明显期)和死亡期[19]。如果这种自然史不被阻断(筛查发现的乳腺癌不加干预,自然进展到症状明显的临床期),结合多次筛查及长期随访,可以采用多阶段模型粗略估计4种状态之间的进展概率[19]。其中从筛查可发现乳腺癌的临床前期到症状明显的临床期的年进展概率倒数即为近似的逗留时间。而基于健康状态到临床前期的年进展概率计算得到的时间为隐性潜伏期,也即真正近似的无进展时间。相对应的逗留时间,因为筛查可发现,可以看成是显性的潜伏期。可以看到,无进展只是一个近似估计。肿瘤只要在体内形成稳定克隆,就可能进展。只是在隐性潜伏期内,部分乳腺癌进展极为缓慢,以至于现有的检测方法探测不到,所以近似认为是无进展。由此可以将上述乳腺癌分类图进一步完善(图 2)。可以看到,不进展的乳腺癌不能完全都归类于过度诊断,因为隐性潜伏期的乳腺癌尚不能被筛查方法检测到,只有筛查方法可以检测到的不进展乳腺癌才可以归类于过度诊断。但绝大部分筛查发现的乳腺癌都会经过手术切除,从而阻断了由筛查发现乳腺癌发展到症状明显的乳腺癌的自然进程。因此,也就无法采用上述的多阶段模型准确估计筛查发现乳腺癌的“逗留时间”[19]。
|
| 图 2 基于是否筛查可检测、是否进展及不同死亡状态的乳腺癌分类 |
目前并没有绝对完善的研究设计可以用于评价过度诊断,但是基于乳腺癌筛查随机干预对照试验(RCT)的长期随访研究[20-21],可以排除竞争死亡风险等的影响,因此能够相对合理地估计过度诊断的比例。相应计算思路如下:基于RCT研究,在足够长的观察时间内(理论上应该大于筛查可发现乳腺癌进展至症状明显的乳腺癌的平均逗留时间,也即显性潜伏期的时间),筛查人群相比未进行筛查的人群,超额发现的乳腺癌中,排除死于竞争死亡风险的乳腺癌(图 2第④类)和筛查不可避免的威胁生命的进展性乳腺癌(图 2第⑥类)(两者均不会从筛查中收益,也不会因为参加筛查而出现过度诊断),同时排除筛查可避免的威胁生命的乳腺癌(图 2第⑤类,筛查的真正收益),最终筛查发现的不会进展的乳腺癌(图 2第②类)及不会威胁生命的进展性乳腺癌(图 2第③类),即为真正过度诊断的乳腺癌。后者占整个筛查组发现的乳腺癌的比例,即为乳腺癌筛查过度诊断的比例。
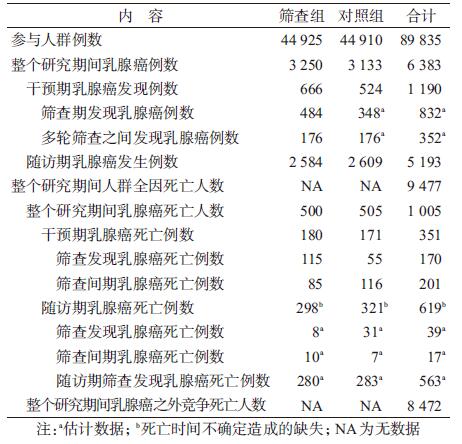
截至目前,国内外共有8项质量相对较高的乳腺X线筛查乳腺癌的RCT研究,包括早期美国纽约市开展的卫生保险计划(Health Insurance Plan,HIP)研究[22-23],加拿大全国乳腺癌筛查研究(Canadian National Breast Cancer Screening,CNBSS)[24-25],英国的Age研究[26-27],Stockholm研究[28-29],Malmo筛查试验研究(Malmo Mammographic Screening Trial,MMST-Ⅰ/MMST-Ⅱ)[30-31],Gothenburg研究[32-33],瑞士双郡研究(Swedish Two-County)[34-35],以及Edinburgh研究[36-37]。然而,这8项RCT,仅有CNBSS和MMST两项研究进行了质量较高的过度诊断评价[20-21]。而MMST研究所能提供的数据相对较少,无法完成基于本研究框架下的过度诊断评价,于是最终采用2014年Miller等[20]发表的CNBSS研究25年随访研究的结果进行过度诊断评价。见表 1。
原文中并没有提供表 1中标注的数据,主要根据以下理论假设估计得到:①多轮筛查之间发现的乳腺癌,由于没有筛查的影响,在假定筛查组筛查方法没有明显漏诊的情况下,筛查组和对照组相应间期乳腺癌的发生率应近似相同。因此,根据筛查组筛查间期癌的发生率,可以近似估计得到对照组筛查间期癌的发生例数。同时,基于对照组干预期乳腺癌发现总数和筛查间期乳腺癌例数,可以计算得到对照组筛查期发现乳腺癌例数。②在随访期,除了筛查组筛查发现乳腺癌理论上分期较早,预后更好,长期死亡率更低外,筛查组和对照组,不论是筛查间期乳腺癌的长期死亡率,还是随访期筛查发现乳腺癌的长期死亡率,因为没有筛查的影响,理论上都应该很接近,而且与对照组在筛查期发现乳腺癌(同样未受到筛查的影响)的长期死亡率相似。排除干预期已经死亡的乳腺癌,基于以上假设可以估算得到上述表格相应随访期筛查组和对照组不同原因的乳腺癌死亡例数。
在表 1的基础上,结合本研究的评价框架,可以分别计算得到以下参数:①筛查组相对对照组超额发现的乳腺癌例数:484-44 915×(348/44 910)=136。②乳腺癌竞争死亡风险概率:8 472÷89 835×100%=9.4%。因为乳腺癌筛查并不会对乳腺癌之外的竞争死亡风险产生影响,因此,采用人群总体的竞争死亡风险来估计乳腺癌患者中的竞争死亡风险。③筛查不可避免的威胁生命的乳腺癌病死率,即对照组整个研究期间发现所有乳腺癌的病死率:505÷3 133×100%=16.1%。④筛查可避免的威胁生命的乳腺癌病死率,即筛查的净收益。最保守的估计为对照组与筛查组整个研究期间发现所有乳腺癌的病死率之差:(505÷3 133)×100%-(500÷3 250)×100%=0.7%。相对严格的估计应为:筛查组筛查期发现乳腺癌在干预期之后的长期病死率与对照组相应定义下乳腺癌的长期死亡率之差。排除干预期已经死亡的乳腺癌患者,主要是考虑人群现患乳腺癌患者较高的死亡率(从表 1中可以看到这种现象)对过度诊断估计的混杂影响。基于该理论,相应的筛查净收益:31÷(348-55)×100%-8÷(484-115)×100%=8.4%。⑤基于以上参数,筛查组超额发现的乳腺癌例数中,可能发生过度诊断的乳腺癌例数的上限:136×(1-9.4%-16.1%-0.7%)=100例,下限:136 ×(1-9.4%-16.1%-8.4%)=90例。⑥根据英国乳腺癌筛查独立评价小组对乳腺癌筛查过度诊断不同评价方法比较之后的总结,虽然目前并没有绝对完善的方法可以用于评价过度诊断,但以下两种算法相对更加合适:①从人群的角度考虑,过度诊断应该为被超额诊断的乳腺癌与邀请筛查的女性在干预期(包括筛查期和筛查间期)及随访期诊断的所有乳腺癌之比;②从邀请参加筛查的女性角度考虑,过度诊断应该为被超额诊断的乳腺癌与邀请筛查的女性在筛查期内诊断的乳腺癌之比[7]。但是基于本文的评价框架,筛查间期癌,尤其是干预期之后随访期发现的乳腺癌,与筛查并没有直接的关联,因此,从人群的角度来评估过度诊断,可能低估过度诊断比例。所以本文最终采用参加筛查的女性角度来评价过度诊断。相应过度诊断比例的上限:100÷484×100%=20.7%,下限:90÷484×100%=18.6%。
上述过度诊断的估计过程中,除了多种假设可能对结果造成的影响外,另外两个方面的影响也不可忽视:①CNBSS研究采用的筛查间隔为1年,同时进行了5轮筛查。但在这5轮筛查当中,出现约26.4%(176/666)的筛查间期癌,间期癌的比例相对偏高。其可能的原因包括:首先,CNBSS中采用的乳腺X线检查设备相对落后导致的漏诊。这也是该研究与其他RCT研究相比,筛查收益偏小的最主要原因,通过提高设备的准确性将有可能避免或减少这类间期癌。其次,在筛查间期内自然发生的乳腺癌。这类间期癌通常很难避免,但可以通过完善肿瘤登记来减少漏报。②RCT研究人群是从一般人群按照一定的入选标准选取的,因此,基于RCT得到的结果在一般人群的推广上会存在一定的局限性[2]。针对该局限性,有研究者提出两种基于大规模自然人群的长期随访研究来间接估计乳腺癌筛查过度诊断的方法,包括:第一,人群实施筛查前后的自身乳腺癌发病率及死亡率的比较研究[6, 10, 38];第二,筛查地区与未筛查地区的人群乳腺癌发病率及死亡率的比较研究[39-41]。但是这些方法同样存在一些偏倚。第一种方法通常时间跨度很大,偏倚的主要来源是因为年代不同而造成的各种混杂偏倚。也即处于不同年代的人群,因为人群危险因素的暴露不同,以及其他医疗环境及社会政策的不同,不同年代的人群乳腺癌的发病率及死亡率均会有显著差异。因此,如果只是以未筛查前固定时间点的乳腺癌发病率为参照(并假定乳腺癌的疾病负担相对稳定)来估计筛查的过度诊断,很可能会将所有混杂作用的影响都将归结为筛查导致的过度诊断,尤其是当与筛查不相关的乳腺癌特定危险因素的暴露水平(如肥胖、初潮年龄的提前、口服避孕药及激素替代疗法的使用等)不断增加的情况下,这种偏倚会更加明显,从而严重高估筛查的过度诊断。这也是Welch等[10]研究的主要问题所在。而对于第二种方法,最主要的偏倚来源是筛查人群和对照人群并非来自同一人群,从而造成筛查地区与未筛查地区很多基线特征不可比,进而同样将潜在的混杂偏倚归结为过度诊断的影响,从而高估过度诊断。
(3) 如何避免过度诊断回顾乳腺癌筛查产生的基础,筛查发现的乳腺癌中有一部分乳腺癌终身不进展,或不会威胁生命。因此,为避免或减少过度诊断,未来采用的筛查模式应该是:①尽可能找到能够将发生转移或威胁生命的高危乳腺癌与不发生转移或威胁生命的低危乳腺癌很好地区分开的生物标志物[42]。首先利用这些生物标志物对人群进行初筛,然后再采用现有的筛查方法进行筛查。②尽可能找到能直接区分上述高危与低危乳腺癌的筛查方法。然而这两者模式均还只是处于假设阶段,目前还没有方法能准确预测哪些乳腺癌会发生转移或威胁生命,尤其是从筛查发现的早期癌中区分出这些可发生转移或可威胁生命的乳腺癌。③基于过度诊断产生的基础,分别从被检查者和检查医生的角度考虑,可以发现过度诊断产生的两个主观因素:第一,被检查者担心自己会患癌,同时担心自己患癌后会危及生命,从而愿意盲目过度地接受筛查,并在发现乳腺癌之后,更愿意盲目地接受过度的治疗来排除癌症的影响。第二,检查医生在不确定筛查结果的情况下,更倾向于建议被检查者接受过度检查以避免可能的诊断失误。为规范这两方面的主观因素的影响,有必要建立统一、规范、合理、科学的乳腺癌筛查指南。同时在指南的指导下,筛查前重视知情同意,告知筛查带来收益的同时,充分告知筛查可能造成的过度诊断、心理负担等风险,在权衡利弊之后再决定是否进行筛查[43]。
总之,筛查在有些情况下确实会来收益,但同时也会给一部分人带来过度诊断。为了有效地控制过度诊断,首先必须系统认识过度诊断产生的原因,进而正确评价过度诊断。在此基础上,转变筛查策略,倾向于选择能够更好地发现高危乳腺癌的筛查方法,并对参与筛查者充分地告知过度诊断所带来的经济负担及心理负担,才有可能减少或者避免过度诊断。
利益冲突: 无
| [1] | Welch HG, Black WC. Overdiagnosis in cancer[J]. J Natl Cancer Inst, 2010, 102(9): 605–613. DOI:10.1093/jnci/djq099 |
| [2] | Carter JL, Coletti RJ, Harris RP. Quantifying and monitoring overdiagnosis in cancer screening:a systematic review of methods[J]. BMJ, 2015, 350: g7773. DOI:10.1136/bmj.g7773 |
| [3] | Myers ER, Moorman P, Gierisch JM, et al. Benefits and harms of breast cancer screening:a systematic review[J]. JAMA, 2015, 314(15): 1615–1634. DOI:10.1001/jama.2015.13183 |
| [4] | Lauby-Secretan B, Scoccianti C, Loomis D, et al. Breast-cancer screening-viewpoint of the IARC working group[J]. N Engl J Med, 2015, 372(24): 2353–2358. DOI:10.1056/NEJMsr1504363 |
| [5] | Biller-Andorno N, Jüni P. Abolishing mammography screening programs? A view from the Swiss medical board[J]. N Engl J Med, 2014, 370(21): 1965–1967. DOI:10.1056/NEJMp1401875 |
| [6] | Bleyer A, Welch HG. Effect of three decades of screening mammography on breast-cancer incidence[J]. N Engl J Med, 2012, 367(21): 1998–2005. DOI:10.1056/NEJMoa1206809 |
| [7] | Independent UK Panel on Breast Cancer Screening. The benefits and harms of breast cancer screening:an independent review[J]. Lancet, 2012, 380(9855): 1778–1786. DOI:10.1016/S0140-6736(12)61611-0 |
| [8] | Friedewald SM, Rafferty EA, Rose SL, et al. Breast cancer screening using tomosynthesis in combination with digital mammography[J]. JAMA, 2014, 311(24): 2499–2507. DOI:10.1001/jama.2014.6095 |
| [9] | Shin HJ, Kim HH, Cha JH. Current status of automated breast ultrasonography[J]. Ultrasonography, 2015, 34(3): 165–172. DOI:10.14366/usg.15002 |
| [10] | Welch HG, Prorok PC, O'Malley AJ, et al. Breast-cancer tumor size, overdiagnosis, and mammography screening effectiveness[J]. N Engl J Med, 2016, 375(15): 1438–1447. DOI:10.1056/NEJMoa1600249 |
| [11] | Baker SG, Prorok PC, Kramer BS. Lead time and overdiagnosis[J]. J Natl Cancer Inst, 2014, 106(12): dju346. DOI:10.1093/jnci/dju346 |
| [12] | Etzioni R, Xia J, Hubbard R, et al. A reality check for overdiagnosis estimates associated with breast cancer screening[J]. J Natl Cancer Inst, 2014, 106(12): dju315. DOI:10.1093/jnci/dju315 |
| [13] | Welch HG, Gorski DH, Albertsen PC. Trends in metastatic breast and prostate cancer-lessons in cancer dynamics[J]. N Engl J Med, 2015, 373(18): 1685–1687. DOI:10.1056/NEJMp1510443 |
| [14] | Paci E, Miccinesi G, Puliti D, et al. Estimate of overdiagnosis of breast cancer due to mammography after adjustment for lead time. A service screening study in Italy[J]. Breast Cancer Res, 2006, 8(6): R68. DOI:10.1186/bcr1625 |
| [15] | Beckmann K, Duffy SW, Lynch J, et al. Estimates of over-diagnosis of breast cancer due to population-based mammography screening in South Australia after adjustment for lead time effects[J]. J Med Screen, 2015, 22(3): 127–135. DOI:10.1177/0969141315573978 |
| [16] | Cong XJ, Shen Y, Miller AB. Estimation of age-specific sensitivity and sojourn time in breast cancer screening studies[J]. Stat Med, 2005, 24(20): 3123–3138. DOI:10.1002/sim.2178 |
| [17] | Shen Y, Zelen M. Robust modeling in screening studies:estimation of sensitivity and preclinical sojourn time distribution[J]. Biostatistics, 2005, 6(4): 604–614. DOI:10.1093/biostatistics/kxi030 |
| [18] | Shen Y, Zelen M. Screening sensitivity and sojourn time from breast cancer early detection clinical trials:mammograms and physical examinations[J]. J Clin Oncol, 2001, 19(15): 3490–3499. DOI:10.1200/jco.2001.19.15.3490 |
| [19] | Taghipour S, Banjevic D, Miller AB, et al. Parameter estimates for invasive breast cancer progression in the Canadian National Breast Screening Study[J]. Br J Cancer, 2013, 108(3): 542–548. DOI:10.1038/bjc.2012.596 |
| [20] | Miller AB, Wall C, Baines CJ, et al. Twenty five year follow-up for breast cancer incidence and mortality of the Canadian National Breast Screening Study:randomised screening trial[J]. BMJ, 2014, 348: g366. DOI:10.1136/bmj.g366 |
| [21] | Zackrisson S, Andersson I, Janzon L, et al. Rate of over-diagnosis of breast cancer 15 years after end of Malmömammographic screening trial:follow-up study[J]. BMJ, 2006, 332(7543): 689–692. DOI:10.1136/bmj.38764.572569.7C |
| [22] | Habbema JD, van Oortmarssen GJ, van Putten DJ, et al. Age-specific reduction in breast cancer mortality by screening:an analysis of the results of the Health Insurance Plan of Greater New York study[J]. J Natl Cancer Inst, 1986, 77(2): 317–320. DOI:10.1093/jnci/77.2.317 |
| [23] | Shapiro S, Venet W, Strax P, et al. Ten-to fourteen-year effect of screening on breast cancer mortality2[J]. J Natl Cancer Inst, 1982, 69(2): 349–355. DOI:10.1093/jnci/69.2.349 |
| [24] | Miller AB, Baines CJ, To T, et al. Canadian national breast screening study:1. Breast cancer detection and death rates among women aged 40 to 49 years[J]. CMAJ, 1992, 147(10): 1459–1476. |
| [25] | Miller AB, Baines CJ, To T, et al. Canadian national breast screening study:2. Breast cancer detection and death rates among women aged 50 to 59 years[J]. CMAJ, 1992, 147(10): 1477–1488. |
| [26] | Moss SM, Wale C, Smith R, et al. Effect of mammographic screening from age 40 years on breast cancer mortality in the UK Age trial at 17 years' follow-up:a randomised controlled trial[J]. Lancet Oncol, 2015, 16(9): 1123–1132. DOI:10.1016/S1470-2045(15)00128-X |
| [27] | Moss SM, Cuckle H, Evans A, et al. Effect of mammographic screening from age 40 years on breast cancer mortality at 10 years' follow-up:a randomised controlled trial[J]. Lancet, 2006, 368(9552): 2053–2060. DOI:10.1016/S0140-6736(06)69834-6 |
| [28] | Frisell J, Eklund G, Hellström L, et al. Randomized study of mammography screening-preliminary report on mortality in the Stockholm trial[J]. Breast Cancer Res Treat, 1991, 18(1): 49–56. DOI:10.1007/BF01975443 |
| [29] | Frisell J, Glas U, Hellström L, et al. Randomized mammographic screening for breast cancer in Stockholm. Design, first round results and comparisons[J]. Breast Cancer Res Treat, 1986, 8(1): 45–54. DOI:10.1007/BF01805924 |
| [30] | Tabár L, Duffy S. Malmo mammographic screening trial[J]. BMJ, 1989, 298(6665): 48–49. DOI:10.1136/bmj.298.6665.48-d |
| [31] | Andersson I, Aspegren K, Janzon L, et al. Mammographic screening and mortality from breast cancer:the Malmömammographic screening trial[J]. BMJ, 1988, 297(6654): 943–948. DOI:10.1136/bmj.297.6654.943 |
| [32] | Bjurstam N, Björneld L, Warwick J, et al. The Gothenburg breast screening trial[J]. Cancer, 2003, 97(10): 2387–2396. DOI:10.1002/cncr.11361 |
| [33] | Bjurstam N, Bjorneld L, Duffy SW, et al. The Gothenburg breast screening trial:first results on mortality, incidence, and mode of detection for women ages 39-49 years at randomization[J]. Cancer, 1997, 80(11): 2091–2099. DOI:10.1002/(ISSN)1097-0142 |
| [34] | Nyström L, Andersson I, Bjurstam N, et al. Long-term effects of mammography screening:updated overview of the Swedish randomised trials[J]. Lancet, 2002, 359(9310): 909–919. DOI:10.1016/S0140-6736(02)08020-0 |
| [35] | Nyström L, Wall S, Rutqvist LE, et al. Breast cancer screening with mammography:overview of Swedish randomised trials[J]. Lancet, 1993, 341(8851): 973–978. DOI:10.1016/0140-6736(93)91067-V |
| [36] | Alexander FE, Anderson TJ, Brown HK, et al. 14 years of follow-up from the Edinburgh randomised trial of breast-cancer screening[J]. Lancet, 1999, 353(9168): 1903–1908. DOI:10.1016/S0140-6736(98)07413-3 |
| [37] | Alexander FE, Anderson TJ, Brown HK, et al. The Edinburgh randomised trial of breast cancer screening:results after 10 years of follow-up[J]. Br J Cancer, 1994, 70(3): 542–548. DOI:10.1038/bjc.1994.342 |
| [38] | Harding C, Pompei F, Burmistrov D, et al. Breast cancer screening, incidence, and mortality across US counties[J]. JAMA Intern Med, 2015, 175(9): 1483–1489. DOI:10.1001/jamainternmed.2015.3043 |
| [39] | Njor SH, Olsen AH, Blichert-Toft M, et al. Overdiagnosis in screening mammography in Denmark:population based cohort study[J]. BMJ, 2013, 346: f1064. DOI:10.1136/bmj.f1064 |
| [40] | Kalager M, Adami HO, Bretthauer M, et al. Overdiagnosis of invasive breast cancer due to mammography screening:results from the Norwegian screening program[J]. Ann Intern Med, 2012, 156(7): 491–499. DOI:10.7326/0003-4819-156-7-201204030-00005 |
| [41] | Peeters PH, Verbeek ALM, Straatman H, et al. Evaluation of overdiagnosis of breast cancer in screening with mammography:results of the Nijmegen programme[J]. Int J Epidemiol, 1989, 18(2): 295–299. DOI:10.1093/ije/18.2.295 |
| [42] | Esserman L, Shieh Y, Thompson I. Rethinking screening for breast cancer and prostate cancer[J]. JAMA, 2009, 302(15): 1685–1692. DOI:10.1001/jama.2009.1498 |
| [43] | Van den Bruel A, Jones C, Yang YL, et al. People's willingness to accept overdetection in cancer screening:population survey[J]. BMJ, 2015, 350: h980. DOI:10.1136/bmj.h980 |
 2017, Vol. 38
2017, Vol. 38