文章信息
- 熊海燕, 罗业飞, 刘海燕, 韩文晖, 胡安群, 汪艳, 郑英杰.
- Xiong Haiyan, Luo Yefei, Liu Haiyan, Han Wenhui, Hu Anqun, Wang Yan, Zheng Yingjie.
- 酶联免疫吸附试验和电化学发光免疫法检测孕妇乙型肝炎表面抗原结果的比较
- Comparison of results of two immunoassays for detection of hepatitis B surface antigen in pregnant women
- 中华流行病学杂志, 2017, 38(11): 1537-1540
- Chinese Journal of Epidemiology, 2017, 38(11): 1537-1540
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2017.11.020
-
文章历史
收稿日期: 2017-03-21
2. 200032 上海, 复旦大学国家卫生和计划生育委员会卫生技术评估重点实验室;
3. 200032 上海, 复旦大学公共卫生安全教育部重点实验室;
4. 246003 安徽省安庆市市立医院检验科;
5. 246003 安徽省安庆市市立医院妇产科
2. Key Laboratory for Health Technology Assessment, National Commission of Health and Family Planning, Ministry of Education-School of Public Health, Fudan University, Shanghai 200032, China;
3. Key Laboratory for Public Health Safety, Ministry of Education-School of Public Health, Fudan University, Shanghai 200032, China;
4. Department of Clinical Laboratory, Anqing City Hospital, Anqing 246003, China;
5. Department of Gynaecology and Obstetrics, Anqing City Hospital, Anqing 246003, China
HBV显性感染的常规判定标准为HBsAg检测阳性,目前常用的检测方法有ELISA、电化学发光免疫法(ECLIA)、时间分辨荧光免疫分析技术(TRFIA)及化学发光免疫分析法(CLIA)等。其中ELISA常用于HBsAg定性检测,而灵敏度更高的ECLIA可用于定量或半定量检测[1],但对于两种方法检测结果不一致样本的判定还存在疑问,其中仍可能存在HBV DNA阳性样本。母婴传播是HBV感染的主要途径[2-4],因此对孕妇人群HBV感染判定的准确性尤为重要,且直接影响新生儿接受乙型肝炎疫苗的免疫策略[5]。为此本研究建立孕妇队列,采用ELISA和ECLIA两种方法检测HBsAg,评价两者的一致性及其影响因素,分析不同阳性组别HBV S基因片段分子进化特征。
对象与方法 (1) 标本来源招募2014年1月1日至2015年1月31日安庆市市立医院收住的所有分娩孕妇,其中分娩活产儿的孕妇为研究对象。排除标准为非活产(包括流产、引产、死胎等)、拒绝参与本研究及血标本量不足的孕妇。共纳入住院活胎分娩孕妇2 296例。
(2) 研究方法通过医院电子病历信息系统取得入院临床记录,本研究自拟调查问卷收集孕妇人口学等资料。并在知情同意下,于孕妇入院后第2天,抽取外周静脉血5 ml:室温静置约1 h后,以4 000 r/min离心15 min,吸取足量的上清液置于灭菌Eppendorf管,双管(A、B)分装,置-80 ℃保存备检。孕妇血清A管使用ELISA和ECLIA进行HBsAg平行检测。ELISA检测结果判定按试剂厂家说明书规定的Cut-off值作为判断标准,夹心法检测HBsAg S/CO≥1.0为阳性。ECLIA检测HBsAg阳性的判断标准为结果值>0.05。对所有B管血清采用天根生化科技(北京)有限公司生产的TIANamp Virus DNA/RNA Kit试剂盒(批号:DP315),严格按操作说明书抽提DNA,储存于-20 ℃备检。使用巢式PCR检测HBV S和pre S片段,阳性结果需不同实验室和不同操作者再次重复实验,结果仍为阳性者确认为阳性,本实验室HBV S和pre S片段PCR扩增灵敏度分别为118~1 180拷贝/ml和11.8~118拷贝/ml。
(3) 统计学分析统计分析采用SPSS 19.0软件。定量资料采用M和四分位间距(QR);定性资料的比例比较使用Pearson χ2检验或行×列表χ2检验或Fisher确切概率法或Possion检验,对其中三组总体不全一致的进行四格表χ2检验或Fisher确切概率法两两比较,并采用Bonferroni校正。定量指标比较使用Kruskal-Wallis秩检验,对其中三组总体不全一致的进行Mann-Whitney检验两两比较,并采用Bonferroni校正。所有P值均为双侧检验,以P<0.05为差异有统计学意义。
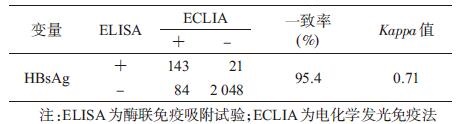
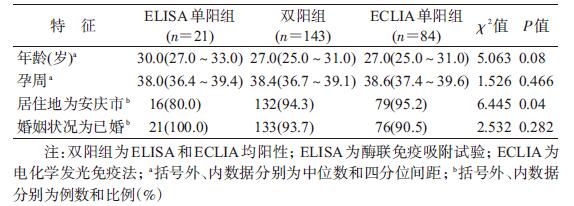
结果 (1) 两种方法检测HBsAg的比较2 296例孕妇标本中,ELISA检出164例阳性,阳性率为7.1%;ECLIA检出227例阳性,阳性率为9.9%。两种方法检测一致率为95.4%,Kappa=0.71,两种方法的一致性程度较高(表 1)。以ECLIA为确证法计算,ELISA灵敏度为63.0%,特异度为99.0%。按不同的人口学特征分组,两种方法检测结果比较均为ECLIA优于ELISA。依据ELISA和ECLIA检测HBsAg阳性结果,分为ELISA单阳组、ELISA和ECLIA双阳组以及ECLIA单阳组,分析显示三组孕妇在年龄、孕周及婚姻状况的差异无统计学意义;ELISA单阳组与ECLIA单阳组比较,在年龄和居住地的差异有统计学意义(P<0.05)。见表 2。
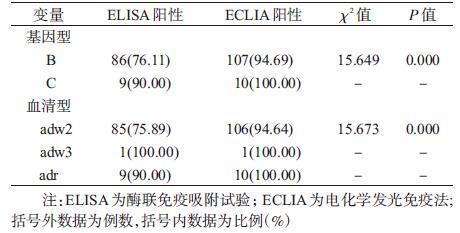
共获得HBV S基因片段序列123条,进化树见图 1。其中B基因型113条(91.7%),C基因型10条(8.3%);adw2血清型112条(91.1%),adw3血清型1条(0.8%),adr血清型10条(8.1%)。两种方法检测不同基因型病毒株,结果显示B基因型的差异有统计学意义(P<0.05),C基因型的差异无统计学意义;检测不同血清型的结果显示,adw2血清型差异有统计学意义(P<0.05),adw3和adr血清型差异均无统计学意义(表 3)。ELISA单阳、ELISA和ECLIA双阳以及ECLIA单阳组间基因型与血清型分布的差异无统计学意义。
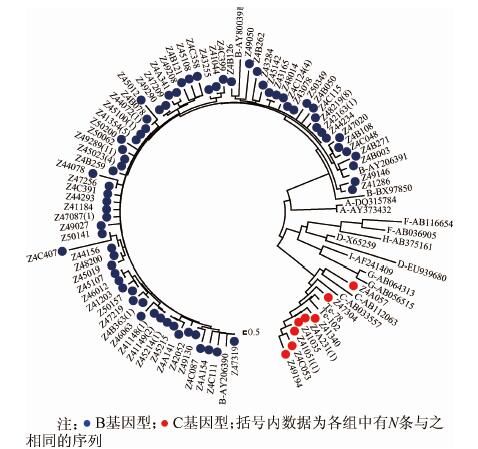
|
| 图 1 HBsAg阳性孕妇HBV S基因片段分子进化树 |
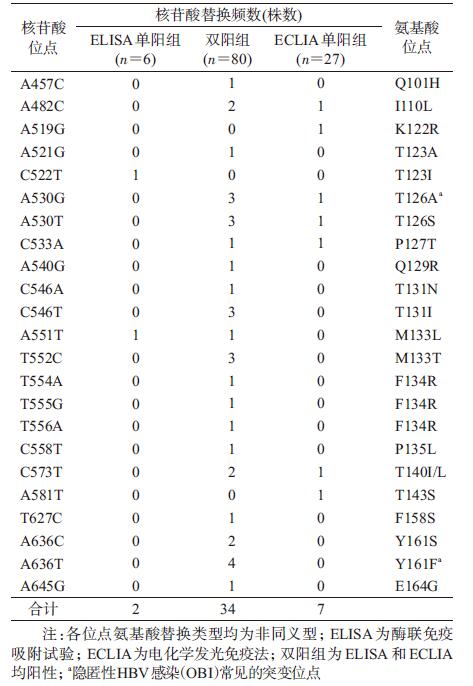
因C基因型HBV株数少,故只分析B基因型。结果显示两种方法检测不同变异位点的差异均无统计学意义。分析HBsAg不同阳性组别序列变异,总体核苷酸和氨基酸位点替换率的差异无统计学意义[ELISA单阳组,核苷酸为3.7‰即12/(6×544),氨基酸为8.3‰即9/(6×181);ELISA和ECLIA双阳组,核苷酸为4.0‰即172/(80×544),氨基酸为6.6‰即95/(80×181);ECLIA单阳组,核苷酸为2.5‰即36/(27×544),氨基酸为7.4‰即36/(27×181)],P>0.05。共95个位点发生核苷酸替换,ELISA单阳组、ELISA和ECLIA双阳组及ECLIA单阳组分别出现10、81和26个;三组间核苷酸替换率的差异无统计学意义。共49个位点发生氨基酸替换,ELISA单阳组、ELISA和ECLIA双阳组及ECLIA单阳组分别出现8、40和16个;主要亲水区(MHR)99~169位的氨基酸共16个位点发生非同义替换(表 4),其中ELISA单阳组和ECLIA单阳组未在任一相同位点出现替换(图 2)。三组间氨基酸替换率的差异无统计学意义。
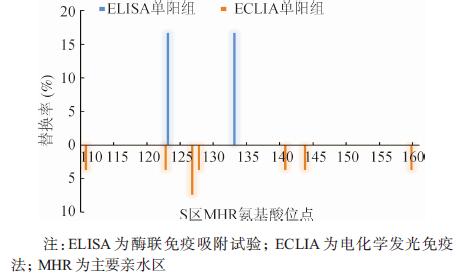
|
| 图 2 HBV基因B型ELISA单阳组与ECLIA单阳组病毒株MHR氨基酸替换比较 |
本研究发现ELISA和ECLIA检测孕妇HBsAg具有高度的一致性,但两种方法检测HBV病毒株B基因型和adw2血清型结果的差异有统计学意义,均为ECLIA优于ELISA。B基因型病毒株进化分析显示,两种方法检测氨基酸或核苷酸替换位点的差异无统计学意义,但ELISA单阳组和ECLIA单阳组在MHR第110~160位出现完全互补的氨基酸替换位点。
既往研究显示ELISA与ECLIA检测HBsAg均有较好的一致性[6-8]。本研究采用ELISA初步检验,阳性者采取ECLIA复测,结果阳性则判定为阳性,若阴性则判定为假阳性。然而发现在ELISA单阳组,即“假阳性组”和ECLIA单阳组分别仍存在28.6%和33.3%的HBV DNA阳性率。因此本研究进一步探讨不一致性可能的分子差异。
现有的HBsAg检测技术主要是基于α抗原决定簇的抗原抗体反应而建立,α抗原决定簇位于HBsAg的MHR内,是第124和147位氨基酸间的蛋白三级结构。本研究未发现两种方法检测结果或不同阳性组别在MHR的核苷酸或氨基酸替换位点的差异有统计学意义。持续性HBV DNA阳性也可呈现为OBI,是血清学HBsAg检测为阴性的HBV感染,即出现检测逃避[9];OBI病毒株中报道较多的MHR变异有G145R、P120T、I/T126N/A、Y161F等[10-11],本研究所获得的病毒株出现相同的变异有T126A和Y161F。Huang等[12]研究发现,OBI病毒株发生在MHR的C124R、C124Y、K141E以及D144A位点变异可以显著降低常见HBsAg检测试剂的灵敏度(包括本研究所使用的试剂盒),本研究中ELISA和ECLIA单阳组所获得的病毒株未出现相同的位点变异,提示其可能不具有OBI病毒株的明显特征。
将ELISA和ECLIA两单阳组比较发现,在MHR第110~160位出现完全不重叠的氨基酸替换位点,即两种方法可以识别不同的变异位点,提示该两种方法同时使用可能更准确的检出HBsAg阳性感染者,从而降低该两组感染者在孕妇中可能造成的静默传播和母婴传播。
本研究存在不足。如无HBV DNA定量检测结果,无法更好阐述两种方法的一致性程度。基于本研究是大样本队列分析结果,故建议临床检验应合并使用ELISA和ECLIA检测,以防控孕妇人群HBV感染保障母婴健康。
利益冲突: 无
| [1] | Kim H, Oh EJ, Kang MS, et al. Comparison of the Abbott Architect i2000 assay, the Roche Modular Analytics E170 assay, and an immunoradiometric assay for serum hepatitis B virus markers[J]. Ann Clin Lab Sci, 2007, 37(3): 256–259. |
| [2] | Giles ML, Visvanathan K, Lewin SR, et al. Chronic hepatitis B infection and pregnancy[J]. Obstet Gynecol Surv, 2012, 67(1): 37–44. DOI:10.1097/OGX.0b013e31823e464b |
| [3] | Saito T, Shinzawa H, Uchida T, et al. Quantitative DNA analysis of low-level hepatitis B viremia in two patients with serologically negative chronic hepatitis B[J]. J Med Virol, 1999, 58(4):325-331. DOI:10.1002/(SICI)1096-9071(199908)58:4<325::AID-JMV2>3.0.CO; 2-L. |
| [4] | Yao QQ, Dong XL, Wang XC, et al. Hepatitis B virus surface antigen (HBsAg)-positive and HBsAg-negative hepatitis B virus infection among mother-teenager pairs 13 years after neonatal hepatitis B virus vaccination[J]. Clin Vaccine Immunol, 2013, 20(2): 269–275. DOI:10.1128/CVI.00539-12 |
| [5] |
中华医学会肝病学分会, 中华医学会感染病学分会.
慢性乙型肝炎防治指南(2015年更新版)[J]. 临床肝胆病杂志, 2015, 31(12): 1941–1960.
Chinese Society of Hepatology, Chinese Medical Asso, Chinese Society of Infectious Diseases, Chinese Med. The guideline of prevention and treatment for chronic hepatitis B:a 2015 update[J]. J.Clin Hepatol, 2015, 31(12): 1941–1960. DOI:10.3969/j.issn.1001-5256.2015.12.002 |
| [6] |
左立新.
不同方法学检测乙型肝炎血清标志物结果的应用研究[J]. 当代医学, 2014, 20(23): 116–117.
Zuo LX. Study on the application of different methods in the detection of hepatitis B serum markers[J]. Contemp Med, 2014, 20(23): 116–117. DOI:10.3969/j.issn.1009-4393.2014.23.085 |
| [7] | Xu WZ, Li Y, Wang M, et al. Comparison of two immunoassays for determining hepatitis B virus serum markers[J]. Clin Chem Lab Med, 2011, 50(1): 153–157. DOI:10.1515/CCLM.2011.721 |
| [8] | Liu C, Chen TB, Lin JP, et al. Evaluation of the performance of four methods for detection of hepatitis B surface antigen and their application for testing 116, 455 specimens[J]. J Virol Methods, 2014, 196: 174–178. DOI:10.1016/j.jviromet.2013.10.039 |
| [9] | Samal J, Kandpal M, Vivekanandan P. Molecular mechanisms underlying occult hepatitis B virus infection[J]. Clin Microbiol Rev, 2012, 25(1): 142–163. DOI:10.1128/CMR.00018-11 |
| [10] | Hsu CW, Yeh CT, Chang ML, et al. Identification of a hepatitis B virus S gene mutant in lamivudine-treated patients experiencing HBsAg seroclearance[J]. Gastroenterology, 2007, 132(2): 543–550. DOI:10.1053/j.gastro.2006.12.001 |
| [11] | Carman WF, Karayiannis P, Waters J, et al. Vaccine-induced escape mutant of hepatitis B virus[J]. Lancet, 1990, 336(8711): 325–329. DOI:10.1016/0140-6736(90)91874-A |
| [12] | Huang CH, Yuan Q, Chen PJ, et al. Influence of mutations in hepatitis B virus surface protein on viral antigenicity and phenotype in occult HBV strains from blood donors[J]. J Hepatol, 2012, 57(4): 720–729. DOI:10.1016/j.jhep.2012.05.009 |
 2017, Vol. 38
2017, Vol. 38