文章信息
- 宋志超, 丁玲, 任志英, 孙雪松, 杨倩, 王璐, 冯美娟, 刘春亮, 王金桃.
- Song Zhichao, Ding Ling, Ren Zhiying, Sun Xuesong, Yang Qian, Wang Lu, Feng Meijuan, Liu Chunliang, Wang Jintao.
- Src介导ERK信号通路对宫颈癌细胞增殖凋亡的作用
- Effects of Src on cervical cancer cells proliferation and apoptosis through ERK signal transduction pathway
- 中华流行病学杂志, 2017, 38(9): 1246-1251
- Chinese journal of Epidemiology, 2017, 38(9): 1246-1251
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2017.09.021
-
文章历史
收稿日期: 2016-12-26
2. 030001 太原, 山西省心血管病医院社区健康中心
2. Community Health Centre, Shanxi Cardiovascular Hospital, Taiyuan 030001, China
全球每年约有53万宫颈癌新发病例和27万宫颈癌死亡病例[1]。2015年我国约有10万宫颈癌新发病例和3万死亡病例[2]。众所周知,高危型人乳头瘤病毒(HR-HPV)反复和持续感染是宫颈癌发生的主要病因,但非唯一因素[3]。有文献报道,宫颈癌患者的5年累积生存率为50%左右,这一数值在过去的20年中并未明显提高[4]。因此,寻找HPV以外的其他因素成为当前宫颈癌病因研究的热点。原癌基因Src是首个被发现可诱导细胞转化的基因。在正常组织和细胞中,细胞癌基因c-Src以磷酸化的形式发挥作用。Src激酶作为连接细胞内外许多重要信号通路的膜结合开关分子,被细胞膜表面的多种信号激活后,可以调控多种与肿瘤发生、发展有关的信号转导通路[5]。细胞外信号调节激酶(ERK)信号通路是其中最重要的一条。有文献报道,ERK信号通路在多种肿瘤的发生发展中起重要调节作用。作为Ras-Raf-MEK-ERK信号通路的重要成分,ERK可将细胞外各种刺激信号传递到细胞内。磷酸化的ERK(p-ERK)是ERK信号通路活化的标志,它可以介导信号由细胞质向细胞核传递,通过上调或下调核转录因子c-myc、c-Fos、c-Jun、cyclin-D1、Bcl-2等蛋白的表达,参与调节细胞的生长、发育、分化、凋亡等多种生理过程,并在细胞的恶性转化中发挥重要作用[6]。本研究采用体外细胞实验的方法,在宫颈癌细胞Hela和C33A中,以ERK信号通路关键因子ERK 1/2、c-Fos和c-Jun为靶点,检测Src抑制前后ERK 1/2、c-Fos和c-Jun蛋白及mRNA表达的变化,以评价Src对宫颈癌细胞中ERK信号通路关键因子的调节作用。
材料与方法1.细胞株的选择与培养:将宫颈癌细胞Hela(HPV阳性)和C33A(HPV阴性)置于DEME medium和MEM-NEAA medium培养基中进行培养及传代。
2. Src激酶的抑制:选择PP2作为Src激酶抑制剂,通过对不同时间不同浓度抑制效果的比较,最终确定20 μmol/L、24 h和12 μmol/L、24 h为Hela和C33A细胞的最适抑制浓度和时间。将Src抑制前后分别设为对照组和实验组,进行后续实验。
3.实验方法:
(1)FCM分析细胞周期及凋亡:取对数生长期细胞(1×105/ml),用0.25%的胰蛋白酶进行消化,PBS冲洗两次后,经70%乙醇固定冷藏过夜,去除乙醇,PBS洗涤2次,经400目尼龙网过滤,加入Annexin V-PE染液染色,于流式细胞仪上检测细胞周期各时相变化及凋亡情况。
(2)Real-time PCR法检测ERK 1/2、c-Jun、c-Fos的mRNA水平:取宫颈癌细胞(1×106/ml),采用TransZol试剂(北京全式金生物技术有限公司)提取总RNA,用紫外分光光度计测定样本RNA纯度。采用First-Strand cDNA Synthesis Super Mix试剂(北京全式金生物技术有限公司)对RNA样品进行反转录,制备cDNA。根据引物设计原则,通过Primer 5.0完成待测基因、管家基因(β-actin)的引物设计。采用QuantiFast SYBR Green PCR Kit试剂盒(德国Qiagen公司)于冰上配置荧光定量PCR反应体系。于ABI 7500 Real-time PCR仪(美国Life Technoligies公司)上检测ERK 1/2、c-Fos和c-Jun基因的mRNA相对表达量。用2-ΔΔCt表示每个样品mRNA的相对表达水平,值越大,表明其表达量越高。
(3)Western-blot法检测Src、ERK 1/2、c-Jun和c-Fos蛋白的表达:消化宫颈癌细胞(1×106/ml),提取蛋白,经BCA法蛋白定量。取50 μl蛋白样品行10%SDS-PAGE凝胶电泳,电转至NC膜,5%脱脂奶粉封闭非特异性抗原,分别加入鼠抗人ERK 1/2(1 : 2 000)、兔抗人Src、c-Jun和c-Fos(1 : 2 000)和兔抗人β-actin(1:1 000)单克隆抗体(英国Abcam公司),4 ℃过夜。洗膜,加辣根过氧化物酶标记的IgG二抗,37 ℃孵育1.5 h,ECL显色,化学发光显影、定影。利用Quantity One蛋白定量软件分析各条带灰度值,将目的条带与内参(β-actin)条带的比值作为该蛋白相对表达量。
4.统计学分析:采用SPSS 20.0软件进行资料的录入和分析。服从正态分布的资料采用(x±s)进行统计学描述,若方差齐采用ANOVA进行均数间的比较,两两比较采用LSD-t检验;不服从正态分布的资料采用(M±QR)进行描述,并进行Welch检验,两两比较采用Bonferroni法。检验水准为α=0.05。
结果1. Src对Hela和C33A细胞周期和凋亡的影响:Src抑制后,Hela和C33A细胞G0/G1期(Hela:t=-15.155,P<0.001,C33A:t=6.101,P=0.004)细胞比例升高,S期(Hela:t=13.384,P=0.001,C33A:t=-5.842,P=0.013)和G2/M期(Hela:t=6.013,P=0.001,C33A:t=-1.317,P=0.258)细胞比例降低,增殖指数(Hela:t=14.941,P<0.001,C33A:t=-6.101,P=0.004)降低,凋亡率(Hela:t=-11.498,P=0.007,C33A:t=-53.501,P<0.001)升高,除C33A细胞的G2/M期外,其余差异均有统计学意义(P<0.05);Hela细胞凋亡率的升高值低于C33A细胞,差异有统计学意义(t=25.834,P<0.001),而增殖指数的降低值在两种细胞间的差异无统计学意义(t=1.613,P=0.145),见表 1。
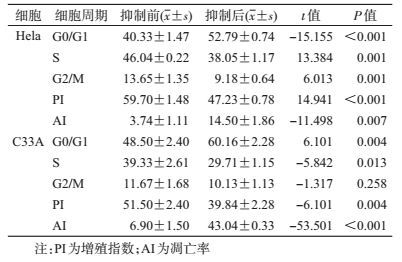
2. Src对宫颈癌细胞中ERK信号通路关键因子mRNA表达水平的影响:Src抑制后,Hela和C33A细胞的ERK 1(Hela:t=-14.773,P=0.005,C33A:t=-0.957,P=0.439)、ERK 2(Hela:t=-9.143,P=0.012,C33A:t=-3.202,P=0.085)、c-Fos(Hela:t=-7.935,P=0.016,C33A:t=-4.696,P=0.042)、c-Jun(Hela:t=-4.820,P=0.040,C33A:t=-9.060,P=0.012)的mRNA表达水平升高,除C33A细胞的ERK 1、ERK 2外,其余差异均有统计学意义(P<0.05);Hela细胞ERK 1(t=5.072,P=0.004)、ERK 2(t=2.308,P=0.057)、c-Fos(t=3.942,P=0.017)、c-Jun(t=3.579,P=0.007)的mRNA升高值高于C33A细胞,除ERK 2的mRNA升高值外,其余差异均有统计学意义,见图 1。
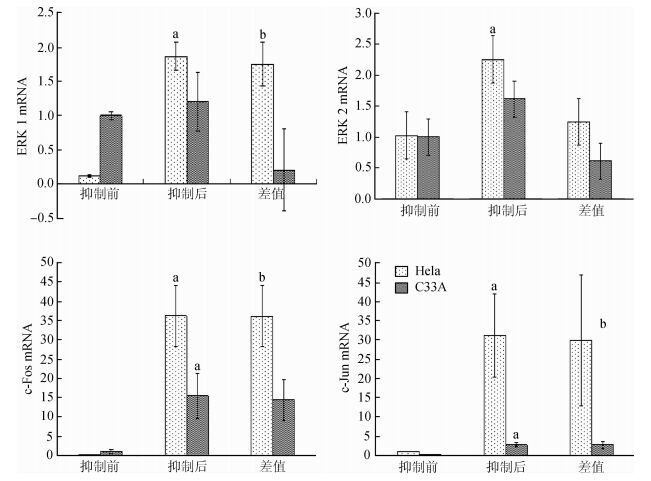
|
| 注:a表示与Src抑制前相比有统计学意义,b表示Src抑制前后两种细胞间的变化有统计学意义 图 1 Src对Hela和C33A细胞中ERK 1/2、c-Fos和c-Jun mRNA表达的影响 |
3. Src对宫颈癌细胞中ERK信号通路关键因子蛋白表达水平的影响:Src抑制后Hela和C33A细胞的ERK 1/2(Hela:t=-6.613,P=0.001,C33A:t=57.185,P<0.001)、p-ERK 1/2(Hela:t=-16.368,P<0.001,C33A:t=18.393,P=0.003)、p-c-Fos(Hela:t=10.825,P=0.008,C33A:t=18.187,P=0.003)蛋白表达水平降低,c-Jun(Hela:t=9.493,P=0.001,C33A:t=-4.715,P=0.042)、p-c-Jun(Hela:t=7.694,P<0.001,C33A:t=-7.967,P=0.015)蛋白表达水平升高,差异均有统计学意义(P<0.05),而c-Fos蛋白表达水平差异均无统计学意义(Hela:t=0.058,P=0.995,C33A:t=-1.441,P=0.223);Hela细胞ERK 1/2蛋白表达水平降低值高于C33A细胞(t=-35.001,P<0.001),Hela细胞p-ERK 1/2(t=3.466,P=0.008)、c-Fos(t=2.514,P=0.036)蛋白降低值低于C33A细胞,Hela细胞c-Jun(t=5.214,P=0.001)、p-c-Jun(t=6.060,P<0.001)蛋白升高值高于C33A细胞,差异均有统计学意义(P<0.05),见图 2。
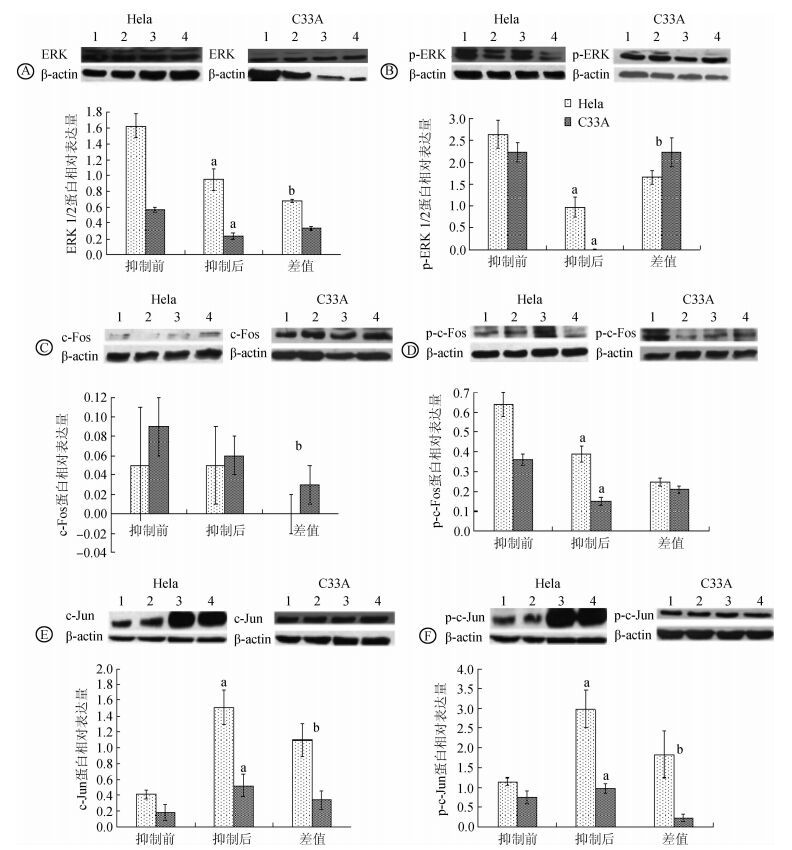
|
| 注:1、2泳道为Src抑制前,3、4泳道为Src抑制后;a表示与Src抑制前相比有统计学意义;b表示Src抑制前后两种细胞间的变化有统计学意义 图 2 Src对Hela和C33A细胞ERK 1/2(Ⓐ,Ⓑ)、c-Fos(Ⓒ,Ⓓ)和c-Jun(Ⓔ,Ⓕ)蛋白表达的影响 |
Src家族(Src-family kinases,SFK)是一类非受体蛋白酪氨酸激酶,包括Blk、Fgr、Frk、Fyn、Hck、Lck、Lyn、c-Src、c-Yes 9个成员,它们在细胞表面蛋白、跨膜蛋白和转录因子的信号传递上发挥着重要作用。其中,原癌基因c-Src可诱导细胞发生恶性转化,它可以被细胞膜表面的生长因子受体(EGF-R)、G蛋白偶联受体(GPCRs)、整合蛋白受体等激活,进而激活多条信号通路,使细胞产生多种生理效应,在肿瘤研究中备受关注。有研究表明,Src在宫颈癌、皮肤癌、前列腺癌等多种肿瘤的组织及细胞系中过度表达和/或活性增强[7-9],与肿瘤的形成密切相关。Kong等[10]发现下调Src激酶的活性,可以有效地抑制宫颈癌细胞的增殖和裸鼠皮下肿瘤的生长。本研究采用PP2抑制Src激酶的活性,对宫颈癌细胞Hela和C33A抑制前后的细胞生物功能变化进行了分析,结果显示,Src抑制后,Hela和C33A细胞G0/G1期细胞比例增高,S期、G2/M期细胞比例降低,细胞增殖减慢,凋亡加快,提示Src具有促进宫颈癌细胞周期向G2/M期转变,促进细胞增殖,抑制凋亡的作用,可作为宫颈癌临床治疗的一个潜在靶点。
肿瘤的发生与细胞信号转导关系密切,细胞接受胞外刺激信号后,由胞内一系列信号通路接替、放大并整合,最终导致基因和功能的变化。丝裂原活化蛋白激酶(MAPK)信号转导途径是许多信号转导途径的汇聚点和共同通道[11],ERK信号转导通路是其中最为重要的一条,广泛参与细胞的生长、发育、分化、凋亡等多种生理过程的调节和细胞的恶性转化。ERK作为Ras-Raf-MEK-ERK信号通路的重要成分,可以将细胞表面各种刺激信号转导入细胞内并引发一系列生物学变化。当ERK被激活后,表现为磷酸化的活性形式(p-ERK)。p-ERK由细胞质进入到细胞核,影响核转录因子c-Fos、c-Jun、c-myc、cyclin-D1、Bcl-2等的表达。c-Fos和c-Jun作为编码核蛋白的癌基因,在多数正常组织和细胞中低表达,而在宫颈癌在内的多种肿瘤组织中呈现高表达[12]。由c-Fos和c-Jun蛋白组成的异源二聚体转录激活蛋白-1(AP-1)通过亮氨酸拉链结构与多种肿瘤相关的基因启动子和增强子相结合[13],调控这些基因的表达,参与细胞的转化、增殖、分化、凋亡等多种生物学过程,促进肿瘤的发生与演进。本课题组前期研究发现,ERK 1/2可能通过调节c-Fos和c-Jun蛋白的表达影响Hela和C33A细胞的增殖[14]。
本研究检测了Src抑制前后Hela和C33A细胞ERK 1/2、c-Fos、c-Jun的蛋白表达水平变化,结果显示,在Hela和C33A细胞中,Src抑制后ERK 1/2、p-ERK 1/2和p-c-Fos蛋白表达水平均降低,提示Src可能通过激活ERK信号通路关键因子,对宫颈癌细胞发挥生物学作用。Src蛋白可以直接调控Ras-Raf-MEK-ERK信号通路上游激活蛋白Ras的活性,对ERK信号通路发挥作用。Li等[15]发现在乳腺癌细胞中抑制Src后,p-ERK 1/2蛋白的表达明显降低。本研究中c-Jun和p-c-Jun蛋白表达水平升高,可能与c-Fos蛋白表达降低引发的负反馈调节有关,有研究显示,c-Fos蛋白表达的降低可引起AP-1的降低[16]。此外,本研究中Src抑制后各关键因子mRNA表达水平均升高,提示Src对ERK信号通路的调节作用主要发生在翻译水平上,表现为ERK信号通路中各关键因子效应蛋白的高表达。当施加PP2使Src活性降低时,相应关键因子的翻译过程被抑制,蛋白表达减少,随之诱发了多个环节的负反馈调节,促进了相应信号因子及上游信号因子的转录,导致ERK信号通路上各关键因子转录形成的mRNA增多。当然,其详细机制尚待深入探讨。
特别应予注意的是,本研究结果还显示,Src抑制前后,细胞凋亡率、p-ERK 1/2和c-Fos蛋白的表达变化在HPV阳性的Hela细胞均低于HPV阴性的C33A细胞,提示HPV感染可能对Src介导的ERK信号通路调节发挥调节作用。众所周知,Src可以被细胞膜表面的表皮生长因子受体激活,而表皮生长因子受体的表达又受到HPV E6/E7蛋白的调节[17],提示,HPV E6/E7蛋白可能通过调节表皮生长因子受体调控Src的表达,继而对ERK信号通路发挥调节作用。本次研究基于体外细胞实验提出Src可能通过调控ERK信号通路对宫颈癌细胞的生长和增殖发挥作用,考虑到生物信号通路的复杂性,Src对ERK信号通路的调节作用及其机制的研究尚需深入。
利益冲突: 无
| [1] | World Health Organization. Human papillomavirus (HPV) and cervical cancer, 2016[EB/OL].[2016-06-20]. http://www.who.int/mediacentre/factsheets/fs380/en/. |
| [2] | Chen WQ, Zheng RS, Baade PD, et al. Cancer statistics in China, 2015[J]. CA A Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [3] | Mejía L, Mu?oz D, Trueba G, et al. Prevalence of human papillomavirus types in cervical cancerous and precancerous lesions of Ecuadorian women[J]. J Med Virol, 2016, 88(1): 144–152. DOI:10.1002/jmv.24310 |
| [4] | Al Moustafa AE, Yasmeen A, Achkhar A. Src inhibitors are promising therapy molecules for human cervical carcinomas[J]. Med Hypotheses, 2011, 77(5): 812–814. DOI:10.1016/j.mehy.2011.07.043 |
| [5] | Parsons SJ, Parsons JT. Src family kinases, key regulators of signal transduction[J]. Oncogene, 2004, 23(48): 7906–7909. DOI:10.1038/sj.onc.1208160 |
| [6] | McCubrey JA, Steelman LS, Chappell WH, et al. Roles of the Raf/MEK/ERK pathway in cell growth, malignant transformation and drug resistance[J]. Biochim Biophys Acta, 2007, 1773(8): 1263–1284. DOI:10.1016/j.bbamcr.2006.10.001 |
| [7] | Hou T, Xiao J, Zhang HT, et al. Phosphorylated c-Src is a novel predictor for recurrence in cervical squamous cell cancer patients[J]. Int J Clin Exp Pathol, 2013, 6(6): 1121–1127. |
| [8] | Lee JH, Pyon JK, Kim DW, et al. Elevated c-Src and c-Yes expression in malignant skin cancers[J]. J Exp Clin Cancer Res, 2010, 29(1): 116. DOI:10.1186/1756-9966-29-116 |
| [9] | Vlaeminck-Guillem V, Gillet G, Rimokh R. Src:marker or actor in prostate cancer aggressiveness[J]. Front Oncol, 2014, 4: 222. DOI:10.3389/fonc.2014.00222 |
| [10] | Kong L, Deng ZH, Zhao YZ, et al. Down-regulation of phospho-non-receptor Src tyrosine kinases contributes to growth inhibition of cervical cancer cells[J]. Med Oncol, 2011, 28(4): 1495–1506. DOI:10.1007/s12032-010-9583-3 |
| [11] | Seger R, Krebs EG. The MAPK signaling cascade[J]. FASEB J, 1995, 9(9): 726–735. |
| [12] | Mishra A, Bharti AC, Saluja D, et al. Transactivation and expression patterns of Jun and Fos/AP-1 super-family proteins in human oral cancer[J]. Int J Cancer, 2010, 126(4): 819–829. DOI:10.1002/ijc.24807 |
| [13] | Glauser DA, Schlegel W. Sequential actions of ERK1/2 on the AP-1 transcription factor allow temporal integration of metabolic signals in pancreatic β cells[J]. FASEB J, 2007, 21(12): 3240–3249. DOI:10.1096/fj.06-7798com |
| [14] | Bai LX, Mao R, Wang JT, et al. ERK1/2 promoted proliferation and inhibited apoptosis of human cervical cancer cells and regulated the expression of c-Fos and c-Jun proteins[J]. Med Oncol, 2015, 32(3): 57. DOI:10.1007/s12032-015-0490-5 |
| [15] | Li ZP, Hosoi Y, Cai KS, et al. Src tyrosine kinase inhibitor PP2 suppresses ERK1/2 activation and epidermal growth factor receptor transactivation by X-irradiation[J]. Biochem Biophys Res Commun, 2006, 341(2): 363–368. DOI:10.1016/j.bbrc.2005.12.193 |
| [16] | McBride K, Nemer M. The C-terminal domain of c-fos is required for activation of an AP-1 site specific for jun-fos heterodimers[J]. Mol Cell Biol, 1998, 18(9): 5073–5081. DOI:10.1128/MCB.18.9.5073 |
| [17] | Manavi M, Hudelist G, Fink-Retter A, et al. Gene profiling in Pap-cell smears of high-risk human papillomavirus-positive squamous cervical carcinoma[J]. Gynecol Oncol, 2007, 105(2): 418–426. DOI:10.1016/j.ygyno.2006.12.032 |
 2017, Vol. 38
2017, Vol. 38