文章信息
- 张治国, 吴进凤, 王莉, 王路钦, 韩露, 马树波, 高铁杰.
- Zhang Zhiguo, Wu Jinfeng, Wang Li, Wang Luqin, Han Lu, Ma Shubo, Gao Tiejie.
- 北京市昌平地区2011-2015年结核分枝杆菌的流行特征
- Genotyping and drug susceptibility of Mycobacterium tuberculosis isolated in Changping district in Beijing, 2011-2015
- 中华流行病学杂志, 2017, 38(9): 1236-1240
- Chinese journal of Epidemiology, 2017, 38(9): 1236-1240
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2017.09.019
-
文章历史
收稿日期: 2017-04-01
2. 102200 北京市昌平区妇幼保健院
2. Changping District Center for Maternal and Child Health Care, Beijing 102200, China
结核病是全球公共卫生领域面临的重大挑战。据WHO估算,2015年全球新发结核病患者1 040万,且有140万患者死于结核病[1]。我国是结核病高负担国家之一,虽然近年来结核病发病率呈逐年下降趋势,涂阳肺结核发病率从1990年的170/10万降至2010年的59/10万,但是每年仍有新发结核病患者92万,位居世界第三位[1-2]。如何有效控制结核病是我国面临的一项重大公共卫生及社会问题[3]。
结核分枝杆菌基因分型是了解结核病的流行规律的重要工具[4]。其中间隔区寡聚核苷酸分型技术(Spoligotyping)是用于鉴定结核分枝杆菌家族遗传机构的重要技术,特别是在区分北京基因型和非北京基因型方面,但是该技术操作过程繁琐,结果判读较复杂,因此近些年来逐渐被SNP法取代[5]。北京基因型菌株是目前全球主要流行的基因型之一,特别是在东亚及北美地区均为当地的优势菌群[3]。我国分离的结核分枝杆菌也以北京基因型为主,但是北京基因型在不同地区的分布呈现出明显的地域特征,其中北方地区的北京基因型的比例显著高于南方地区[3]。可变数目串联重复序列分析(variable number tandem repeat,VNTR)是以PCR技术为基础的基因分型方法,该技术的分辨率更高,结果更易分析,且具有很高的重复性,特别是其数字化的结果展现形式使得不同实验室之间的结果相互比较[6]。本研究选取北京市昌平区2011-2015年所有培养阳性结核分枝杆菌1 099株,采用SNP和高谦课题组等推荐的12位点VNTR进行基因分型,同时检测菌株对6种抗结核药物的耐药性,以初步了解该地区结核分枝杆菌不同基因型的流行特征,以及基因型和耐药性的关系,探讨基因分型用于评价本地区结核病控制中的应用价值。
材料与方法1.菌株来源:本研究纳入2011-2015年昌平地区所有肺结核疑似患者痰标本,对其进行传统固体培养和鉴定,共获得1 099株结核分枝杆菌阳性菌株。所有菌株的获得均得到患者知情同意。对照标准菌株H37Rv(ATCC27294)由国家结核病参比实验室提供。
2.主要试剂:2×Taq Master Mix、100 bp DNA Ladder和琼脂糖均购自北京康为世纪生物科技有限公司。异烟肼、利福平、链霉素、乙胺丁醇、阿米卡星和氧氟沙星均购自美国SIGMA公司。
3. DNA提取:将结核分枝杆菌临床分离株接种于L-J培养基,37 ℃培养4~8周,至有菌落生长后,取一接种环菌于400 μl TE缓冲液(pH 8.3)中悬菌,100 ℃煮沸15 min,12 000 r/min离心10 min,取上清用做基因分型模板,-20 ℃保存备用[3]。
4. VNTR基因分型:反应体系和条件:采用25 μl PCR反应体系:2×Taq Master Mix 12.5 μl、DNA模板2 μl、上下游引物各0.5 μl(10 μmol/L)、双蒸水9.5 μl补充至反应体积。PCR反应条件:预变性94 ℃ 10 min;变性94 ℃ 30 s,退火58 ℃ 30 s,延伸72 ℃ 45 s,共35个循环,最终延伸72 ℃ 10 min。引物及序列参照文献,引物由北京擎科生物有限公司合成,见表 1。结果检测:用1%琼脂糖凝胶电泳PCR产物,Gelred核酸染料染色,用100 bp DNA Ladder来确定相对分子质量的大小,以标准株H37Rv作为对照,计算出不同结核分枝杆菌各个位点的重复拷贝数,再用BioNumerics(Version 5.0)软件进行聚类分析。应用Hunter-Gaston分辨率指数(Hunter-Gaston index,HGI)分析各位点的多态性,公式:

5. Taqman探针基因分型:采用10 μl反应体系:10×反应缓冲液1 μl、dNTP 0.4 μl、上游引物0.05 μl(0.02 μmol/L)、下游引物1 μl(0.4 μmol/L)、探针0.2 μl(0.2 μmol/L)、酶0.2 μl、DNA 0.5 μl、双蒸水6.65 μl。反应条件:预变性95 ℃ 2 min;变性95 ℃ 10 s,退火58 ℃ 10 s,延伸72 ℃ 10 s,共40个循环,最终延伸72 ℃ 5 min。溶解曲线分析条件为:95 ℃变性5 min,40~80 ℃溶解曲线分析,每升高1°采集一次荧光,检测FAM和ROX 2个通道。引物、探针及序列参照文献[7],由北京擎科生物有限公司合成,见表 2。
6.药物敏感试验:对异烟肼、利福平、乙胺丁醇、链霉素、阿米卡星和氧氟沙星的药物敏感性试验采用WHO推荐的比例法,对任意一种药物耐药称为耐药菌株,至少对异烟肼和利福平同时耐药称为耐多药菌株(MDR),对异烟肼和利福平耐药,并同时对任何氟喹诺酮类药物以及3种二线注射药物(卷曲霉素、卡那霉素和阿米卡星)中至少一种具耐药称为广泛耐多药菌株(XDR)[8]。
7.统计学分析:使用SPSS 17.5软件,采用χ2检验对不同基因型菌株的药敏结果进行比较分析,P<0.05为差异有统计学意义。
结果1.耐药率动态变化:本研究纳入2011-2015年期间昌平区结防所连续收集的所有培养阳性的结核分枝杆菌菌株,其中各年份收集的菌株分别为175株(15.9%)、194株(17.7%),198株(18.0%)、261株(23.7%)和271株(24.7%)。对菌株采用传统比例法药敏试验检测其对4种一线抗结核药物链霉素、异烟肼、利福平、乙胺丁醇以及2种二线抗结核药物氧氟沙星和阿米卡星的耐药情况,结果表明,2011-2015年各种抗结核药物的耐药率都有不同程度提高:链霉素(18.3% vs. 24.7%,P=0.07)、异烟肼(11.4% vs. 15.9%,P=0.19)、利福平(9.1% vs. 14.8%,P=0.14)、乙胺丁醇(4.0% vs. 10.3%,P=0.13)、阿米卡星(1.1% vs. 2.6%,P=0.32)、氧氟沙星(2.9% vs. 8.9%,P=0.01)。此外,结核分枝杆菌MDR从2011年的6.3%提高到2015年8.9%,而XDR从2011年1.1%提高到2015年的1.8%,但差异无统计学意义(MDR:P=0.37;XDR:P=0.53)。见图 1。

|
| 图 1 2011-2015年菌株对不同药物的耐药率动态变化 |
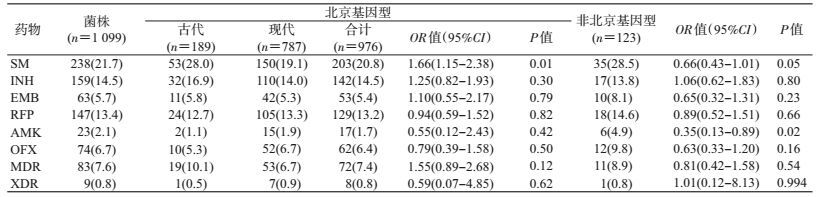
2.北京基因型的动态变化:在所有菌株中,北京基因型菌株976株,占88.8%,非北京基因型菌株123株,占11.2%,其中北京基因型菌株中还包括189株(17.2%)古代北京基因型和787株(71.6%)现代北京基因型。2011年,90.9%的结核分枝杆菌属于北京基因型,到2015年,该比例为88.2%,两者差异无统计学意义。此外,进一步分析表明,现代北京基因型所占比例在5年期间无显著性变化,从2011年的81.1%到2015年的82.0%。见表 3。
3.不同基因型菌株与耐药性的关系:不同基因型结核分枝杆菌耐药率呈现出不同的特征,北京基因型对阿米卡星的耐药率(1.7%)低于非北京基因型(4.9%,P=0.02)。在古代北京基因型和现代北京基因型方面,两种基因型的菌株仅在链霉素耐药率方面存在统计学差异,其中古代北京基因型对链霉素耐药率(28.0%)高于现代北京基因型(15.7%,P=0.01)。见表 4。
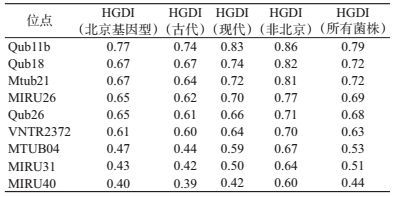
4. VNTR位点多态性分析:本次首先选取了9个VNTR位点进行检测分析,为了比较不同位点的多态性,应用HGI对各个位点的分辨力进行分析。9个位点HGDI差异较大,HGI为0.441~0.792,其中高分辨率(HGDI≥0.6)的VNTR位点6个(Qub11b、Qub18、Mtub21、MIRU26、Qub26和VNTR2372),其余3个位点属于中分辨率位点(0.6>HGDI>0.3)。进一步分析VNTR位点在不同基因型结核分枝杆菌的分辨率,结果表明同一VNTR位点对于非北京基因型菌株的分辨率明显高于北京基因型;而对北京基因型菌株,现代北京基因型菌株的分辨率高于古代基因型菌株。见表 5。
5.结核分枝杆菌VNTR基因分型:1 099株结核分枝杆菌经聚类分析后,共分为934个基因型(H37Rv为参照株),其中929株为单一基因型,170株可归为67个基因簇之一,成簇率为15.5%(170/1 099),每簇包括2~6株临床分离株,最大一簇含6株分离株。进一步对成簇菌株采用超高分辨率位点VNTR3232,VNTR3820以及VNTR4120进行基因分型,结果表明仅有2株菌株成簇。
讨论耐药结核的传播是我国结核病防控体系面临的最大难题。2016年WHO年报表明我国耐多药结核病仅有20%被诊断并治疗,尚有超过80%的耐多药结核未能被及时发现,而这些患者成为潜在的传染源导致耐药结核的进一步播散[1, 9]。本研究系统分析了2011-2015年耐药结核的变化趋势,结果表明,昌平地区结核分枝杆菌链霉素、异烟肼、利福平等多种药物耐药性并无显著性增长,而氧氟沙星耐药率显著提高。由于抗菌谱广、副作用低,喹诺酮药物被广泛用于治疗不同病原微生物感染,在呼吸道感染中使用频率较高[10];喹诺酮的不规则使用可能造成误诊为其他感染的肺结核患者体内的结核分枝杆菌对其耐药性提高,因此,研究结果提示应进一步规范喹诺酮在治疗其他感染领域的应用。此外,喹诺酮药物同时被广泛用于畜牧业治疗或预防牲畜的治疗中,有研究表明我国河流、土地等环境中抗生素残留明显[11],因此这也可能是造成结核分枝杆菌喹诺酮耐药率上升的重要原因。近期的一项基于全国流行病学调查分离的菌株进行的药敏试验表明,结核分枝杆菌对莫西沙星的耐药率显著提高[12],作为治疗耐多药结核最核心的药物之一,喹诺酮耐药率直接决定耐药患者的治疗结局,因此,结核分枝杆菌日益增长的对喹诺酮的耐药性是我们未来需要面对的结核分枝杆菌防控的新问题。
北京基因型菌株是我国目前最主要的结核分枝杆菌家族,其分布呈现出明显的地域特征,北方地区显著高于南方地区,本研究结果表明昌平地区北京基因型结核分枝杆菌菌株所占比例为88.8%,与河南(89.8%)和黑龙江(89.5%)的报道类似,低于之前甘肃(91.9%)、河北(91.0%)的报道,高于内蒙古(79.0%)和山东(77.7%)[13]。但是北京基因型在2011-2015年期间的比例未发生显著性提高,与近年来基于全国流调的菌株数据结果不同,提示北京基因型未发生进一步人群中传播。与北京基因型结果类似,VNTR分型研究结果表明上述菌株成簇率低于1%,提示结核分枝杆菌在本地区近期传播比例较低。结核病分子流行病学研究结果表明昌平地区近年来结核分枝杆菌未发生明显的人际传播,与上述结果相一致,马树波等[14]的研究结果表明2006-2015年昌平地区肺结核发病率呈下降趋势,但是在某些特殊人群中发病率较高,包括该地区的流动人口以及老年人群,提示该地区疫情与外地输入性病例以及内源性复发相关,结果表明昌平地区结核病防治工作措施有效,但需要重点针对流动人口、老年人群等结核高发人群采用一些创新性的措施,如主动筛查、加强宣教,有助于减少结核病在该人群中的传播。同时本研究提示9+3位点对本地区结核分枝杆菌提供了良好的分辨率,是一种具有良好推广意义的VNTR分型位点组合[7]。
北京基因型与耐药结核分枝杆菌耐药性密切相关。基于全国耐药基线调查的数据表明北京基因型菌株与利福平、氟喹诺酮等多种药物耐药性密切相关[3];但是来自上海地区的研究结果与之不同,北京基因型菌株与耐药性无关[15]。本研究结果与后者类似,仅有阿米卡星耐药性与非北京基因型相关,推测与阿米卡星耐药菌株数目较少有关。此外,近期来自Pang等[16]的研究结果表明,与现代北京基因型相比,古代北京基因型与耐药更相关,本研究结果支持上述发现,古代北京基因型对链霉素耐药率显著高于现代北京基因型。现代北京基因型出现时间较晚,特别是近几十年才在全世界大规模播散,其接受链霉素选择的时间较短,因此耐药率比暴露时间更长的古代北京基因型更低。
利益冲突: 无
| [1] | World Health Organization. Global tuberculosis report 2016[R]. Geneva:WHO, 2016. |
| [2] | Wang LX, Zhang H, Ruan YZ, et al. Tuberculosis prevalence in China, 1990-2010; a longitudinal analysis of national survey data[J]. Lancet, 2014, 383(9934): 2057–2064. DOI:10.1016/S0140-6736(13)62639-2 |
| [3] | Pang Y, Zhou Y, Zhao B, et al. Spoligotyping and drug resistance analysis of Mycobacterium tuberculosis strains from national survey in China[J]. PLoS One, 2012, 7(3): e32976. DOI:10.1371/journal.pone.0032976 |
| [4] |
田丽丽, 丁北川, 祝秉东, 等.
结核分枝杆菌基因分型方法及其应用[J]. 中国防痨杂志, 2015(8): 885–891.
Tian LL, Ding BC, Zhu BD, et al. The application of genotyping method of Mycobacterium tuberculosis[J]. Chin J Antitubere, 2015(8): 885–891. DOI:10.3969/j.issn.1000-6621.2015.08.018 |
| [5] | Coll F, McNerney R, Guerra-Assun??o JA, et al. A robust SNP barcode for typing Mycobacterium tuberculosis complex strains[J]. Nat Commun, 2014, 5: 4812. DOI:10.1038/ncomms5812 |
| [6] |
罗涛, 杨崇广, 逄宇, 等.
建立适合我国结核分枝杆菌特征的可变串联重复序列(VNTR)分型方法[J]. 中华结核和呼吸杂志, 2014, 37(5): 322.
Luo T, Yang CG, Pang Y, et al. Development of a hierarchical variable-number tandem repeat typing scheme for Mycobacterium tuberculosis in China[J]. Chin J Tubere Respir Dis, 2014, 37(5): 322. DOI:10.3760/cma.j.issn.1001-0939.2014.05.002 |
| [7] | Luo T, Yang CG, Pang Y, et al. Development of a hierarchical variable-number tandem repeat typing scheme for Mycobacterium tuberculosis in China[J]. PLoS One, 2014, 9(2): e89726. DOI:10.1371/journal.pone.0089726 |
| [8] | Zhao YL, Xu SF, Wang LX, et al. National survey of drug-resistant tuberculosis in China[J]. N Engl J Med, 2012, 366(23): 2161–2170. DOI:10.1056/NEJMoa1108789 |
| [9] |
高谦, 梅建.
传播才是造成我国结核病高耐药率的主要原因[J]. 中国防痨杂志, 2015, 37(11): 1091–1096.
Gao Q, Mei J. Transmission is the main cause of high rate of drug-resistant tuberculosis in China[J]. Chin J Antitubere, 2015, 37(11): 1091–1096. DOI:10.3969/j.issn.1000-6621.2015.11.002 |
| [10] | Zhang ZJ, Lu J, Wang YF, et al. Prevalence and molecular characterization of fluoroquinolone-resistant Mycobacterium tuberculosis isolates in China[J]. Antimicrob Agents Chemother, 2014, 58(1): 364–369. DOI:10.1128/AAC.01228-13 |
| [11] | Zhang QQ, Ying GG, Pan CG, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China:source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environ Sci Technol, 2015, 49(11): 6772–6782. DOI:10.1021/acs.est.5b00729 |
| [12] | Pang Y, Zhang ZJ, Wang YF, et al. Genotyping and prevalence of pyrazinamide-and moxifloxacin-resistant tuberculosis in China, 2000 to 2010:findings from the national survey data[J]. Antimicrob Agents Chemother, 2017, 61(2): e02170–16. DOI:10.1128/AAC.02170-16 |
| [13] | Liu ZW, Pang Y, Chen SH, et al. A First insight into the genetic diversity and drug susceptibility pattern of Mycobacterium tuberculosis complex in Zhejiang, China[J]. BioMed Res Int, 2016, 2016: 8937539. DOI:10.1155/2016/8937539 |
| [14] |
马树波, 王娜, 杨震, 等.
2006-2015年北京市昌平区肺结核报告发病情况分析[J]. 实用预防医学, 2016, 23(10): 1176–1181.
Ma SB, Wang N, Yang Z, et al. Reported incidence of tuberculosis cases in Changping district, Beijing, 2006-2015[J]. Pract Prev Med, 2016, 23(10): 1176–1181. DOI:10.3969/j.issn.1006-3110.2016.10.008 |
| [15] | Yang CG, Luo T, Sun GM, et al. Mycobacterium tuberculosis Beijing strains favor transmission but not drug resistance in China[J]. Clin Infect Dis, 2012, 55(9): 1179–1187. DOI:10.1093/cid/cis670 |
| [16] | Zhang ZJ, Lu J, Liu M, et al. Genotyping and molecular characteristics of multidrug-resistant Mycobacterium tuberculosis isolates from China[J]. J Infect, 2015, 70(4): 335–345. DOI:10.1016/j.jinf.2014.11.008 |
 2017, Vol. 38
2017, Vol. 38