文章信息
- 林玫, 崔哲哲, 林定文, 梁大斌, 黄敏莹, 苏华斌, 唐咸艳.
- Lin Mei, Cui Zhezhe, Lin Dingwen, Liang Dabin, Huang Minying, Su Huabin, Tang Xianyan.
- 广西壮族自治区2010-2015年传染性肺结核时空特征分析
- Visual-spatial and temporal characteristics related to infectious Tuberculosis epidemics in Guangxi Zhuang Autonomous Region, 2012-2015
- 中华流行病学杂志, 2017, 38(9): 1206-1211
- Chinese journal of Epidemiology, 2017, 38(9): 1206-1211
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2017.09.013
-
文章历史
收稿日期: 2016-12-14
2. 90112 宋卡, 泰国宋卡王子大学医学院流行病学系;
3. 530021 南宁, 广西医科大学公共卫生学院流行病与生物统计系
2. Epidemiology Unit, Faculty of Medicine, Prince of Songkhla University, Songkhla 90112, Thailand;
3. Department of Epidemiology and Biostatistics, School of Health Public, Guangxi Medical University, Nanning 530021, China
结核病是由结核分枝杆菌传播引起的慢性传染病。结核病的流行已成为全球发展中国家面临的公共卫生问题。排菌的肺结核患者(传染性肺结核患者)在传播链中起到了至关重要的作用。2016年全球结核病报告指出,虽然估计发病率在缓慢下降,但中国仍然是仅次于印度和印度尼西亚的结核病高负担国家之一[1]。根据历年全国传染病报告系统统计,广西壮族自治区(广西)结核病报告发病率一直处于第3或第4高发省份,其传播流行的特征和趋势依然未明确。时空间流行病学分析可有效掌握疾病聚集的范围和趋势[2-3],对卫生决策起到关键作用。某些地区研究表明,结核病的传播具有多样性、复杂性和时空异质性[4-5]。目前尚无针对广西结核病相关研究和文献报道。本研究运用时间序列模型、空间自相关统计量和时空扫描统计量,对2010-2015年广西传染性肺结核患者时空特征分析,为结核病防治提供科学依据。
资料与方法1.研究设计:基于现住址定位的广西全人群回顾性调查。拟用2010-2015年的分析结果阐述广西传染性肺结核病例在该时期的时空分布情况。同时,通过时间序列模型对2016年传染性肺结核的报告发病趋势进行预测。
2.数据收集和整理:从我国传染病报告系统收集2010-2015年所有确诊的传染性肺结核病例,共76 151例。根据患者的现住址地区编码进行归类和统计,最小空间统计单元为县(区),即统计各县(区)的登记报告数。将每个单元的病例按照月和年再次归类,形成2010-2015年广西传染性肺结核数据库。从“Google Earth”地图获取每个县(区)的经度和纬度,根据其地区编码建立坐标数据库。从“Global administrative area database”获取中国地图,从中剪取并生成广西shp文件。将病例数据与地图文件根据地区编码进行关联,生成分析数据库。
3.统计学分析:
(1) 基本情况描述:对总体及各年度报告的传染病肺结核患者进行描述性分析,并进行趋势χ2检验,了解2010-2015年广西传染性肺结核报告数的总体变化趋势。
(2) 时间序列分析:将数据库数据进行长期趋势分析。运用SPSS 19.0软件时间序列预测模块中的“专家建模器”功能,基于最小二乘法自动筛选优化模型,并与ARIMA法手动修改参数(p\d\q和P\D\Q)进行比较,调整R2最大,均方根误差(RMES)、正态化BIC、平均绝对误差百分比(MAPE)和平均绝对误差(MAE)最小的模型为最优模型,基于模型解释其不同时期的登记报告规律,并对2016年的登记数进行预测和预警(95%CI上限为预警值)。
(3) 空间自相关分析:采用统计学家Patrick Alfred Pierce Moran创建的“Moran’s I”统计理论[6]进行空间自相关分析。该分析分为全局和局部自相关分析。全局自相关分析通过方差归一化,使研究区域内总体相关系数Moran’s I取值在-1~1之间。Moran’s I>0表示存在空间正相关性,指数值越大,空间相关性越显著,也就是随着相邻的单元在空间上越聚集,相关性越明显;Moran’s I<0表示存在空间负相关性,指数值越小,空间差异显著,也就是相邻的单元在空间上越离散,反而相关性变得显著了;当Moran’s I=0,空间呈随机性,相邻研究单位之间没有相关性[7]。本研究将用总体指数和象限图进行结果描述。象限图将各相邻坐标点之间的相关系数用高-高聚集(high-high,HH)、低-低聚集(low-low,LL)、高-低聚集(high-low,HL)和低-高聚集(low-high,LH)在四个象限呈现。全局统计量公式:

式中,W为空间权重系数,当两个相邻地区(i和j)传染性肺结核均为高发(聚集),W值为1;若均为低发,W值为-1。n为总研究单元数。若差异有统计学意义,W值则为0。S0为总体权重系数。
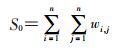
局部自相关是针对每个研究单元的自相关分析。其在全局分析的基础上,对局部地区的相邻关系计算统计量,并根据不同的显著性在LISA聚集地图中呈现结果。一般认为具有“HH”关系的区域是“热点”地区(高发聚集区),而具有“LL”关系的区域是“冷点”地区(低发聚集区)。本研究用GeoDa 1.8.12空间分析软件进行空间自相关分析。Anslin’s局部公式:
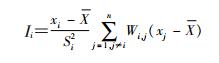
式中,W为两个相邻地区(i和j)传染性肺结核报告发病率的空间权重系数;i地权重系数Si2公式:
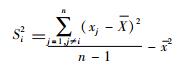
全局和局部自相关分析均用“经验Bayes”调整,以解决比率方差不稳定的问题。
(4) 时空扫描统计量:① 时空扫描统计量计算:自相关分析对于尺度的选择容易受到研究者的主观影响,且不能分析时间维度的聚集情况,本研究引入库尔多夫研发的时空扫描统计量[8],将空间和时间维度的病例登记聚集趋势进行整合分析。运用SaTScan 7.0.2软件,设置圆柱形扫描窗口对病例的聚集性进行侦测。该圆柱扫描窗的横截面为空间区域,高度为时间段。窗口在研究区域和时间段内以不同的半径和高度随机移动,同时与窗口外的登记率进行比较。具有最大释然比(差异的统计学意义最大)扫描区域认为是一级聚集地区和时间段;其他统计学差异(P<0.05) 的区域认为是次级聚集区;无差异的相邻区域不同登记率认为是机遇造成的结果。② 输出时空数据的可视化:SaTScan软件结果输出主要以文本格式为主,还需要借助Google Earth等软件读取相应的输出文件(KML),并在地图上实现空间聚集数据的可视化。Google Earth虽然可以读取和显示时空扫描统计量输出文件,但不能实现时间维度的可视化。因此本研究应用R语言v 3.3.1软件,创建含有时空聚集窗口的三维可视化地图。其步骤包括:① 程序包的安装和运行;② 广西地图文件(shp文件)和时空扫描结果数据(csv文件)的读取;③ 时空三维聚集性圆柱体可视化程序的编辑;④ 三维聚集地图的构建和输出(圆柱体的底面为聚集地区扫描窗口,高为聚集时间段)。
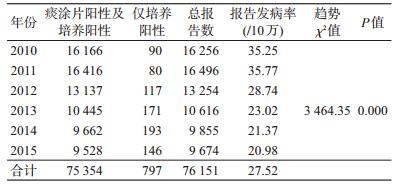
结果1.基本情况:2010-2015年广西共报告传染性肺结核患者76 151例(痰涂片阳性、痰涂片及培养均阳性75 354例,仅培养阳性797例)。传染性肺结核年均报告发病率27.52/10万(20.98/10万~35.77/10万)。趋势χ2检验,传染性肺结核年报告发病率有下降趋势(趋势χ2=3 464.53,P=0.000),见表 1。
2.时间序列分析:经过“专家建模器”筛选Winters相乘模型,其平稳R2=0.640,RMSE= 87.730,正态化BIC=9.127,MAPE=7.046,MAE=68.544。根据ARIMA模型残差自相关函数(ACF)图和偏自相关函数(PACF)图的特征筛选模型参数(0,1,1)(1,0,0),其平稳R2=0.439,RMES=125.465,正态化BIC=9.784,MAPE=8.953,MAE=92.600,并不优于Winters模型(平稳R2较Winters模型小,RMES、正态化BIC、MAPE和MAE较Winters模型大)。因此较好的模型依然是Winters乘法模型。该拟合曲线既体现了广西传染性肺结核报告数平稳的春夏季高发季节趋势,也提示了其逐年缓慢下降的趋势。通过模型预测,2016年可能报告传染性肺结核7 764(4 971~10 557) 例,3月将出现报告峰值,之后缓慢下降,其95% CI可作为下年度系统监测的实时预警指标值。见图 1。
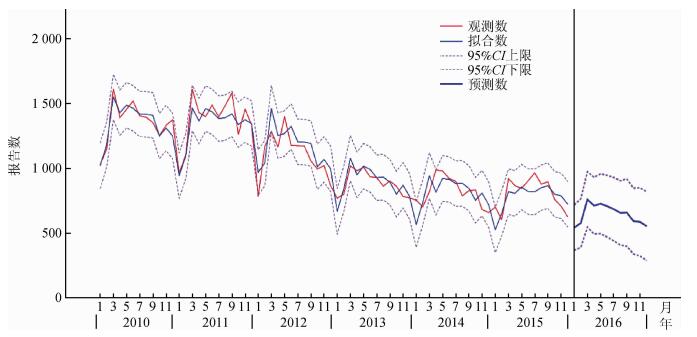
|
| 图 1 2010-2015年基于Winters相乘模型的广西传染性肺结核报告数预测曲线 |
3.空间自相关分析:经过全局Moran’s I统计量计算,所有年度的统计量均大于0(0.257~0.390),2011年的全局统计量达到峰值,见表 2。说明每年均有报告病例的空间聚集,但2014、2015年相关性相对较弱。LISA局部自相关结果显示:每年的热点地区和冷点地区数目均在10个左右。热点主要集中在中、西部地区,且有从西部向中部聚拢的趋势。2013-2015年在东南部出现了明显的冷点区域的聚集。相邻地区出现显著差异的区域(HL和LH)并不多。聚集区统计及可视化地图见表 2、图 2。

|
| 注:通过经验Bayes调整自相关比率 图 2 2010-2015年广西局部自相关LISA聚集图 |
4.时空扫描统计量分析和可视化输出:
(1) 时空扫描统计量分析:通过时空扫描,侦测到两处聚集区域:一级聚集区(冷点),扫描窗口的中点位于梧州市辖的岑溪市,扫描半径为150.8 km,聚集时段为2014年全年。该区域传染性肺结核发生率是周围地区的0.54倍(RR=0.54)。二级聚集区(热点),扫描窗口的中点位于百色市辖的乐业县,扫描半径为276.74 km,聚集时段为2011年全年。该区域传染性肺结核发生率是相邻其他地区的1.53倍(RR=1.53)。扫描统计量输出结果,见表 3。
(2) 传染性肺结核时空聚集可视化输出:从R语言输出的三维聚集区看,相对不同时段,西部高发区只在2011年一过性出现,之后逐渐回暖;而东部则在2014年表现了普遍低发的态势,见图 3。
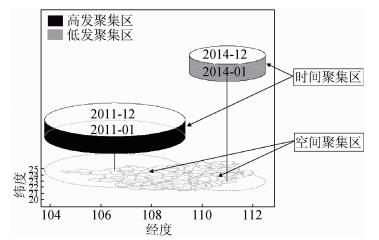
|
| 图 3 2010-2015年广西传染性肺结核三维时空扫描聚集区 |
广西作为中国西南部欠发达省份,活动性肺结核和其中的传染性肺结核的报告发病率一直处于高势。而一些经济水平较高的国家和省、市的结核病已经控制在了相当低的水平[9]。由此可见,区域经济水平直接影响了结核病的流行和控制。然而作为传播机制复杂的传染病,结核病流行是否有其他推动传播因素,仍有待研究。近年来,提倡精确防控的结核病防治模式,取代广覆盖、低效率的撒网模式。因此有必要探明结核病的传播模式和其发展趋势,找到传播的根源、重点区域和亚组人群,以帮助建立合理的传播机制假设和统计推断。
时空分析技术是近年来在慢性病和传染病领域应用较为广泛的流行病学分析技术[10-12]。国内外很多研究,借助时空统计技术,证明了结核病的传播确实存在一定的季节趋势和空间传播属性[4, 13]。本研究所用的病例数据来源于国家传染病报告系统,经抽样调查,误诊和数据漏报率较低,已和估计发病水平非常接近[14],可以代表目前广西的肺结核的实际流行情况。通过时间序列分析、空间自相关分析、时空扫描统计量分析及聚集区域的可视化技术的应用,真实还原2010-2015年广西传染性肺结核的传播和变化趋势。
目前可用于疾病预测的时间序列预测模型有自相关移动平均(ARIMA)模型、Holt线性趋势模型、Winters相乘模型和简单季节模型等[15-16]。通过模型筛选和拟合,Winters相乘模型更适合对广西未来传染性肺结核发病情况进行预测。从预测曲线看,传染性肺结核病例总体呈缓慢下降,证明目前的防控措施起到了一定的效果。高发病季节为春夏季,支持在印度一项研究的观点[17]:大多数结核病患者因为在冬季缺少户外运动和充足的紫外线照射而感染结核杆菌,经过数月到半年的潜伏期发病,95%CI可作为下一年度系统监测的实时预警指标,若超过其值则有可能出现异常情况,应及时启动调查与应对程序。
对各年度的空间自相关分析发现,传染性肺结核高发聚集区随着时间的推移有从西南向东北方向迁移的趋势,但总体都围绕着中部地区变化。都安县、宜州市、忻城县和上林县各年度均表现为热点区域,说明该地区一直存在相对广泛、持续的传染源,在人群中传播结核杆菌。这些热点地区多处在山区,经济落后,给结核杆菌提供了传播条件[18]。当然也不排除周边国家和省(市)的影响。有证据证明,人口的迁徙可能加剧结核病传播[19]。对于高发聚集区的识别也为分子流行病学的假设提供了线索。有研究指出,某些地区的结核病聚集发病,特别是耐药结核的聚集发病是由于近期传播引起的[20],而散发地区的结核病发生则可能归咎于体内潜伏杆菌的自激活。经过有效干预,由于近期传播导致的结核病疫情可明显下降[21]。而自激活模式地区的结核病疫情只能依靠健康教育、基本防护和有效疫苗的接种来降低。
时空扫描统计量将观察变量的空间属性和时间属性进行了整合,能够更加立体了解结核病的流行特征。特别是R语言的可视化模块,有效还原SaTScan的时空扫描统计的圆柱形窗口,为时空聚集区的结果解读提供了便利。2010-2015年虽然热点地区持续存在,但仅在2011年出现空间和时间的高发聚集,甚至2014年出现了低发聚集区。说明传染性肺结核的传播已得到了有效控制。但是,无高发聚集区不代表控制了疫情,当结核病出现散在高水平传播的情况,可能无法被软件识别出来,仍需结合实际发病情况调整防控策略。
综上所述,2010-2015年广西的传染性结核病疫情呈现了总体缓慢下降、夏秋季高发的时间变化趋势;中、西部地区高发聚集区和东部低发聚集区出现,为合理布局结核病防控资源提供依据,也为下一步开展分子流行病学研究,探索结核分枝杆菌成簇和迁徙模式提供了重要线索。
利益冲突: 无
| [1] | World Health Organization. Global tuberculosis report 2016[R/OL].[2016-10-14]. http://www.who.int/tb/publications/global_report/en/. |
| [2] | Xie YH, Chongsuvivatwong V, Tang ZZ, et al. Spatio-temporal clustering of hand, foot, and mouth disease at the county level in Guangxi, China[J]. PLoS One, 2014, 9(2): e88065. DOI:10.1371/journal.pone.0088065 |
| [3] | Zulu LC, Kalipeni E, Johannes E. Analyzing spatial clustering and the spatiotemporal nature and trends of HIV/AIDS prevalence using GIS:the case of Malawi, 1994-2010[J]. BMC Infect Dis, 2014, 14(1): 285. DOI:10.1186/1471-2334-14-285 |
| [4] | Li XX, Wang LX, Zhang J, et al. Exploration of ecological factors related to the spatial heterogeneity of tuberculosis prevalence in P.R. China[J]. Global Health Actio, 2014, 7(1): 23620. DOI:10.3402/gha.v7.23620 |
| [5] | Sun WY, Gong JH, Zhou JP, et al. A spatial, social and environmental study of tuberculosis in China using statistical and GIS technology[J]. Int J Environ Res Public Health, 2015, 12(2): 1425–1448. DOI:10.3390/ijerph120201425 |
| [6] | Moran PA. Notes on continuous stochastic phenomena[J]. Biometrika, 1950, 37(1/2): 17–23. DOI:10.2307/2332142 |
| [7] | Chan TC, King CC. Surveillance and epidemiology of infectious diseases using spatial and temporal clustering methods[M]//Zeng D, Chen H, Bies D, et al. Infectious Disease Informatics and Biosurveillance:Research, Systems and Case Studies. US:Springer, 2010:208-234. DOI:10.1007/978-1-4419-6892-0_10. |
| [8] | Kulldorff M. A spatial scan statistic[J]. Commun Stat, 1997, 26(6): 1487–1496. DOI:10.1080/03610929708831995 |
| [9] | Schepisi MS, Gualano G, Piselli P, et al. Active tuberculosis case finding interventions among immigrants, refugees and asylum seekers in Italy[J]. Infect Dis Rep, 2016, 8(2): 6594. DOI:10.4081/idr.2016.6594 |
| [10] | Kulldorff M, Athas WF, Feurer EJ, et al. Evaluating cluster alarms:a space-time scan statistic and brain cancer in Los Alamos, New Mexico[J]. Am J Public Health, 1998, 88(9): 1377–1380. DOI:10.2105/AJPH.88.9.1377 |
| [11] | Zhu Q, Hao YT, Ma JQ, et al. Surveillance of hand, foot, and mouth disease in mainland China (2008-2009)[J]. Biomed Environ Sci, 2011, 24(4): 349–356. DOI:10.3967/0895-3988.2011.04.005 |
| [12] | Rotela C, Fouque F, Lamfri M, et al. Space-time analysis of the dengue spreading dynamics in the 2004 Tartagal outbreak, Northern Argentina[J]. Acta Trop, 2007, 103(1): 1–13. DOI:10.1016/j.actatropica.2007.05.003 |
| [13] | Li L, Xi YL, Ren F. Spatio-temporal distribution characteristics and trajectory similarity analysis of tuberculosis in Beijing, China[J]. Int J Environ Res Public Health, 2016, 13(3): 291. DOI:10.3390/ijerph13030291 |
| [14] |
夏愔愔, 杜昕, 陈伟, 等.
2010年全国肺结核患病率地区差异分析[J]. 中国防痨杂志, 2012, 34(12): 803–807.
Xia YY, Du X, Chen W, et al. Pulmonary tuberculosis prevalence among different regions in China in 2010[J]. Chin J Antituberc, 2012, 34(12): 803–807. |
| [15] |
钟球, 蒋莉, 周琳, 等.
广东省结核病发病趋势的时间序列分析[J]. 中国防痨杂志, 2010, 32(9): 515–519.
Zhong Q, Jiang L, Zhou L, et al. Application of time series analysis for the prediction of incidence trend of tuberculosis in Guangdong province[J]. Chin J Antituberc, 2010, 32(9): 515–519. |
| [16] |
林定文, 余红平, 秦林原, 等.
基于时间序列模型的广西肺结核患者登记数量发展趋势分析[J]. 广西医学, 2015, 37(9): 1298–1301.
Lin DW, Yu HP, Qin LY, et al. Development trend of registration number of patients with tuberculosis in Guangxi based on time series model[J]. Guangxi Med J, 2015, 37(9): 1298–1301. DOI:10.11675/j.issn.0253-4304.2015.09.27 |
| [17] | Thorpe LE, Frieden TR, Laserson KF, et al. Seasonality of tuberculosis in India:is it real and what does it tell us?[J]. Lancet, 2004, 364(9445): 1613–1614. DOI:10.1016/S0140-6736(04)17316-9 |
| [18] | Olson NA, Davidow AL, Winston CA, et al. A national study of socioeconomic status and tuberculosis rates by country of birth, United States, 1996-2005[J]. BMC Public Health, 2012, 12(1): 365. DOI:10.1186/1471-2458-12-365 |
| [19] | Ge EJ, Zhang X, Wang XM, et al. Spatial and temporal analysis of tuberculosis in Zhejiang province, China, 2009-2012[J]. Infect Dis Poverty, 2016, 5(1): 11. DOI:10.1186/s40249-016-0104-2 |
| [20] | Ozcaglar C, Shabbeer A, Vandenberg SL, et al. Epidemiological models of Mycobacterium tuberculosis complex infections[J]. Math Biosci, 2012, 236(2): 77–96. DOI:10.1016/j.mbs.2012.02.003 |
| [21] | Wu P, Lau EHY, Cowling BJ, et al. The transmission dynamics of tuberculosis in a recently developed Chinese city[J]. PLoS One, 2010, 5(5): e10468. DOI:10.1371/journal.pone.0010468 |
 2017, Vol. 38
2017, Vol. 38