文章信息
- 聂黎, 庞星火, 张政, 马建新, 刘秀颖, 邱倩, 梁妍, 李倩, 张卫.
- Nie Li, Pang Xinghuo, Zhang Zheng, Ma Jianxin, Liu Xiuying, Qiu Qian, Liang Yan, Li Qian, Zhang Wei.
- 不同种类和剂量乙型肝炎疫苗成年人快速免疫效果观察
- Effectiveness of rapid hepatitis B vaccination with different vaccine dosages and types in adults
- 中华流行病学杂志, 2017, 38(9): 1151-1155
- Chinese journal of Epidemiology, 2017, 38(9): 1151-1155
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2017.09.001
-
文章历史
收稿日期: 2017-01-04
2. 100013 北京市疾病预防控制中心 北京市预防医学研究中心 免疫预防管理所;
3. 100021 北京市朝阳区疾病预防控制中心流行病和地方病控制科
2. Department of Planned Immunization Programme, Beijing Municipal Center for Disease Control and Prevention, Beijing Centers for Preventive Medical Research, Beijing 100013, China;
3. Department of Infectious Diseases and Endemic Diseases Prevention, Chaoyang District Center for Disease Control and Prevention, Beijing 100021, China
HBV感染流行是我国重要的公共卫生问题[1]。乙型肝炎(乙肝)疫苗(HepB)接种是目前预防HBV感染及其后果的最有效方法之一。自1992年我国开始在新生儿人群中全面推广HepB接种以来,尽管小年龄组HBsAg阳性率已经大幅下降,但在2006年的全国调查中显示20~59岁年龄组HBsAg阳性率仍高于8%[2-3]。北京市“十一五”期间人群抽样调查也显示,≥30岁居民抗-HBs阳性率仅为30%~40%[4]。目前采用的HepB “0-1-6”接种方案,对成年人群而言其常规程序依从性不佳[5],需探讨更加适合于成年人的快速免疫方案,以提高其接种率。为此本研究通过对≥20岁成年人按“0-1-2”方案接种10、20 μg酒酿酵母乙肝疫苗(HepB-SCY)、20 μg中国仓鼠卵巢乙肝疫苗(HepB-CHO)、10 μg汉逊酵母乙肝疫苗(HepB-HPY),观察接种后抗-HBs阳转率和滴度水平,评估不同种类和剂量的HepB在成年人中的快速免疫效果。
对象与方法1.研究对象:源自北京市朝阳区艾滋病和病毒性肝炎综合防治示范区基线调查抽取的22个街道(地区),采用入户动员、集中采血调查的方法,募集初筛研究对象[4]。初筛合格者以社区卫生服务中心为单位,选择年龄≥20周岁、居住地稳定便于随访、乙肝5项指标检测为阴性或单纯抗-HBc阳性,且无乙肝疫苗接种禁忌证者,根据研究可行性分为4组。
2.研究方法:
(1) 接种疫苗和方案:按照“0-1-2”接种方案,对4组研究对象分别肌肉注射10 μg HepB-SCY(北京天坛生物制品股份有限公司)、20 μg HepB-SCY(GlaxoSmithKline Biologicals s.a.)、20 μg HepB-CHO(华北制药集团金坦生物制药有限公司)、10 μg HepB-HPY(大连汉信生物制药有限公司)。
(2) 问卷调查:研究对象知情同意后,采用面对面询问式调查了解其年龄、婚姻状况、既往HepB接种情况等。
(3) 血清学指标检测:接种疫苗前和全程免疫接种后1~2个月内,采集5 ml静脉血,用化学发光微粒子免疫分析法(CMIA)在接种前检测乙肝5项指标、接种后定量检测抗-HBs滴度。
3.统计学分析:采用SPSS 19.0软件进行数据统计学分析。4组研究对象基本情况的组间差异、接种疫苗后抗-HBs阳转率比较以及其他影响因素的单因素分析采用χ2检验、Mantel-Haensel χ2分析和Kruskal-Wallis秩和检验。多因素分析采用logistic模型拟合。组别和“是否单独核心抗体阳性”为本研究主要关注的2个自变量进入模型;“乙肝疫苗接种史”作为潜在的混杂变量进入模型;其他自变量的选择采用逐步回归的方法,P<0.1进入模型。
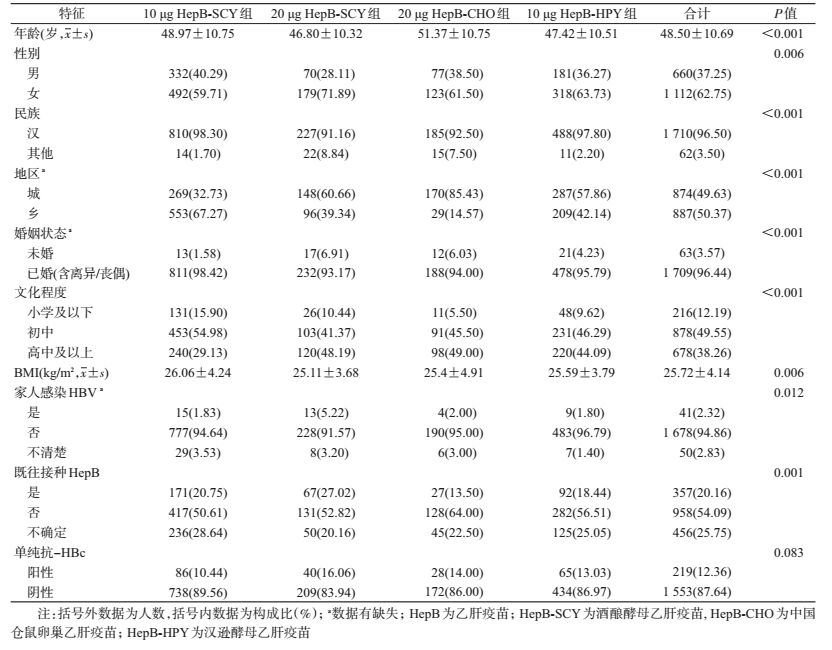
结果1.基本情况:共1 772名符合条件的研究对象完成疫苗接种和效果观察。平均年龄48.50岁,<30岁仅占6.38%;绝大多数已婚;>60%为女性;城乡人群约各占50%;BMI均值为25.72 kg/m2;超过半数的研究对象既往未接种过HepB,有1/4的研究对象接种史不详;单纯抗-HBc阳性者占12.36%。4组研究对象在年龄、性别等的差异均有统计学意义(表 1)。
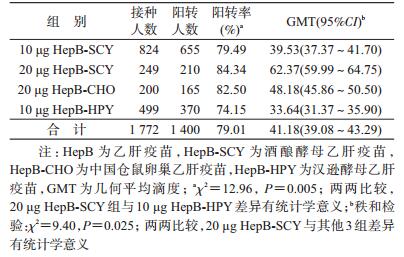
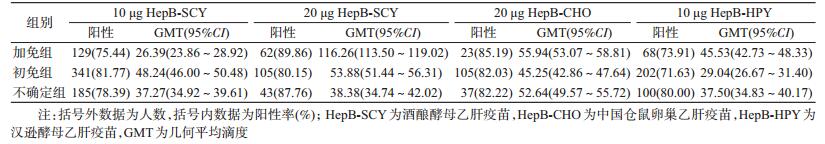
2.接种HepB后抗-HBs阳转率和滴度水平:共1 400人接种疫苗1个月后发生抗-HBs阳转,总阳转率为79.01%,几何平均滴度(GMT)为41.18 mIU/ml。不同种类不同剂量疫苗组阳转率的差异有统计学意义,20 μg HepB-SCY组阳转率最高(84.34%),10 μg HepB-HPY组阳转率最低(74.15%),见表 2。根据研究对象自我报告既往是否接种过HepB分为“加免”、“初免”和“不确定”3组,除10 μg HepB-SCY组外,加免组抗-HBs的GMT普遍高于初免和不确定组(表 3)。
不同剂量和种类疫苗在不同年龄组中的抗体滴度水平亦不相同。在<30岁组中,4组接种对象抗-HBs的GMT水平差异较大,20 μg HepB-SCY组GMT达到700 mIU/ml,10 μg HepB-HPY组仅为10.4 mIU/ml。4组抗-HBs水平均随着年龄增大均呈下降趋势,抗-HBs在各组间GMT的差异随年龄增大而缩小,≥40岁接种对象抗-HBs的GMT均下降至不足100 mIU/ml(图 1)。

|
| 注:HepB-SCY为酒酿酵母乙肝疫苗,HepB-CHO为中国仓鼠卵巢乙肝疫苗,HepB-HPY为汉逊酵母乙肝疫苗 图 1 4组乙肝疫苗接种后不同年龄组人群抗-HBs的几何平均滴度水平 |
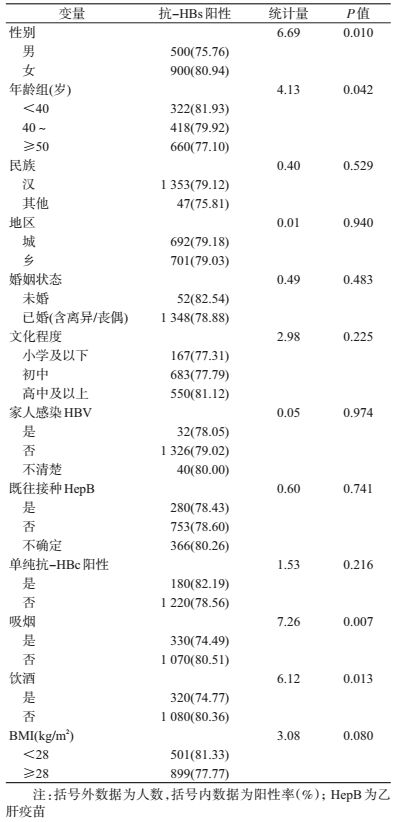
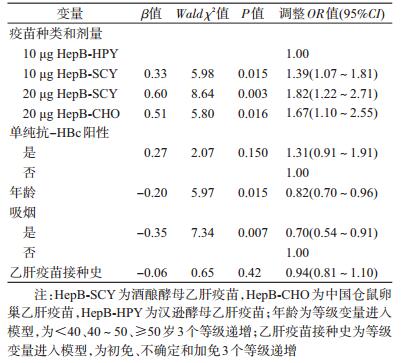
3.影响抗-HBs阳性的因素分析:单因素分析中,除接种疫苗的种类和剂量外,性别、年龄、是否吸烟和饮酒因素与抗-HBs关联有统计学意义(表 4)。采用logistic多因素分析,接种疫苗的种类和剂量、是否单纯抗-HBc阳性、年龄、是否吸烟进入模型。在控制了其他变量后,接种疫苗的种类和剂量与抗-HBs关联有统计学意义,且接种20 μg HepB-SCY的研究对象抗-HBs阳性的概率是接种10 μg HepB-HPY组的1.82倍(表 5)。
本研究评估了4组不同剂量不同表达体系的HepB在成年人中采用“0-1-2”快速免疫方案的效果,为国内成年人特别是高年龄组人群缩短接种周期、提高接种率提供了参考依据[4]。
研究中发现,接种疫苗后抗-HBs平均阳转率为79.01%,GMT为41.18 mIU/ml,远低于在健康人群中采用其他快速免疫方案和“0-1-6”程序免疫效果的相关报道。例如,在古巴460名20~64岁健康人中按“0-1-2”接种20 μg重组HepB,抗-HBs阳转率和GMT分别为97.0%和932.18 mIU/ml[6];Yao等[7]在中国近250名成年人中采用“0-1-3”方案接种10 μg重组HepB,抗-HBs阳转率和GMT分别为83.9%和61.19 mIU/ml。张卫等[8-10]在成年人中按“0-1-6”常规免疫程序接种10 μg和20 μg HepB-CHO,两组抗-HBs阳转率分别为88.8%和95.3%,抗-HBs的GMT分别为173.42 mIU/ml和588.51 mIU/ml;龚晓红等[11]按相同程序在大学生中接种5~20 μg不同剂量3种表达体系的HepB,抗-HBs平均阳性率达到95.5%,GMT达到1 336.58 mIU/ml。
影响本研究免疫效果低于其他研究的主要原因:第一,研究对象年龄普遍较高,平均年龄接近50岁。有研究认为HepB免疫效果随年龄增大而减弱[12],如美国一项老年人(平均82.2岁)按“0-1-4”接种20 μg重组HepB的研究,抗-HBs阳性率仅为33.3%,GMT仅为4.81 mIU/ml[13]。本文4个组不同年龄段的GMT变化趋势和logistic回归分析结果也证实了高龄是影响免疫效果的主要因素。此外研究中还显示,各组内≥40岁者GMT下降趋势已趋于平缓,不同组间的免疫应答效果几乎趋于一致。第二,既往研究显示,成年人采用快速接种方案免疫效果低于“0-1-6”常规免疫程序[7]。但是既往研究结果大部分是基于青年人的研究,而本研究则为中老年人。
本研究比较了4组不同剂量不同表达体系HepB免疫效果,20 μg HepB-SCY组阳转率最高(84.34%),10 μg HepB-HPY组阳转率最低(74.15%)。在控制了年龄、吸烟和单纯核心抗体阳性等变量后,20 μg HepB-SCY和20 μg HepB-CHO免疫效果均优于10 μg的2个疫苗。因此,与常规接种程序相仿[8-10],相比10 μg而言,20 μg剂量仍旧为高龄人群的推荐剂量。从表达体系上来看,HepB-SCY的免疫效果基本与HepB-CHO相似。
本研究的单因素和多因素分析表明,是否单纯抗-HBc阳性与抗-HBs阳性无统计学关联。我国一项“0-1-3”方案20 μg成年人HepB接种研究,单纯抗-HBc阳性者抗-HBs阳性率和GMT均低于乙肝5项指标阴性的对象[14]。本文单纯抗-HBc阳性者比例较少,仅占12%,在多因素分析中该变量不够稳健;此外可能是单纯抗-HBc阳性结果存在假阳性。因此在实际预防接种中,建议单纯抗-HBc阳性者仍需接种HepB。
本研究中男性、吸烟者和饮酒者均呈现相对较低的抗-HBs阳性率。通过多因素模型分析,最终只有“是否吸烟”变量进入模型。但由于研究中未收集吸烟和饮酒频率等详细资料,无法对该类变量做深入分析。同时,4组中吸烟和饮酒者多为男性,性别、吸烟和饮酒3个变量高度相关,难以解释究竟哪个因素通过何机制最终影响了抗-HBs的阳转。
本文存在局限性。首先,近1/4的研究对象在HepB接种史调查上回答为不确定;其次,研究中仅记录了完成全程3针接种后的抗-HBs水平,缺乏每一针次后数据,无法全面了解快速免疫方案下的免疫应答变化趋势;另外,本文基于多个社区卫生服务中心(接种点)的项目,部分接种点未详细调查没有完成全程接种的原因,但失访人数较少,对研究结果的影响不大。
总之,尽管HepB “0-1-2”快速免疫方案在抗-HBs阳转率和滴度水平上低于常规免疫程序,但是20 μg的接种剂量仍能在中高年龄组人群中获得80%以上的阳转率。因此,采用20 μg HepB-SCY和HepB-CHO的“0-1-2”快速接种方案可以作为常规免疫程序的补充。
利益冲突: 无
| [1] | Lu FM, Li T, Liu S, et al. Epidemiology and prevention of hepatitis B virus infection in China[J]. J Viral Hepat, 2010, 17(Suppl 1): 4–9. DOI:10.1111/j.1365-2893.2010.01266.x |
| [2] | Liang XF, Bi SL, Yang WZ, et al. Epidemiological serosurvey of hepatitis B in China-declining HBV prevalence due to hepatitis B vaccination[J]. Vaccine, 2009, 27(47): 6550–6557. DOI:10.1016/j.vaccine.2009.08.048 |
| [3] | Liang XF, Bi SL, Yang WZ, et al. Evaluation of the impact of hepatitis B vaccination among children born during 1992-2005 in China[J]. J Infect Dis, 2009, 200(1): 39–47. DOI:10.1086/599332 |
| [4] |
张秀春, 庞星火, 张卫, 等.
2010年北京市朝阳区乙型肝炎流行状况调查[J]. 中华预防医学杂志, 2012, 46(7): 623–626.
Zhang XC, Pang XH, Zhang W, et al. Prevalence of hepatitis B in Chaoyang district, Beijing in 2010[J]. Chin J Prev Med, 2012, 46(7): 623–626. DOI:10.3760/cma.j.issn.0253-9624.2012.07.010 |
| [5] |
谈逸云, 申惠国, 赵黎芳, 等.
成人乙肝疫苗主动接种影响因素分析[J]. 中国公共卫生, 2010, 26(2): 218–220.
Tan YY, Shen HG, Zhao LF, et al. Influencing factors of active vaccination of hepatitis B vaccine in adults[J]. Chin J Public Health, 2010, 26(2): 218–220. DOI:10.11847/zgggws2010-26-02-49 |
| [6] | Estévez ZC, Betancourt AA, González VM, et al. Immunogenicity and safety assessment of the Cuban recombinant hepatitis B vaccine in healthy adults[J]. Biologicals, 2007, 35(2): 115–122. DOI:10.1016/j.biologicals.2006.06.001 |
| [7] | Yao J, Li J, Chen YD, et al. The response of hepatitis B vaccination on seronegative adults with different vaccination schedules[J]. Hum Vaccin Immunother, 2015, 11(5): 1102–1107. DOI:10.4161/21645515.2014.985500 |
| [8] |
张卫, 林长缨, 韩莉莉, 等.
不同剂量国产重组酵母乙型肝炎疫苗成年人免疫效果及影响因素研究[J]. 中华流行病学杂志, 2010, 31(7): 767–770.
Zhang W, Lin CY, Han LL, et al. Study on the immuno-effects and influencing factors of Chinese Hamster Ovary (CHO) cell hepatitis B vaccine among adults, under different dosages[J]. Chin J Epidemiol, 2010, 31(7): 767–770. DOI:10.3760/cma.j.issn.0254-6450.2010.07.011 |
| [9] |
张卫, 韩莉莉, 林长缨, 等.
重组中国仓鼠卵巢细胞乙型肝炎疫苗应用于成人后细胞及体液免疫的效果研究[J]. 中华预防医学杂志, 2010, 44(10): 918–922.
Zhang W, Han LL, Lin CY, et al. Study on the cellular and humoral immunity effect of recombinant Chinese hamster ovary cell hepatitis B vaccine in adults[J]. Chin J Prev Med, 2010, 44(10): 918–922. DOI:10.3760/cma.j.issn.0253-9624.2010.10.016 |
| [10] | Zhang W, Han LL, Lin LY, et al. Surface antibody and cytokine response to recombinant Chinese hamster ovary cell (CHO) hepatitis B vaccine[J]. Vaccine, 2011, 29(37): 6276–6282. DOI:10.1016/j.vaccine.2011.06.045 |
| [11] |
龚晓红, 王富珍, 吴疆, 等.
不同种类国产基因重组乙型肝炎疫苗免疫原性观察[J]. 中国计划免疫, 2007, 13(4): 316–318.
Gong XH, Wang FZ, Wu J, et al. Observation on the immunity effects with different hepatitis B vaccine made by recombinant DNA techniques[J]. Chin J Vaccin Immun, 2007, 13(4): 316–318. DOI:10.3969/j.issn.1006-916X.2007.04.008 |
| [12] | Yang SG, Tian G, Cui YX, et al. Factors influencing immunologic response to hepatitis B vaccine in adults[J]. Sci Rep, 2016, 6: 27251. DOI:10.1038/srep27251 |
| [13] | Tohme RA, Awosika-Olumo D, Nielsen C, et al. Evaluation of hepatitis B vaccine immunogenicity among older adults during an outbreak response in assisted living facilities[J]. Vaccine, 2011, 29(50): 9316–9320. DOI:10.1016/j.vaccine.2011.10.011 |
| [14] | Yao J, Ren W, Chen YD, et al. Responses to hepatitis B vaccine in isolated anti-HBc positive adults[J]. Hum Vaccin Immunother, 2016, 12(7): 1847–1851. DOI:10.1080/21645515.2016.1139256 |
 2017, Vol. 38
2017, Vol. 38