文章信息
- 王璐, 刘学智, 任志英, 丁玲, 南晶, 刘春亮, 宋志超, 冯美娟, 杨倩, 王金桃.
- Wang Lu, Liu Xuezhi, Ren Zhiying, Ding Ling, Nan Jing, Liu Chunliang, Song Zhichao, Feng Meijuan, Yang Qian, Wang Jintao.
- 多环芳烃与p16、FHIT基因CpG岛甲基化在宫颈上皮内瘤变中的交互效应
- Interaction between polycyclic aromatic hydrocarbons and p16, FHIT gene CpG island methylation in patients with cervical intraepithelial neoplasias
- 中华流行病学杂志, 2017, 38(8): 1113-1117
- Chinese journal of Epidemiology, 2017, 38(8): 1113-1117
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2017.08.023
-
文章历史
收稿日期: 2016-12-27
2. 030001 太原, 山西省心血管病医院社区健康中心
2. Community Health Center, Shanxi Cardiovascular Hospital, Taiyuan 030001, China
多环芳烃(PAH)是环境中广泛存在的污染物,具有致癌、致畸、致突变性。芘在PAH混合物中含量较高,进入人体后约95%的芘代谢为1-羟基芘(1-OHP),通过检测尿中1-OHP的浓度,可较好反映PAH的暴露情况。细胞学研究显示,在HPV31感染的宫颈细胞中,暴露于高浓度苯并(a)芘[B(a)P]组的HPV31病毒含量是低浓度组的10倍[1]。抑癌基因p16、FHIT与多种肿瘤的发生密切相关。本课题组前期研究发现,随着宫颈病变的加重,p16、FHIT基因CpG岛的甲基化率呈升高趋势[2-3]。PAH暴露引起的基因启动子及其附近区域内CpG岛甲基化是导致癌症发生发展的机制之一,基于细胞学研究提示PAH可导致DNA甲基化的改变[4],然而,关于PAH在宫颈上皮内瘤变(CIN)中的作用,以及PAH与抑癌基因DNA甲基化在CIN中的相互关系目前尚未见相关报道。为此,本研究旨在探讨PAH与p16、FHIT基因CpG岛甲基化在CIN中的作用及其交互效应,为其致病机制研究提供依据。
对象与方法1.研究对象:包括CIN患者169例(CINⅠ86例,CINⅡ/Ⅲ 83例)和正常宫颈(NC)妇女91例,均源自本课题组2014年6-12月建立的山西省阳曲县宫颈病变自然人群队列。所有研究对象均经知情同意,且病理学确诊,排除妊娠期和哺乳期妇女,有子宫切除术、宫颈及阴道病变治疗史者,其他恶性肿瘤患者,血液系统、消化系统疾病以及精神病患者。
2.资料收集:采用统一的结构式问卷,由培训合格的调查人员对研究对象进行面对面调查,包括人口学特征、生活方式、个人卫生习惯、月经史、婚姻史、孕产史、既往病史、肿瘤家族史等。采集全部研究对象晨尿30 ml,取1 ml尿样用于尿肌酐检测,剩余尿样分装后置于-80 ℃冰箱保存。所有尿样于6个月内检测完毕。同时采集清晨空腹静脉血5 ml,常温静置,33 000 r/min离心10 min,将分离后的血凝块分装于3个冻存管中,置-80 ℃贮存待检。
3.实验方法:
(1) 尿液1-OHP浓度检测:采用高效液相色谱法。以碱水解法进行尿样前期处理,设定流动相为75%甲醇(色谱级)和25%超纯水,以等度方式进行洗脱,流速为1.0 ml/min,进样时间10 min,进样体积10 μl,柱温箱温度为30 ℃。采用反相C18高效液相色谱柱(150 mm×4.6 mm×5 μm;Waters,USA),利用配置有2475多波长荧光检测器(Waters,USA)的Alliance E2695高效液相色谱仪(Waters,USA),在激发波长λex=346 nm、发射波长λem=386 nm的条件下进行检测。采用保留时间定性,内标法定量,结果均经尿肌酐进行校正。本次实验1-OHP检出限为0.03 μg/L,回收率范围为89.7%~107.6%,日内精密度和日间精密度分别为3.7%和7.8%。
(2) 抑癌基因p16、FHIT CpG岛甲基化状态检测:采用甲基化特异性PCR法(MSP)。参照本课题组前期建立的方法[2-3],先用酚-氯仿法提取血凝块中总DNA,亚硫酸盐进行DNA甲基化修饰,55 ℃避光孵育过夜,经Wizard DNA Clean Up System试剂(Promega,USA)纯化后,溶入40 μl三蒸水中,在PTC200-PCR仪(Bio-Rad,USA)上扩增。p16基因的甲基化引物(F:5′-TTA TTA GAG GGT GGG GCG GAT CGC-3′,R:5′-GAC CCC GAA CCG CGA CCG TAA-3′)和非甲基化引物(F:5′-TTA TTA GAG GGT GGG GTG GAG TGT-3′,R:5′-CAA CCC CAA ACC ACA ACA CTA A-3′)产物长度分别为150 bp、151 bp。FHIT基因的甲基化引物(F:5′-TTG GGG CGC GGG TTT GGG TTT TTA CGC-3′,R:5′-CGT AAA CGA CGC CGA CCC CAC TA-3′)和非甲基化引物(F:5′-TTG GGG TGT GGG TTT GGG TTT TTA TG-3′,R:5′-CAT AAA CAA CAC CAA CCC CAC TA-3′)产物长度均为74 bp。对PCR扩增产物行2%琼脂糖凝胶电泳,在VILBER CV-A50C凝胶成像仪下观察,分别获得p16基因、FHIT基因甲基化和未甲基化条带。
4.统计学分析:采用SPSS 20.0软件进行相关资料的Kruskal-Wallis H检验、χ2检验、趋势χ2检验,采用logistic回归模型计算因素与宫颈疾病之间关联强度的OR值及其95%CI。应用广义多因子降维模型(GMDR)评价交互作用[5],将检验样本准确度最高和交叉验证一致性最高,且置换检验有统计学意义的模型确定为最优模型,如果检验样本准确度最高和交叉验证一致性最高的模型不是同一个模型,则优先选取阶数较低的模型。
结果1.人口学特征及相关因素分析:NC组及CINⅠ、CINⅡ/Ⅲ组在年龄、出生地、居住地、民族、婚姻状况、职业、文化程度、吸烟、被动吸烟、饮茶、饮酒、洗澡频率、洗阴频率、内裤换洗频率、性生活后清洗、经期性生活、绝经、首次性交年龄、孕次、产次、阴道炎、既往慢性病史、家族肿瘤史、妇科手术史等方面的差异均无统计学意义(P>0.05),但在HPV感染(χ2=8.315,P=0.016)、非经期是否使用护垫(χ2=6.637,P=0.036)、月经初潮年龄(χ2=24.907,P<0.001)、痛经(χ2=9.013,P=0.011)、人工流产史(χ2=6.725,P=0.035)、避孕(χ2=20.096,P<0.001)、盆腔炎(χ2=7.007,P=0.030) 的差异均有统计学意义。
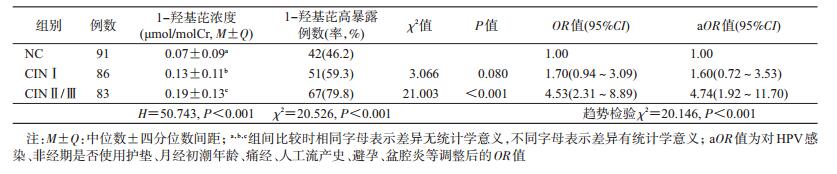
2. 1-OHP浓度与CIN的关系:经Kruskal-Wallis H检验,各组1-OHP浓度总体分布不同(H=50.743,P<0.001),采用Bonferroni法(检验水准为调整α’=0.05/C32=0.05/3=0.016 7) 进行两两比较显示,CINⅡ/Ⅲ组1-OHP浓度高于CINⅠ组和NC组,CINⅠ组1-OHP浓度高于NC组。进一步以NC组的1-OHP浓度的P50点值(0.07 μmol/molCr)为界分为高暴露和低暴露进行定性分析,结果显示,1-OHP高暴露率在CINⅡ/Ⅲ组高于NC组,差异有统计学意义(P<0.001)。随着CIN程度的加重,1-OHP高暴露率逐渐升高(趋势χ2=20.146,P<0.001),见表 1。
3. p16、FHIT基因CpG岛甲基化状况与CIN的关系:CINⅠ组、CINⅡ/Ⅲ组p16、FHIT CpG岛甲基化率均高于NC组,差异均有统计学意义,且随CIN程度加重,p16(趋势检验χ2=9.746,P=0.002) 和FHIT(趋势检验χ2=10.389,P=0.001) CpG岛甲基化率均逐渐升高(表 2)。
4. 1-OHP与p16、FHIT基因CpG岛甲基化在CIN中的交互作用:将1-OHP、p16、FHIT基因CpG岛甲基化3个因素纳入GMDR,以NC组为对照进行了交互作用分析(表 3)。结果显示,在CINⅡ/Ⅲ组,1-OHP、p16、FHIT基因CpG岛甲基化交互作用为最佳模型,检验样本准确度为0.632 7,交叉验证一致性达到10/10,且置换检验有统计学意义(P<0.05),在调整CIN的相关因素后这种效应更明显,检验样本准确度提高到0.673 4。在CINⅠ组,调整CIN的相关因素后,1-OHP、p16、FHIT基因CpG岛甲基化交互作用为最佳模型,检验样本准确度为0.604 1,交叉验证一致性达到10/10,且置换检验有统计学意义(P<0.05)。
B(a)P是环境化学致癌物,通常作为PAH的代表。B(a)P进入人体后,首先在CYP450 Ⅰ相代谢酶作用下,形成具有致癌作用的环氧化物和二醇环氧化物等,进而在Ⅱ相代谢酶的催化作用下,形成7,8-二羟基-9,10-环氧苯并(a)芘(BPDE)[6-7]。BPDE是最终致癌物,具有亲电性,易与DNA及蛋白质等体内大分子物质结合,形成BPDE-DNA加合物,引起DNA损伤,最终引发癌症等疾病[6, 8]。目前用于评价PAH暴露的生物标志物很多,由于芘在PAH混合物中含量较高,1-OHP是芘在哺乳动物体内的主要代谢物[9-10],因而成为评价个体PAH暴露的最重要参数[9, 11]。流行病学调查和动物实验表明,PAH可诱发皮肤、肺、肝、阴囊等部位癌症[12]。近年来,环境污染物PAH与宫颈病变的关系引起各国学者的关注。本研究采用高效液相色谱法检测结果显示,CINⅠ组、CINⅡ/Ⅲ组患者尿1-OHP浓度均高于NC组,在调整宫颈病变相关因素后,尿1-OHP浓度>0.7 μmol/molCr患CINⅠ、CINⅡ/Ⅲ的风险分别是<0.7 μmol/molCr者的1.60倍、4.74倍,且随着CIN的进展,1-OHP浓度呈逐渐上升趋势,提示随着尿中1-OHP浓度的增加,患CIN的风险也在增加。
本研究发现,抑癌基因p16、FHIT CpG岛高甲基化与宫颈癌的发生密切相关。随着宫颈病变的加重,p16、FHIT基因CpG岛的甲基化率逐渐升高[2, 13],在调整宫颈病变相关因素后,p16基因CpG岛高甲基化患CINⅠ、CINⅡ/Ⅲ的风险分别是非甲基化状态的9.87倍、13.62倍;FHIT基因CpG岛高甲基化患CINⅠ、CINⅡ/Ⅲ的风险分别是非甲基化状态的3.87倍、5.25倍,提示p16、FHIT基因CpG岛甲基化水平与宫颈病变的发生密切相关,可作为宫颈病变的标志物,用于临床早期诊断。正常情况下,在细胞由G1期向S期转变的过程中,p16蛋白可与cyclinD竞争结合CDK4、CDK6,使cyclinD与CDK4适量结合,cyclinD-CDK4/CDK6复合物可促进视网膜母细胞瘤蛋白(Rb)的磷酸化,使原来与Rb结合的转录因子E2F被释放,促进DNA解链。而p16基因启动子区CpG岛的异常甲基化可干扰基因转录,导致p16蛋白表达的降低或缺失,cyclinD失去竞争对象,与CDK4大量结合,激发Rb的磷酸化,细胞大量由G1期进入S期,在无限制的增殖过程中发生表型变化导致肿瘤形成[14]。FHIT基因参与修复和细胞周期的调控,其编码的FHIT蛋白是一个典型的二腺苷三磷酸(Ap3A)水解酶,FHIT-Ap3A复合物可通过诱发细胞凋亡而发挥抑癌作用[15]。FHIT基因启动子区CpG岛的高甲基化,可能引发其上述效应的改变,导致宫颈癌的发生。
PAH暴露引起的基因启动子及其附近区域内CpG岛内甲基化是导致众多基因过表达或沉默的重要途径,也是导致癌症发生发展的机制之一[16]。有研究表明,低浓度的PAH暴露与p53基因启动子的甲基化呈负相关[17]。李新等[18]发现,焦炉工外周血细胞p16基因CpG岛异常甲基化的检出率显著高于对照组的甲基化检出率,并且随着尿1-OHP水平的增高,p16基因CpG岛异常甲基化的检出率逐渐增高。然而,在宫颈病变发生中,多环芳烃与p16、FHIT基因CpG岛甲基化的相互关系尚不清楚。本次研究基于课题组前期关于p16、FHIT基因CpG岛甲基化对CIN作用的研究,探讨PAH与p16、FHIT基因CpG岛甲基化在CIN中的交互效应。应用GMDR分析显示,在CINⅠ和CINⅡ/Ⅲ组,调整CIN的相关因素后,1-OHP与p16和FHIT基因CpG岛甲基化之间的交互作用均为最优,交叉验证一致性均达到10/10,且置换检验均有统计学意义(P<0.05)。结果提示,1-OHP高暴露与p16、FHIT基因CpG岛甲基化同时存在时,可增加CIN发生的风险。已有研究显示,外源性致癌物B(a)P可诱导DNA甲基化转移酶(DNMT)表达水平增高,而DNMT酶活性紊乱可导致肿瘤相关基因甲基化水平的异常,增加基因组的不稳定性,从而促进肿瘤的发生发展[19-20],本课题组前期研究已发现,DNMT1的高表达是促进宫颈癌变的主要因素之一[21]。后者作为启动和维持DNA甲基化的关键酶,其功能紊乱,可引起基因DNA的甲基化异常,特别是抑癌基因CpG岛的高甲基化,因此各基因的甲基化均与DNMT1的表达有关,与宫颈癌的发生密切相关。
总之,本文从人群研究的角度揭示了PAH暴露具有增加CIN罹患风险的作用,并初步推断1-OHP高暴露与p16、FHIT基因CpG岛甲基化在CIN中存在协同作用,但此结论尚需前瞻性队列研究和实验性研究加以验证。鉴于PAH及DNA甲基化与宫颈癌关系的复杂性,其详细机制尚待探讨。
利益冲突: 无
| [1] | Alam S, Conway MJ, Chen HS, et al. The cigarette smoke carcinogen benzo[α]pyrene enhances human papillomavirus synthesis[J]. J Virol, 2008, 82(2): 1053–1058. DOI:10.1128/JVI.01813-07 |
| [2] |
吴婷婷, 王金桃, 丁玲, 等.
叶酸缺乏和p16基因CpG岛甲基化对宫颈癌变的作用[J]. 中华疾病控制杂志, 2013, 17(1): 9–12.
Wu TT, Wang JT, Ding L, et al. Folate deficiency and aberrant methylation of p16 CpG islands on cervical cancer and its precancerous lesions[J]. Chin J Dis Control Prev, 2013, 17(1): 9–12. |
| [3] | Bai LX, Wang JT, Ding L, et al. Folate deficiency and FHIT hypermethylation and HPV 16 infection promote cervical cancerization[J]. Asian Pac J Cancer Prev, 2014, 15(21): 9313–9317. DOI:10.7314/APJCP.2014.15.21.9313 |
| [4] |
蒋成兰, 张云东, 常宏, 等. 环境致癌剂多环芳烃对肺癌全基因组DNA甲基化的影响[C]//第十六届中国科协年会论文集. 昆明: 中国科学技术协会, 2014.
Jiang CL, Zhang YD, Chang H, et al. The effect of environmental carcinogens PAHs on genome-wide DNA methylation of lung cancers[C]//Proceedings of the 16th annual meeting of China association for science and technology. Kunming:China Association for Science and Techonology, 2014. |
| [5] |
陈卿, 唐迅, 胡永华.
应用广义多因子降维法分析数量性状的交互作用[J]. 中华流行病学杂志, 2010, 31(8): 938–941.
Chen Q, Tang X, Hu YH. Detecting interaction for quantitative trait by generalized multifactor dimensionality reduction[J]. Chin J Epidemiol, 2010, 31(8): 938–941. DOI:10.3760/cma.j.issn.0254-6450.2010.08.024 |
| [6] |
胡玉霞, 常福厚, 白图雅, 等.
多环芳烃类化合物及芳香烃受体在肿瘤发生发展中的作用[J]. 中国生化药物杂志, 2015, 35(6): 185–188.
Hu YX, Chang FH, Bai TY, et al. Role of polycyclic aromatic hydrocarbons and aryl hydrocarbon receptor in the development of tumor[J]. Chin J Biochem Pharm, 2015, 35(6): 185–188. |
| [7] | Xue WL, Warshawsky D. Metabolic activation of polycyclic and heterocyclic aromatic hydrocarbons and DNA damage:a review[J]. Toxicol Appl Pharmacol, 2005, 206(1): 73–93. DOI:10.1016/j.taap.2004.11.006 |
| [8] |
陈春梅, 金永堂, 徐鹤云, 等.
CYP1A1和GSTM1基因多态性与BPDE-DNA加合物的关系及其对肺癌的影响[J]. 中华医学遗传学杂志, 2012, 29(1): 23–27.
Chen CM, Jin YT, Xu HY, et al. Effects of CYP1A1 and GSTM1 gene polymorphisms and BPDE-DNA adducts on lung cancer[J]. Chin J Med Genet, 2012, 29(1): 23–27. DOI:10.3760/cma.j.issn.1003-9406.2012.01.007 |
| [9] |
段小丽, 汪翠萍, 王贝贝, 等.
多环芳烃暴露生物标志物的研究进展[J]. 环境与健康杂志, 2011, 28(3): 274–278.
Duan XL, Wang CP, Wang BB, et al. Advance of research on biomarkers to PAHs exposure[J]. J Environ Health, 2011, 28(3): 274–278. |
| [10] | Leroyer A, Jeandel F, Maitre A, et al. 1-Hydroxypyrene and 3-hydroxybenzo[α]pyrene as biomarkers of exposure to PAH in various environmental exposure situations[J]. Sci Total Environ, 2010, 408(5): 1166–1173. DOI:10.1016/j.scitotenv.2009.10.073 |
| [11] | Campo L, Rossella F, Pavanello S, et al. Urinary profiles to assess polycyclic aromatic hydrocarbons exposure in coke-oven workers[J]. Toxicol Lett, 2010, 192(1): 72–78. DOI:10.1016/j.toxlet.2008.12.018 |
| [12] | Baird WM, Hooven LA, Mahadevan B. Carcinogenic polycyclic aromatic hydrocarbon-DNA adducts and mechanism of action[J]. Environ Mol Mutagen, 2005, 45(2/3): 106–114. DOI:10.1002/em.20095 |
| [13] |
陈霄, 王金桃, 白丽霞, 等.
宫颈癌变中叶酸缺乏与脆性组氨酸三联体基因表达异常的相互作用[J]. 中华流行病学杂志, 2015, 36(4): 387–392.
Chen X, Wang JT, Bai LX, et al. Interaction between folate deficiency and aberrant expression related to fragile histidine triad gene in the progression of cervical cancerization[J]. Chin J Epidemiol, 2015, 36(4): 387–392. DOI:10.3760/cma.j.issn.0254-6450.2015.04.020 |
| [14] | Kim YT, Zhao M. Aberrant cell cycle regulation in cervical carcinoma[J]. Yonsei Med J, 2005, 46(5): 597–613. DOI:10.3349/ymj.2005.46.5.597 |
| [15] | Semba S, Han SY, Qin HR, et al. Biological functions of mammalian Nit1, the counterpart of the invertebrate Nit Fhit Rosetta stone protein, a possible tumor suppressor[J]. J Biol Chem, 2006, 281(38): 28244–28253. DOI:10.1074/jbc.M603590200 |
| [16] |
王君, 黄丽华, 金银龙.
多环芳烃暴露对DNA甲基化的影响[J]. 医学研究杂志, 2014, 43(9): 152–155.
Wang J, Huang LH, Jin YL. Effects of polycyclic aromatic hydrocarbon exposure on DNA methylation[J]. J Med Res, 2014, 43(9): 152–155. |
| [17] | Alegría-Torres JA, Barretta F, Batres-Esquivel LE, et al. Epigenetic markers of exposure to polycyclic aromatic hydrocarbons in Mexican brickmakers:a pilot study[J]. Chemosphere, 2013, 91(4): 475–480. DOI:10.1016/j.chemosphere.2012.11.077 |
| [18] |
李新, 张红梅, 杨瑾, 等.
焦炉工人周围血细胞p16基因甲基化研究[J]. 中国职业医学, 2012, 39(2): 111–114.
Li X, Zhang HM, Yang J, et al. Study on p16 gene methylation in peripheral blood cells of coke oven workers[J]. Chin Occup Med, 2012, 39(2): 111–114. |
| [19] | Mamun AAMA. Elevated expression of DNA polymerase Ⅱ increases spontaneous mutagenesis in Escherichia coli[J]. Mutat Res, 2007, 625(1/2): 29–39. DOI:10.1016/j.mrfmmm.2007.05.002 |
| [20] |
邓雯文, 杨沫, 张遵真, 等.
苯并[α]芘诱导的细胞恶性转化对DNA甲基化转移酶的影响[J]. 卫生研究, 2013, 42(6): 915–919, 924.
Deng WW, Yang M, Zhang ZZ, et al. Effects of cell malignant transformation induced by benzo[α]pyrene on DNA methylation transferases[J]. J Hyg Res, 2013, 42(6): 915–919, 924. |
| [21] | Wang JT, Ding L, Jiang SW, et al. Folate deficiency and aberrant expression of DNA methyltransferase 1 were associated with cervical cancerization[J]. Curr Pharm Des, 2014, 20(11): 1639–1646. DOI:10.2174/13816128113199990543 |
 2017, Vol. 38
2017, Vol. 38