文章信息
- 王雪飞, 史晓红, 许喜喜, 杨志清, 郝海昀, 张芳, 王斌, 温海秀, 付振东, 王婷, 丰淑英, 汪波, 王素萍.
- Wang Xuefei, Shi Xiaohong, Xu Xixi, Yang Zhiqing, Hao Haiyun, Zhang Fang, Wang Bin, Wen Haixiu, Fu Zhendong, Wang Ting, Feng Shuying, Wang Bo, Wang Suping.
- 白介素-6和白介素-12在HBsAg阳性母亲婴儿乙肝疫苗免疫应答中的作用
- Effect of interleukin-6 and interleukin-12 on immune response to hepatitis B vaccination in infants of HBsAg-positive mothers
- 中华流行病学杂志, 2017, 38(7): 950-953
- Chinese journal of Epidemiology, 2017, 38(7): 950-953
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2017.07.020
-
文章历史
收稿日期: 2016-12-13
2. 030001 太原市第三人民医院妇产科
2. Department of Obstetrics and Gynaecology, The Third People Hospital of Taiyuan, Taiyuan 030001, China
HBV感染是全球重大的公共卫生问题,每年有超过68.6万人死于乙型肝炎(乙肝)并发症,包括肝硬化和肝癌[1]。乙肝疫苗及高效价免疫球蛋白(HBIG)的普及是预防HBV传播的重要措施,但HBsAg阳性母亲婴儿的乙肝疫苗无/弱应答率仍高达30%~50%,远高于一般人群[2-3],是HBV的易感人群,且80%~90%在1岁前感染HBV的婴儿将会发展成慢性感染[4]。乙肝疫苗触发机体产生保护性抗体需要辅助T细胞(Th细胞)的活化及Thl/Th2型细胞因子的协调分泌[5]。白介素-6(IL-6)是机体免疫调节网络中的关键因子,可促进B细胞的增殖和分化;白介素-12(IL-12)是重要的Th1型细胞因子,可促进其他Th1型细胞因子分泌,抑制Th2型细胞因子IL-6等的合成。研究表明,Thl/Th2型细胞因子分泌水平改变是接种乙肝疫苗后发生无/弱应答的重要原因[5-7]。本研究通过观察HBsAg阳性母亲婴儿在主被动免疫前后的IL-6和IL-12表达水平及其变化,探讨IL-6和IL-12在乙肝疫苗免疫应答中的作用,为降低这一特殊人群的乙肝疫苗无/弱应答率提供理论依据。
对象与方法1.研究对象:选择2011年7月至2012年7月太原市第三人民医院妇产科HBsAg阳性孕妇足月分娩的新生儿91例作为研究对象,并对其随访至12月龄。纳入标准:① 新生儿足月产者(孕周为37~42周);② 新生儿体重正常者(2.5~4.0 kg)。排除标准:从出生至12月龄间曾患有感染性疾病者。根据我国免疫接种程序,新生儿出生后24 h内接种10 μg重组乙肝疫苗[中国仓鼠卵巢细胞(CHO细胞)]及注射200 IU HBIG,并于1月龄及6月龄时分别接种第2、3针重组乙肝疫苗。本研究经山西医科大学伦理委员会批准,所有研究对象均签署知情同意书。
2.研究方法:
(1)基线及随访资料:采用面对面的调查方法,由经过培训的专业人员及妇产科的护士通过标准统一的问卷进行调查,部分信息从医院病历中查询并记录。收集新生儿的人口学特征、分娩方式等,以及婴儿喂养方式、是否患感染性疾病等资料。
采集新生儿出生后24 h内主、被动免疫前的股静脉血3 ml(新生儿期),以及12月龄时的肘静脉血3 ml(婴儿期),分离血清,于-80 ℃冰箱中冷藏备检。
(2)实验室检测:采用化学发光免疫试验(chemiluminescence immunoassay,CLIA)检测新生儿的5项HBV血清学标志物和婴儿的抗-HBs;采用荧光定量聚合酶链反应(fluorescent quantitation polymerase chain reaction,FQ-PCR)检测新生儿和婴儿外周血HBV DNA载量,HBV DNA载量>1×103拷贝/ml判断为阳性;采用ELISA检测新生儿及婴儿外周血IL-6和IL-12水平。
(3)HBV宫内传播及乙肝疫苗免疫应答判定标准:新生儿出生后24 h内,主、被动免疫前股静脉血HBsAg阳性和/或HBV DNA>1×103拷贝/ml者判为HBV宫内传播[8];婴儿血清抗-HBs<10 mIU/ml为乙肝疫苗免疫无应答;10 mIU/ml≤抗-HBs<100 mIU/ml为乙肝疫苗免疫弱应答;100 mIU/ml≤抗-HBs为乙肝疫苗免疫强应答[9]。
(4)统计学分析:采用SAS 9.2软件对数据进行整理和分析,定量数据描述采用M(QR)表示;定性资料分析采用χ2检验;两组定量资料差异分析采用Wilcoxon秩和检验,相关性分析采用Spearman秩相关检验。P<0.05为差异有统计学意义。
结果1.一般情况:共收集91例HBsAg阳性孕妇分娩的新生儿,并在其进行全程免疫接种后随访至12月龄。新生儿男女比例为1.12 : 1;44例为阴道产(48.35%);有26例为母乳喂养(28.57%),50例为人工喂养(54.95%),15例为混合喂养(16.48%)。新生儿发生宫内传播者16例,占17.58%;外周血HBeAg阳性者41例(45.05%)。婴儿乙肝疫苗强应答者共59例;无/弱应答者32例,占35.16%。以婴儿乙肝疫苗应答情况分为无/弱应答组和强应答组,其中性别、分娩方式、喂养方式、新生儿HBeAg及是否发生宫内传播在两组间分布差异无统计学意义(均P>0.05),即两组间基本特征均衡可比,见表 1。
2.乙肝疫苗无/弱应答组和强应答组新生儿期及婴儿期的IL-6和IL-12的水平:分析两组间IL-6和IL-12在新生儿期及婴儿期的分泌水平显示,两组间无论是新生儿期还是婴儿期,其IL-6和IL-12的水平差异均具有统计学意义(均P<0.01),无/弱应答组在新生儿期和婴儿期IL-6水平均低于强应答组;而IL-12水平均高于强应答组。见表 2。
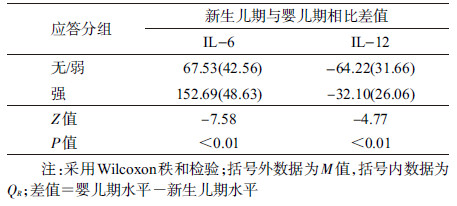
3.乙肝疫苗无/弱应答组和强应答组新生儿期与婴儿期IL-6和IL-12的变化:进一步分析两组从新生儿期到婴儿期IL-6和IL-12的变化可知,无/弱应答组及强应答组IL-6水平均升高,而IL-12水平均降低,两组间从新生儿期到婴儿期IL-6和IL-12的变化差异均有统计学意义(均P<0.01),即强应答组IL-6水平升高较多,而IL-12水平降低较少,提示IL-6及IL-12在乙肝疫苗免疫应答中具有一定的作用。见表 3。
4. IL-6和IL-12与婴儿抗-HBs的相关性分析:进一步采用Spearman秩相关检验对IL-6及IL-12与婴儿抗-HBs的相关性进行分析显示,婴儿抗-HBs水平与新生儿期及婴儿期IL-6和IL-12均具有强相关性,其中,婴儿抗-HBs水平与IL-6呈正相关(rs=0.70、0.79,均P<0.01);婴儿抗-HBs水平与IL-12呈负相关(rs-0.71、-0.72,均P<0.01)。同时,发现婴儿抗-HBs水平与IL-6和IL-12从新生儿期到婴儿期的变化也存在强相关性,IL-6升高程度与婴儿抗-HBs水平存在正相关(rs-0.74,P<0.01),IL-12的降低程度与婴儿抗-HBs水平存在负相关(rs-0.42,P<0.01)。
5. IL-6与IL-12间的相关性分析:对IL-6与IL-12间的相关性进行分析显示,新生儿期和婴儿期IL-6与IL-12均呈现显著的负相关(rs -0.68、-0.70,均P<0.01),提示IL-6与IL-12间可能存在一定的相互作用。
讨论国内目前使用的乙肝疫苗在一般人群中免疫后的保护率达到90%~95%以上,但在HBsAg阳性母亲婴儿中,免疫后的保护率仍有待提高。本研究中,HBsAg阳性母亲婴儿全程接种乙肝疫苗后,无/弱应答率为35.16%,与国内报道的30%~50%一致[2-3]。因此,进一步提高HBsAg阳性母亲婴儿的免疫应答是阻断HBV传播的重要途径。
国内外研究表明,在乙肝疫苗中加入一定量的佐剂可促进乙肝疫苗免疫应答,目前的研究集中于Toll样受体(TLRs)[10-11],而以细胞因子为佐剂研究较少。HBsAg是严格的胸腺依赖性抗原(TD-Ag),可促进B细胞活化、增殖和分化为抗体分泌性浆细胞和记忆性B细胞,而该过程需要Th细胞活化以及Th1/Th2型细胞因子的协调分泌[12]。有研究表明,Th1/Th2型细胞因子分泌水平改变是接种乙肝疫苗后发生无/弱应答的重要原因[5-7],IL-6是重要的Th2型细胞因子,可促进B细胞增殖分化并产生抗体[13]。本研究结果显示,无论是在免疫前还是在全程免疫后,体内IL-6水平均为强应答组高于无/弱应答组,且IL-6水平均与婴儿体内抗-HBs水平呈正相关,与孔令斌等[14]的研究结果相同,提示IL-6可促进机体抗-HBs的分泌,提高机体对乙肝疫苗的免疫应答。
IL-12在介导细胞免疫中起关键作用,能促进Th0细胞分化为Th1细胞,影响B细胞的活化及抗体产生[15-16]。而在免疫前后,强应答组婴儿IL-12水平均低于无/弱应答组,且IL-12水平均与婴儿体内抗-HBs水平呈负相关关系。有研究报道,在体外实验中,经HBsAg刺激后,强应答组的Th1型细胞因子水平高于无/弱应答组[7],与本研究结论不一致,可能是体内和体外环境下细胞对外来刺激产生了不同的反应所致,需进一步研究证实。
IL-12可促进Th1型细胞因子IL-2和IFN-γ的分泌,同时抑制Th2型细胞因子IL-4和IL-6等的合成。另有研究报道,IL-6可直接或间接地影响IL-12的产生及其下游信号通路的活化[17],提示IL-6与IL-12间可能存在某种相互关系,而本研究结果也显示,IL-6可能会抑制IL-12的分泌而呈负相关。此外,强应答组IL-6水平在新生儿期及婴儿期均高于无/弱应答组,而IL-12水平均低于无/弱应答组;在乙肝疫苗免疫后,两组IL-6水平均上升,IL-12水平均有所降低,且强应答组相比无/弱应答组IL-6水平上升更高。提示新生儿高IL-6水平下,乙肝疫苗的免疫应答可能会更强,而激活的免疫细胞又进一步增加IL-6分泌,抑制IL-12的分泌,以此达到更好的免疫效果。
有研究表明HBV宫内传播可能是乙肝疫苗无应答的影响因素,但本研究中尚未发现HBV宫内传播与乙肝疫苗无/弱应答有关,且以HBV宫内传播分层分析IL-6和IL-12与乙肝疫苗无/弱应答的关系时,结果与未分层分析时基本一致(数据未列出),可能与本研究中样本量较少有关,需待进一步扩大样本量后进行深入研究。
综上所述,IL-6与IL-12在HBsAg阳性母亲的婴儿的乙肝疫苗免疫应答中可能分别起着正、负调控作用,共同影响HBsAg阳性母亲的婴儿的免疫应答。对于HBsAg阳性母亲婴儿发生无/弱应答者,适当的提高其IL-6水平可能对其产生抗体的能力有积极作用,因此,可考虑将IL-6作为乙肝疫苗佐剂,为提高乙肝疫苗免疫应答提供新的研究思路。
利益冲突: 无
| [1] | GBD 2013 Mortality and Causes of Death Collaborators. Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013:a systematic analysis for the Global Burden of Disease Study 2013[J]. Lancet, 2015, 385(9963): 117–171. DOI:10.1016/S0140-6736(14)61682-2 |
| [2] | Bracciale L, Fabbiani M, Sansoni A, et al. Impact of hepatitis B vaccination in children born to HBsAg-positive mothers:a 20-year retrospective study[J]. Infection, 2009, 37(4): 340–343. DOI:10.1007/s15010-008-8252-3 |
| [3] |
陈红, 李瑛, 刘晓红.
乙肝疫苗对乙肝病毒携带者子女的免疫效应[J]. 中国妇幼健康研究, 2008, 19(6): 555–557.
Chen H, Li Y, Liu XH. Immunological effect of hepatitis B vaccine on infant whose mother was hepatitis B virus carrier[J]. Chin J Woman Child Health Res, 2008, 19(6): 555–557. DOI:10.3969/j.issn.1673-5293.2008.06.011 |
| [4] | Cardoso AC, Carvalho-Filho RJ, Stern C, et al. Direct comparison of diagnostic performance of transient elastography in patients with chronic hepatitis B and chronic hepatitis C[J]. Liver Int, 2012, 32(4): 612–621. DOI:10.1111/j.1478-3231.2011.02660.x |
| [5] | Velu V, Saravanan S, Nandakumar S, et al. Relationship between T-lymphocyte cytokine levels and sero-response to hepatitis B vaccines[J]. World J Gastroenterol, 2008, 14(22): 3534–3540. DOI:10.3748/wjg.14.3534 |
| [6] | Vingerhoets J, Vanham G, Kestens L, et al. Deficient T-cell responses in non-responders to hepatitis B vaccination:absence of TH1 cytokine production[J]. Immunol Lett, 1994, 39(2): 163–168. DOI:10.1016/0165-2478(94)90102-3 |
| [7] | Jafarzadeh A, Shokri F. The antibody response to HBs antigen is regulated by coordinated Th1 and Th2 cytokine production in healthy neonates[J]. Clin Exp Immunol, 2003, 131(3): 451–456. DOI:10.1046/j.1365-2249.2003.02093.x |
| [8] | Zou H, Chen Y, Duan Z, et al. Virologic factors associated with failure to passive-active immunoprophylaxis in infants born to HBsAg-positive mothers[J]. J Viral Hepat, 2012, 19(2): e18–25. DOI:10.1111/j.1365-2893.2011.01492.x |
| [9] | Mast EE, Weinbaum CM, Fiore AE, et al. A comprehensive immunization strategy to eliminate transmission of hepatitis B virus infection in the United States:recommendations of the Advisory Committee on Immunization Practices (ACIP) Part Ⅱ:immunization of adults[J]. MMWR Recomm Rep, 2006, 55(RR-16): 1–33; quiz CE31-34. |
| [10] | Mata-Haro V, Cekic C, Martin M, et al. The vaccine adjuvant monophosphoryl lipid A as a TRIF-biased agonist of TLR4[J]. Science, 2007, 316(5831): 1628–1632. DOI:10.1126/science.1138963 |
| [11] | Pantel A, Cheong C, Dandamudi D, et al. A new synthetic TLR4 agonist, GLA, allows dendritic cells targeted with antigen to elicit Th1 T-cell immunity in vivo[J]. Eur J Immunol, 2012, 42(1): 101–109. DOI:10.1002/eji.201141855 |
| [12] | Crotty S. A brief history of T cell help to B cells[J]. Nat Rev Immunol, 2015, 15(3): 185–189. DOI:10.1038/nri3803 |
| [13] | Romagnani S. The Th1/Th2 paradigm[J]. Immunol Today, 1997, 18(6): 263–266. DOI:10.1016/S0167-5699(97)80019-9 |
| [14] |
孔令斌, 安锐, 林立, 等.
乙肝疫苗接种后无弱应答者发生的分子生物学机制[J]. 济宁医学院学报:英文版, 2007, 30(1): 13–16.
Kong LB, An R, Lin L, et al. Study on molecular biology mechanism of non-and-hyporesponder after hepatitis B vaccination[J]. J Jining Med Coll:Engl ed, 2007, 30(1): 13–16. DOI:10.3969/j.issn.1000-9760.2007.01.003 |
| [15] | Watford WT, Moriguchi M, Morinobu A, et al. The biology of IL-12:coordinating innate and adaptive immune responses[J]. Cytokine Growth Factor Rev, 2003, 14(5): 361–368. DOI:10.1016/S1359-6101(03)00043-1 |
| [16] | Trinchieri G. Interleukin-12 and the regulation of innate resistance and adaptive immunity[J]. Nat Rev Immunol, 2003, 3(2): 133–146. DOI:10.1038/nri1001 |
| [17] | Tamburini BA, Kedl RM, Bellgrau D. IL-6-inducing whole yeast-based immunotherapy directly controls IL-12-dependent CD8 T-cell responses[J]. J Immunother, 2012, 35(1): 14–22. DOI:10.1097/CJI.0b013e3182356888 |
 2017, Vol. 38
2017, Vol. 38