文章信息
- 韩志刚, 吴昊, 梁彩云, 高凯, 麦惠霞, 蔡衍珊, 徐慧芳.
- Han Zhigang, Wu Hao, Liang Caiyun, Gao Kai, Mai Huixia, Cai Yanshan, Xu Huifang.
- 广州市2008-2010年和2015年外籍HIV-1感染者病毒亚型分析
- Bibliometric analysis on relations between cardiovascular disease and erectile dysfunction
- 中华流行病学杂志, 2017, 38(6): 805-809
- Chinese Journal of Epidemiology, 2017, 38(6): 805-809
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2017.06.023
-
文章历史
收稿日期: 2016-11-07
2. 510440 广州市疾病预防控制中心艾滋病预防控制部
2. Guangzhou Center for Disease Control and Prevention, Guangzhou 510440, China
2015年底全球存活的HIV /AIDS病例有3 670万,与1999年估计的2 620万相比增加了40.1%;非洲和东南亚地区是HIV/AIDS流行最严重的地区[1]。病例报告数据显示,2003-2013年我国广州市外籍HIV/AIDS病例数呈上升趋势,近51%来自病毒亚型分布多样的非洲地区。为了解广州市外籍HIV-1感染者中病毒亚型分布特征,对2008-2010年新诊断的外籍HIV-1感染者进行分子流行病学研究;为进一步了解该人群最新的亚型分布情况,本研究对2015年新诊断的外籍HIV-1感染者再次进行分子流行病学研究。
材料与方法1.研究样本:2008-2010年和2015年经广州市CDC新确证的全部外籍(不包括港澳台地区)HIV-1抗体阳性者的血清样本。其中未能获得目的基因序列片段的样本不纳入本研究。
2. HIV-1抗体检测和RNA提取:所有样本均经初筛实验ELISA法,北京华大吉比爱生物技术有限公司和上海梅里埃生物工程有限公司和确证实验WB法,HIV Blot 2.2,MP生物医学亚太私人有限公司证实为HIV-1抗体阳性。按照Qiagen公司的QIAamp Vrial RNA Mini Kit说明书,从病例血清样本中提取病毒RNA,-80 ℃保存。
3.基因片段的扩增:采用巢式PCR法扩增目的基因,第一轮扩增反应采用一步法RT-PCR(PrimeScriptTM One Step RT-PCR Kit,大连宝生物公司),以所提取的RNA为模板。第二轮PCR(TaKaRa Ex Taq,大连宝生物公司)扩增反应以第一轮扩增产物为模板,扩增HIV-1 pol区部分基因片段,序列长度为1 578 bp,包括全部蛋白酶(PR)和部分反转录酶(RT)基因(对应HXB2基因组的2 244~3 821位点)。PCR引物参见文献[2-3],反应条件参照试剂说明书。
4.序列测定及比对:PCR产物经1%琼脂糖凝胶电泳鉴定无误后,交测序公司进行序列测定。使用Chromas 1.7.6软件将样本测得的四段重叠的pol区序列片段进行编辑、校正,最终拼接成一条序列。使用Mega 6.06软件中的Align by Muscle(Codons)方法将拼接好的样本序列与从美国Los Alamos实验室HIV核酸序列库下载的国际参考序列进行比对[4],建立数据集用于构建系统进化树。
5.样本亚型的确定:使用FastTree 2.1.8软件,基于GTR+CAT替代模型构建最大似然法(Maximum-likelihood,ML)系统进化树。为了使结果更加准确,设置子树修剪再接(SPR)为4[5]。根据样本序列与国际参考序列在进化树上的拓扑关系确定样本的亚型。对于拓扑关系不明确或怀疑有重组的样本,使用RIP软件查看重组情况,并与美国Los Alamos实验室HIV核酸序列库中HIV-1流行重组模式对比确定样本的亚型[6]。
6.耐药分析:应用斯坦福大学HIV耐药数据库提供的耐药序列分析软件HIVdb Program对整理好的样本序列进行分析[7],根据程序的评分结果确定样本对蛋白酶抑制剂(PIs)和反转录酶抑制剂(RTIs)是否耐药。
7.与本地样本流行关系分析:选择与广州市本地主要流行亚型相同的外籍感染者样本,与其来源地区及广州市本地的相同亚型样本一起,使用上述方法构建系统进化树。
8.统计学分析:应用SPSS 21.0软件进行统计学分析,计量数据比较采用方差分析,各项构成比的比较使用χ2检验,当有理论频数<5时,采用蒙特卡罗模拟方法计算确切概率及P值的99%CI,P<0.05为差异有统计学意义。
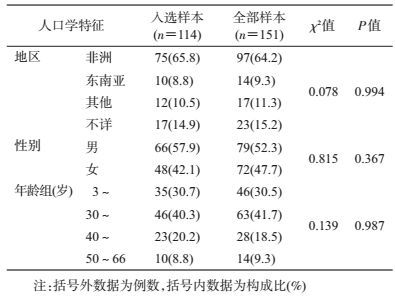
结果1.样本的代表性:本研究从广州市2008-2010年报告和2015年新确诊的外籍HIV-1感染者151份血清样本中成功获得114份样本的pol区基因片段。纳入研究的样本占全部样本的75.5%(114/151),入选样本与全部样本在人口学特征构成间差异无统计学意义。见表 1。
2.样本特征:男性占57.9%,女性占42.1%;年龄最小3岁,最大66岁,平均年龄(35.21±9.63)岁;主要来自非洲地区,占64.2%;传播途径不详占73.7%,其次为异性传播占21.0%。不同年份样本的性别、年龄组、来源地区构成间差异无统计学意义。
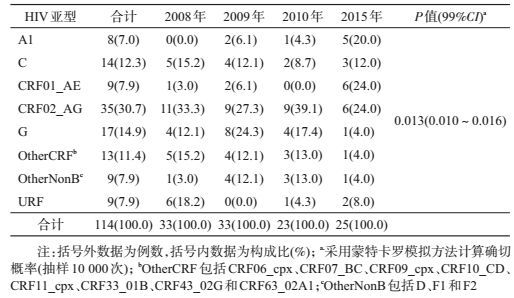
3.不同年度样本病毒亚型分布:114份HIV-1样本均为M组的非B亚型和流行重组模式(CRF),构成前三位的为CRF02_AG重组型、G亚型和C亚型,分别占30.7%、14.9%和12.3%。与2008-2010年样本相比,2015年样本中A1亚型和CRF01_AE重组型的构成比上升(P=0.013,99%CI:0.010~0.016)。见表 2。
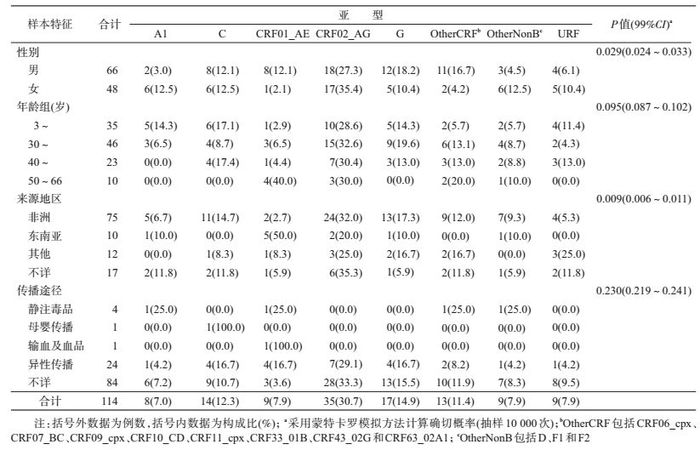
4.不同特征样本病毒亚型分布:男性中CRF01_AE、和G亚型的比例高于女性,而女性中A1亚型、CRF02_AG和URF比例高于男性(P=0.029,99%CI:0.024~0.033)。来自非洲地区感染者中CRF02_AG和G的构成比高于来自东南亚和其他地区的感染者,而来自东南亚地区感染者中CRF01_AE的构成比高于来自非洲和其他地区的感染者(P=0.009,99%CI:0.006~0.011)。各年龄组和传播途径间样本亚型分布差异无统计学意义。见表 3。
5.耐药分析:对任意一种PIs和RTIs耐药的比例为21.9%(25/114);其中CRF02_AG最高,为28.6%(10/35);其次是A1和G,分别为25.0%(2/8)和23.5%(4/17);CRF01_AE未发现耐药。对PIs的耐药率为12.3%(14/114);其中CRF02_AG最高,为25.7%(10/35);其次是C和G,分别为7.1%(1/14)和5.9%(1/17)。14例对PIs耐药的样本中,全部对NFV/r耐药,1例对除DRV/r以外的所有PIs耐药。对核苷类RTIs(NRTIs)的耐药率为6.1%(7/114);其中G最高,为17.6%(3/17);其次是C,为7.1%(1/14)。对非核苷类RTIs(NNRTIs)的耐药率为7.0%(8/114);其中A1最高,为25.0%(2/8);其次为G和CRF02_AG,分别为11.8%(2/17)和2.9%(1/35)。
6.与本地样本进化关系分析:本研究在外籍感染者中发现9例CRF01_AE,多数来自东南亚地区感染者中。由于CRF01_AE也是广州地区主要的HIV-1流行毒株之一,将其与东南亚CRF01_AE样本进行了进化关系分析。其中1份外籍样本与本地样本在进化树上关系密切(bootstrap=0.855),其他8份与来自泰国的样本相关。见图 1。

|
| 图 1 2008-2010年和2015年我国广州市外籍HIV-1感染者CRF01_AE样本与本地及东南亚地区CRF01_AE样本的系统进化树 |
HIV-1在全球广泛传播的最重要因素之一,是其极大的遗传变异性和快速进化[8]。流行最广泛的HIV-1 M组在传播过程中形成9个不同亚型(A~D,F~H,J和K)和若干流行重组模式(CRFs),并在全球不同地区形成了较为稳定的差异性分布[9-10]。这种基因多样性对疾病进展和传播、诊断和病毒载量测定、抗病毒治疗和耐药、免疫反应与疫苗开发等各方面有着深远影响[11]。
前期研究显示,广州市本地HIV-1感染者中主要流行亚型为CRF01_AE重组型、CRF07_BC重组型、CRF08_BC重组型和B亚型[12-13]。本研究结果显示,广州市外籍HIV-1感染者中主要流行亚型为CRF02_AG重组型、G亚型和C亚型,与本地感染者的亚型明显不同,提示广州市外籍感染者以输入性病例为主。但是,本研究也发现1份外籍样本与本地样本在进化树上密切相关,提示少数外籍感染者可能与本地病例存在直接或间接的流行病学关联。
此外,广州市外籍HIV-1感染者中,也存在多个流行重组型(CRFs)和独特重组型(URFs),呈现多样化的特点,且不同来源地区间样本亚型分布存在差异。这可能与本研究中大部分的外籍感染者来源地区为非洲有关。分子流行病学资料显示,在非洲中部HIV-1高度多样化,A、C、CRF02_AG和D约占新发感染的85%;在非洲地区东部主要为A和D;在非洲地区南部主要为C;在非洲地区西部为A、G、CRF02_AG和CRF06_cpx[14];在东南亚地区主要为CRF01_AE[10]。本研究中来自非洲地区的外籍感染者HIV-1亚型分布地区差异和多样性与文献报道相符。遗憾的是,本文限于样本中传播途径不详的比例较高,无法揭示不同传播途径的亚型分布特征。
研究显示,我国接受治疗感染者耐药率为19.2%(543/2 826),PIs、NRTIs和NNRTIs耐药率分别为0.5%(15/2 826)、11.0%(311/2 826)和18.5(522/2 826)[15];未接受治疗感染者耐药率为6.7%(32/478),PIs、NRTIs和NNRTIs耐药率分别为2.7%(13/478)、2.5%(12/478)和2.3%(11/478)[16]。广州市外籍感染者耐药率显著高于我国未接受治疗感染者(χ2=24.554,P=0.000),与我国接受治疗感染者耐药率差异无统计学意义(χ2=0.518,P=0.472)。本研究中外籍感染者PIs耐药率显著高于我国接受治疗感染者(χ2=143.104,P=0.000)。尽管外籍感染者对PIs耐药集中于NFV/r,与我国接受治疗感染者相比NNRTIs耐药率较低(χ2=9.728,P=0.002),NRTIs耐药率差异无统计学意义(χ2=2.688,P=0.101),但耐药传播的风险不容忽视,尤其是发现存在7例耐多药感染者。
综上所述,外籍HIV-1感染者给我国广州市带来了不同于本地的流行亚型,其亚型多样性和较高的耐药率对控制HIV流行构成了挑战,增加了国外毒株本地化和耐药毒株传播的风险,应加强外籍HIV-1感染者的随访管理和行为干预。
利益冲突: 无
| [1] | UNAIDS. AIDS by the numbers-AIDS is not over, but it can be[EB/OL]. Geneva:UNAIDS.(2016-11-01)[2016-11-06]. http://www.unaids.org/en/resources/documents/2016/AIDS-by-the-numbers. |
| [2] | Zhong P, Pan QC, Ning Z, et al. Genetic diversity and drug resistance of human immunodeficiency virus type 1(HIV-1) strains circulating in Shanghai[J]. AIDS Res Hum Retroviruses, 2007, 23(7): 847–856. DOI:10.1089/aid.2006.0196 |
| [3] | Han ZG, Leung TWC, Zhao JK, et al. A HIV-1 heterosexual transmission chain in Guangzhou, China:a molecular epidemiological study[J]. Virol J, 2009, 6: 148. DOI:10.1186/1743-422X-6-148 |
| [4] | Los Alamos National Laboratory. HIV sequence alignments[EB/OL]. (2016-09-18)[2016-11-06]. http://www.hiv.lanl.gov/content/sequence/NEWALIGN/align.html. |
| [5] | Price MN, Dehal PS, Arkin AP. FastTree 2-Approximately maximum-likelihood trees for large alignments[J]. PLoS One, 2010, 5(3): e9490. DOI:10.1371/journal.pone.0009490 |
| [6] | Los Alamos National Laboratory. HIV circulating recombinant forms (CRFs)[EB/OL]. (2016-09-19)[2016-11-06]. http://www.hiv.lanl.gov/content/sequence/HIV/CRFs/CRFs.html. |
| [7] | Rhee SY, Gonzales MJ, Kantor R, et al. Human immunodeficiency virus reverse transcriptase and protease sequence database[J]. Nucleic Acids Res, 2003, 31(1): 298–303. DOI:10.1093/nar/gkg100 |
| [8] | Baesi K, Moallemi S, Farrokhi M, et al. Subtype classification of iranian HIV-1 sequences registered in the HIV databases, 2006-2013[J]. PLoS One, 2014, 9(9): e105098. DOI:10.1371/journal.pone.0105098 |
| [9] | Jahanbakhsh F, Ibe S, Hattori J, et al. Molecular epidemiology of HIV type 1 infection in Iran:genomic evidence of CRF35_AD predominance and CRF01_AE infection among individuals associated with injection drug use[J]. AIDS Res Hum Retroviruses, 2013, 29(1): 198–203. DOI:10.1089/AID.2012.0186 |
| [10] | Hemelaar J, Gouws E, Ghys PD, et al. Global trends in molecular epidemiology of HIV-1 during 2000-2007[J]. AIDS, 2011, 25(5): 679–689. DOI:10.1097/QAD.0b013e328342ff93 |
| [11] | Hemelaar J. The origin and diversity of the HIV-1 pandemic[J]. Trends Mol Med, 2012, 18(3): 182–192. DOI:10.1016/j.molmed.2011.12.001 |
| [12] |
韩志刚, 邢辉, 徐慧芳, 等.
广州市2004-2005年HIV-1感染者亚型分析[J]. 中国艾滋病性病, 2008, 14(3): 232–234.
Han ZG, Xing H, Xu HF, et al. Molecular epidemiological study of HIV-1 positive individuals in Guangzhou from 2004 to 2005[J]. Chin J AIDS STD, 2008, 14(3): 232–234. DOI:10.3969/j.issn.1672-5662.2008.03.007 |
| [13] |
韩志刚, 徐慧芳, 李燕, 等.
广州市男男性行为者HIV-1分子流行病学研究[J]. 中国艾滋病性病, 2009, 15(4): 381–384.
Han ZG, Xu HF, Li Y, et al. Molecular epidemiology of HIV-1 infection among MSM in Guangzhou[J]. Chin J AIDS STD, 2009, 15(4): 381–384. DOI:10.13419/j.cnki.aids.2009.04.018 |
| [14] | Lihana RW, Ssemwanga D, Abimiku A, et al. Update on HIV-1 diversity in Africa:a decade in review[J]. AIDS Rev, 2012, 14(2): 83–100. |
| [15] | Xing H, Ruan YH, Li JY, et al. HIV drug resistance and its impact on antiretroviral therapy in Chinese HIV-infected patients[J]. PLoS One, 2013, 8(2): e54917. DOI:10.1371/journal.pone.0054917 |
| [16] | Li HP, Chang S, Han Y, et al. The prevalence of drug resistance among treatment-naïve HIV-1-infected individuals in China during pre-and post-2004[J]. BMC Infect Dis, 2016, 16: 605. DOI:10.1186/s12879-016-1928-x |
 2017, Vol. 38
2017, Vol. 38