文章信息
- 缑琼英, 喻荣彬, 施瑞华.
- Gou Qiongying, Yu Rongbin, Shi Ruihua.
- 幽门螺旋杆菌药敏试验指导的治疗方案和新一线四联方案:网状Meta分析
- Drug susceptibility test guided therapy and novel empirical quadruple therapy for Helicobacter pylori infection: a network Meta-analysis
- 中华流行病学杂志, 2017, 38(5): 670-673
- Chinese Journal of Epidemiology, 2017, 38(5): 670-673
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2017.05.023
-
文章历史
收稿日期: 2016-10-09
2. 233100 安徽省凤阳县鼓楼医院消化内科;
3. 210029 南京, 东南大学医学院附属中大医院消化内科
2. Digestive Department, Drum Tower Hospital of Fengyang, Fengyang 233100, China;
3. Digestive Department, Affiliated Zhongda Hospital to Southeast University Medical School, Nanjing 210029, China
幽门螺旋杆菌(H. pylori)是消化性溃疡病及胃癌的主要致病因素。2000年佛罗伦萨共识提出H. pylori 7~14 d三联疗法[1-3],但由于对甲硝唑和克拉霉素的耐药[4-5],H. pylori根除率已下降。目前就H. pylori治疗策略,全球研究结论颇具争议,特别是最新的伴同疗法、混合治疗、序贯治疗、铋剂四联治疗方案。本研究通过网状Meta分析比较世界范围内细菌培养药敏试验指导的根除方案和以上4种方案的根除率和不良反应发生率,并进行单组率的Meta分析获得各方案绝对疗效和不良反应发生率。
资料与方法本次网状Meta分析严格按照PRISMA(the preferred reporting items for systematic reviews and Meta-analyses)声明[6]。
1.检索策略:系统检索万方数据库、中国科学引文数据库、Web of Science、PubMed、OVID中比较H. pylori细菌培养药敏试验指导的治疗及新四联方案的随机对照试验(RCT),截止日期为2015年6月。使用医学术语和主题词包括“幽门螺旋杆菌”、“药敏试验指导的治疗”、“伴同疗法”、“混合疗法”、“序贯治疗”、“铋剂四联治疗”,没有语言和时间的限制。
2.纳入标准:合格的RCT应满足PICOS标准。P:18岁的H. pylori阳性感染者,首次接受根除治疗;I:伴同疗法、混合治疗、标准的序贯方案、10 d的铋剂四联治疗均按照H. pylori标准治疗方案的剂量和细菌培养药敏试验指导的治疗(患者通过细菌培养诊断,接受标准三联治疗);C:序贯方案作为参照组;O:主要结局指标包括H. pylori ITT分析(the intention-to-treat analysis)根除率,根除证实至少在治疗结束后4周,次要结局指标为治疗方案的不良反应发生率;S:研究设计包括纳入网状Meta分析的研究均为RCT,全文发表于有同行评审的期刊。
3.文献数据提取及质量评价:2名研究者独立审阅合格的文献,抽提相关信息[患者基线资料、研究设计、所患疾病、干预措施(药物、剂量、疗程)、H. pylori感染和根除的诊断方法、随访周期、根除率、不良反应表现及发生率]。数据提取有分歧,由第三者解决。如果文献研究设计或结局指标相关信息不明确,通过电子邮件联系第一作者或通信作者。由2名研究者采用Jadad评分单独评价纳入文献的方法学质量。Jadad评分≥3分为高质量RCT,<3分为低质量。构建漏斗图定性测量纳入随机对照试验的发表偏倚,用Begg秩相关检验[7]或者Egger线性回归检验[8]评价漏斗图的不对称性。
4.统计学分析:发表偏倚用漏斗图法评价。纳入研究间的异质性评价采用I2指标,I2<50%定义为低度异质性,>50%为显著的异质性。对合格的RCT采用蒙特卡洛-马科夫链方法(ADDIS软件)进行网状Meta分析。网状Meta分析是基于多种成对的RCT在一个分析中整合直接和间接证据[9-10]。如果2种治疗方案之前并未经过比较,但有与同一个参照比较的研究,可间接比较这2种治疗方案的临床效果[11-12]。直接证据和间接证据间不一致性的评价,用环不一致性模型和节点拆分模型,节点拆分是将一种治疗方案的效应拆分为直接和间接证据[13]。计算H. pylori根除方案的疗效、不良反应排位概率。合并的效应值用OR值和95%CI表示。
结果1.纳入文献特征:共检索到2 615篇文献,经过标题、摘要初筛,排除2 595篇,最终20篇纳入分析,包括48组比较,6 753例接受根除治疗的感染者。纳入的RCT有6个3组的比较,其余为2组的比较。
在H. pylori根除率的比较网络中,1 827例(27.05%)感染者随机分配到10 d序贯治疗方案组,2 566例(37.99%)分配到伴同疗法组,1 346例(19.93%)分配到混合治疗组,478例(7.08%)分配到铋剂四联治疗方案组,536例(7.94%)分配到细菌培养药敏试验指导治疗组。通过单组率的Meta分析,合并的H. pylori绝对根除率(%):序贯治疗方案组为84.01(95%CI:80.48~88.15),伴同疗法组为86.05(95%CI:82.55~90.29),混合治疗组为87.27(95%CI:82.19~91.28),铋剂四联治疗方案组为85.51(95%CI:74.71~96.41),基于细菌培养药敏试验的治疗方案组为91.30(95%CI:87.57~95.13)。
不良反应发生率网络共纳入16个随机对照研究,包含37臂比较、5 143例感染者;其中1 528例(29.71%)感染者随机分配到10 d序贯治疗方案组,1 511例(29.38%)分配到伴同疗法组,1 476例(28.70%)分配到混合治疗组,128例(2.49%)分配到铋剂四联治疗方案组,500例(9.72%)分配到细菌培养药敏试验指导方案组。5种方案不良反应发生率的差异无统计学意义。单组率Meta分析显示,合并的绝对不良反应发生率(%):序贯治疗方案组为28.24(95%CI:19.91~36.13),伴同疗法组为33.23(95%CI:23.16~42.27),混合治疗组为21.03(95%CI:13.27~29.19),铋剂四联治疗组为8.51(95%CI:5.35~20.98),基于细菌培养药敏试验指导治疗组为19.03(95%CI:12.27~26.19)。
2.不同结局指标的网状Meta分析:各方案的根除率和不良反应发生率合并的OR值及95%CI见图 1。可见细菌培养药敏试验指导方案的根除率显著高于其他4种方案;混合治疗方案比序贯治疗更高效。此外,伴同疗法、混合治疗、铋剂四联及序贯方案的两两比较的差异无统计学意义。计算最优方案概率显示(图 2),细菌培养药敏试验指导方案有97.00%可能性成为最高效方案,其他依次排序为铋剂四联、伴同疗法、混合治疗和序贯治疗方案。

|
| 注:上、下三角形中的数据分别为不良反应和疗效的OR值(95%CI);黑体字为差异有统计学意义 图 1 5种H. pylori根除治疗方案临床疗效和安全性的网状Meta分析(OR值及95%CI) |
分析次要结局指标,以伴同疗法方案的不良反应发生率最高(79.00%),基于细菌培养药敏试验指导方案出现不良反应的概率最低,其次为铋剂四联治疗及混合治疗方案(图 2)。基于三角或四角环特异的不一致性模型检验,有一个环中发现显著的不一致性,节点拆分分析表明有2组比较存在明显的不一致性。
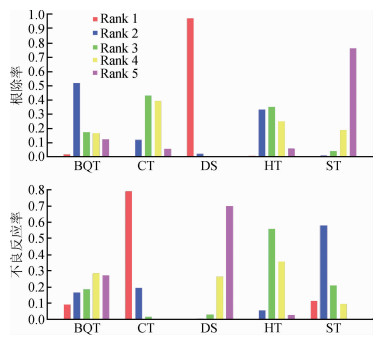
|
| 注:BQT:铋剂四联治疗;CT:伴同疗法;DS:细菌培养药敏试验指导治疗;HT:混合治疗;ST:序贯治疗;疗效从高到低排序依次为DS>BQT>CT>HT>ST;不良反应从低到高排序依次为DS<HT<BQT<ST<CT 图 2 5种H. pylori根除治疗方案临床疗效和安全性的排序 |
2010年北京地区H. pylori对克拉霉素、甲硝唑、左氧氟沙星耐药率分别为37.2%、63.9%、50.3%[14]。有研究显示治疗H. pylori感染的三联疗法根除率下降为57.5%~61.8%[15]。据最新报告[16],铋剂四联治疗和序贯治疗已推荐为临床一线方案。最近国际大型RCT和Meta分析显示,新一线治疗方案其疗效、不良反应差异较大。
本研究未发现伴同疗法显著优于序贯治疗方案,同其他研究结论一致[17-18],目前部分国家已推荐伴同疗法为临床治疗一线方案。序贯治疗方案对于耐克拉霉素的H. pylori菌株有良好的根除率。有研究报道[19],与标准三联疗法相比,序贯治疗方案有很高的ITT根除率(88.2%),而前者为79.1%。混合治疗方案对甲硝唑和克拉霉素双药耐药菌株有效。本文中混合治疗方案根除率显著高于序贯治疗方案,与其他研究不一致[20-22]。此外还提示铋剂四联治疗方案高效低风险。一项大型试验报道序贯治疗方案H. pylori初治根除率为89.4%,铋剂四联治疗方案为92.7%,但后者不良反应率明显高于前者(16.7%比8.1%)[23]。另一研究显示[24],纳入初治失败者,铋剂四联治疗方案ITT根除率为87.9%~95.2%,不良反应发生率为33.6%,与本文结果部分不一致。
本文网状Meta分析提示,纳入的研究中各项方案治疗根除率存在较大差异,如序贯治疗为70.0%~93.0%,伴同疗法为74.0%~94.0%,混合治疗为75.0%~97.0%,铋剂四联治疗为77.0%~94.0%,表现出洲际间的巨大差异。近来欧洲H. pylori研究组提供了2008-2009年H. pylori抗生素耐药率[25],其中克拉霉素、左氧氟沙星、甲硝唑总原发耐药率分别为17.5%、14.1%、34.9%,克拉霉素和甲硝唑联合耐药率为7.8%。本文中基于细菌培养药敏试验指导治疗方案的H. pylori根除率显著高于其他4种方案。
总之,本研究表明H. pylori感染根除治疗方案中,细菌培养药敏试验指导治疗的方案显著优于伴同疗法、混合治疗、铋剂四联治疗和序贯治疗方案,在医疗条件不足的地区可采用混合治疗和铋剂四联治疗方案。
利益冲突: 无
| [1] | Malfertheiner P, Megraud F, O'Morain C, et al. Current concepts in the management of Helicobacter pylori infection:The Maastricht Ⅲ Consensus Report[J]. Gut, 2007, 56(6): 772–781. DOI:10.1136/gut.2006.101634 |
| [2] | Vaz Coelho LG, León-Barúa R, Quigley EMM. Latin-American consensus conference on Helicobacter pylori infection Latin-American consensus conference on H. pylori[J]. Am J Gastroenterol, 2000, 95(10): 2688–2691. DOI:10.1111/j.1572-0241.2000.03174.x |
| [3] | Chey WD, Wong BCY, Practice Parameters Committee of the American College of Gastroenterology. American college of gastroenterology guideline on the management of Helicobacter pylori infection[J]. Am J Gastroenterol, 2007, 102(8): 1808–1825. DOI:10.1111/j.1572-0241.2007.01393.x |
| [4] | Meyer JM, Silliman NP, Wang WJ, et al. Risk factors for Helicobacter pylori resistance in the United States:the surveillance of H. pylori antimicrobial resistance partnership (SHARP) study, 1993-1999[J]. Ann Intern Med, 2002, 136(1): 13–24. DOI:10.7326/0003-4819-136-1-200201010-00008 |
| [5] | Hwang TJ, Kim N, Kim HB, et al. Change in antibiotic resistance of Helicobacter pylori strains and the effect of A2143G point mutation of 23S rRNA on the eradication of H. pylori in a single center of Korea[J]. J Clin Gastroenterol, 2010, 44(8): 536–543. DOI:10.1097/MCG.0b013e3181d04592 |
| [6] | Jansen JP, Fleurence R, Devine B, et al. Interpreting indirect treatment comparisons and network Meta-analysis for health-care decision making:report of the ISPOR task force on indirect treatment comparisons good research practices:part 1[J]. Value Health, 2011, 14(4): 417–428. DOI:10.1016/j.jval.2011.04.002 |
| [7] | Begg CB, Mazumdar M. Operating characteristics of a rank correlation test for publication bias[J]. Biometrics, 1994, 50(4): 1088–1101. DOI:10.2307/2533446 |
| [8] | Egger M, Smith DS, Schneider M, et al. Bias in Meta-analysis detected by a simple, graphical test[J]. BMJ, 1997, 315(7109): 629–634. DOI:10.1136/bmj.315.7109.629 |
| [9] | Higgins JPT, Green S. Cochrane Handbook for Systematic Reviews of Interventions Version 5.1.0[EB/OL]. http://www.cochane-handbook.org. |
| [10] | Lumley T. Network Meta-analysis for indirect treatment comparisons[J]. Stat Med, 2002, 21(16): 2313–2324. DOI:10.1002/sim.1201 |
| [11] | Bucher HC, Guyatt GH, Griffith LE, et al. The results of direct and indirect treatment comparisons in Meta-analysis of randomized controlled trials[J]. J Clin Epidemiol, 1997, 50(6): 683–691. DOI:10.1016/S0895-4356(97)00049-8 |
| [12] | Wells GA, Sultan SA, Chen L, et al. Indirect evidence:indirect treatment comparisons in Meta-analysis[R]. Ottawa, Canada:Canadian Agency for Drugs and Technologies in Health, 2009. |
| [13] | Dias S, Welton NJ, Caldwell DM, et al. Checking consistency in mixed treatment comparison Meta-analysis[J]. Stat Med, 2010, 29(7-8): 932–944. DOI:10.1002/sim.3767 |
| [14] | Gao W, Cheng H, Hu FL, et al. The evolution of Helicobacter pylori antibiotics resistance over 10 years in Beijing, China[J]. Helicobacter, 2010, 15(5): 460–466. DOI:10.1111/j.1523-5378.2010.00788.x |
| [15] | Chen MC, Lei WY, Lin JS, et al. Levofloxacin-Amoxicillin/Clavulanate-Rabeprazole versus a standard seven-day triple therapy for eradication of Helicobacter pylori infection[J]. Biomed Res Int, 2014: 158520. DOI:10.1155/2014/158520 |
| [16] | Malfertheiner P, Megraud F, O'Morain CA, et al. Management of Helicobacter pylori infection-the Maastricht Ⅳ/Florence consensus report[J]. Gut, 2012, 61: 646–664. DOI:10.1136/gutjnl-2012-302084 |
| [17] | Huang YK, Wu MC, Wang SS, et al. Lansoprazole-based sequential and concomitant therapy for the first-line Helicobacter pylori eradication[J]. J Dig Dis, 2012, 13(4): 232–238. DOI:10.1111/j.1751-2980.2012.00575.x |
| [18] | Gisbert JP, Calvet X. Update on non-bismuth quadruple (concomitant) therapy for eradication of Helicobacter pylori[J]. Clin Exp Gastroenterol, 2012, 5: 23–34. DOI:10.2147/CEG.S25419 |
| [19] | Nasa M, Choksey A, Phadke A, et al. Sequential therapy versus standard triple-drug therapy for Helicobacter pylori eradication:a randomized study[J]. Indian J Gastroenterol, 2013, 32(6): 392–396. DOI:10.1007/s12664-013-0357-7 |
| [20] | Hsu PI, Wu DC, Wu JY, et al. Modified sequential Helicobacter pylori therapy:proton pump inhibitor and amoxicillin for 14 days with clarithromycin and metronidazole added as a quadruple (hybrid) therapy for the final 7 days[J]. Helicobacter, 2011, 16(2): 139–145. DOI:10.1111/j.1523-5378.2011.00828.x |
| [21] | Wu JY, Hsu PI, Wu DC, et al. Feasibility of shortening 14-day hybrid therapy while maintaining an excellent Helicobacter pylori eradication rate[J]. Helicobacter, 2014, 19(3): 207–213. DOI:10.1111/hel.12113 |
| [22] | Oh DH, Lee DH, Kang KK, et al. The efficacy of hybrid therapy as first-line regimen for Helicobacter pylori infection compared with sequential therapy[J]. J Gastroenterol Hepatol, 2014, 29(6): 1171–1176. DOI:10.1111/jgh.2014.29.issue-6 |
| [23] | Liu KS, Hung IF, Seto WK, et al. Ten day sequential versus 10 day modified bismuth quadruple therapy as empirical firstline and secondline treatment for Helicobacter pylori in Chinese patients:an open label, randomised, crossover trial[J]. Gut, 2013, 63(9): 1410–1415. DOI:10.1136/gutjnl-2013-306120 |
| [24] | Liang X, Xu XQ, Zheng Q, et al. Efficacy of bismuth-containing quadruple therapies for clarithromycin-, metronidazole-, and fluoroquinolone-resistant Helicobacter pylori infections in a prospective study[J]. Clin Gastroenterol Hepatol, 2013, 11(7): 802–807. DOI:10.1016/j.cgh.2013.01.008 |
| [25] | Megraud F, Coenen S, Versporten A, et al. Helicobacter pylori resistance to antibiotics in Europe and its relationship to antibiotic consumption[J]. Gut, 2013, 62(1): 34–42. DOI:10.1136/gutjnl-2012-302254 |
 2017, Vol. 38
2017, Vol. 38


