文章信息
- 朱立国, 姜洁, 宋词, 邹艳, 徐建芳, 刘红建, 彭红, 胡志斌, 朱凤才, 沈洪兵, 翟祥军 .
- Zhu Liguo, Jiang Jie, Song Ci, Zou Yan, Xu Jianfang, Liu Hongjian, Peng Hong, Hu Zhibin, Zhu Fengcai, Shen Hongbing, Zhai Xiangjun .
- 江苏省2012-2014年HBeAg阳性慢性HBV感染者HBeAg阴转的特征分析
- A cohort study on the epidemiological characteristics of HBeAg sero-clearance in HBeAg positive chronic hepatitis B patients in Jiangsu province from 2012 to 2014
- 中华流行病学杂志, 2017, 38(2): 179-184
- CHINESE JOURNAL OF EPIDEMIOLOGY, 2017, 38(2): 179-184
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2017.02.009
-
文章历史
收稿日期: 2016-08-09
2. 210029 南京医科大学公共卫生学院;
3. 210029 南京医科大学医药实验动物中心;
4. 215600 江苏省张家港市疾病预防控制中心防疫科;
5. 212310 丹阳市疾病预防控制中心防疫科;
6. 225400 泰兴市疾病预防控制中心重大专项执行办公室
2. School of Public Health, Nanjing Medical University, Nanjing 210029, China;
3. Animal Care Facility, Nanjing Medical University, Nanjing 210029, China;
4. Epidemic Prevention Section, Zhangjiagang City Center for Disease Control and Prevention, Zhangjiagang 215600, China;
5. Epidemic Prevention Section, Danyang City Center for Disease Control and Prevention, Danyang 212310, China;
6. Major Project Executive Office, Taixing City Center for Disease Control and Prevention, Taixing 225400, China
HBeAg阳性是慢性HBV感染者病毒复制的重要标志,HBeAg转阴或消失表示病毒复制已减少,预后相对良好[1],传染性降低。在无治疗状态下,部分感染者会发生HBeAg自然转阴[2]。HBeAg转阴也是当前各类抗病毒药物治疗追求的目标[3-4]。分析社区HBeAg阳性慢性HBV感染者HBeAg阴转的流行病学特征及其影响因素,可为慢性HBV感染者的规范治疗和科学管理提供依据。在国家科技重大专项等项目资助下,江苏省传染病防治示范区自2010年起建立了基于社区人群的慢性HBV感染者队列,并定期随访,现将其中HBeAg阳性慢性HBV感染者HBeAg阴转的流行病学特征报告如下。
对象与方法1. 研究对象:选择江苏省传染病防治示范区(江苏省经济、卫生和疾病流行水平不同的张家港市、丹阳市和泰兴市)为研究现场,建立江苏省传染病防治示范区社区慢性HBV感染者前瞻性队列,具体信息参见文献[5]。调查对象入选标准:2012年HBeAg阳性,排除2013年和2014年均未进行队列随访者、随访未满1年死亡者。2012年共有806例HBeAg阳性慢性HBV感染者,剔除85例(81例未参加2013年、2014年的调查,4例随访未满1年死亡)后,纳入721例HBeAg阳性慢性HBV感染者作为研究对象。调查对象在2012年的年龄、饮酒史、HBV DNA和ALT值定为基线值。
2. 研究内容:主要包括人口学特征、生活方式(饮酒史)、乙肝诊断治疗史(干扰素包括α-干扰素、聚乙二醇干扰素;核苷类药物包括拉米夫定、阿德福韦、替比夫定、恩替卡韦、替诺福韦)等信息。随访时,采集研究对象5 ml空腹静脉血。采用上海科华生物工程股份有限公司试剂盒,运用速率法检测ALT,其判断标准为<40 U/L。运用ELISA方法检测HBsAg、抗-HBe、HBeAg。运用PCR-荧光探针法检测HBV DNA,检测下限为100 IU/ml。参考《慢性乙型肝炎防治指南(2015年版)》[6]对HBeAg阴转进行判定:既往HBeAg阳性患者的HBeAg变成阴性。
3. 统计学分析:应用EpiData 3.1软件对流行病学资料和实验室数据进行录入和管理,资料分析采用SPSS 18.0软件。对性别、年龄、饮酒史、ALT、HBV DNA等基线数据和抗病毒治疗史与HBeAg阴转的关联分析采用单因素和多因素Cox比例风险模型,计算风险比值比(HR)及其95%CI;Cox分析风险模型的建立采用基于最大似然估计的向前逐步回归法,逐步回归分析模型变量入选的显著性水平为P<0.05,剔除标准为P>0.10。分析不同HBeAg转归分组者HBV DNA的变化趋势,通过重复测量数据方差分析计算,根据“球对称”假设检验结果,如果满足“球对称”假设,则采用未校正的F界值,如果不满足,用Greenhouse-Geisser方法对F界值进行校正[7]。全部统计学检验均为双侧检验,P<0.05为差异有统计学意义。
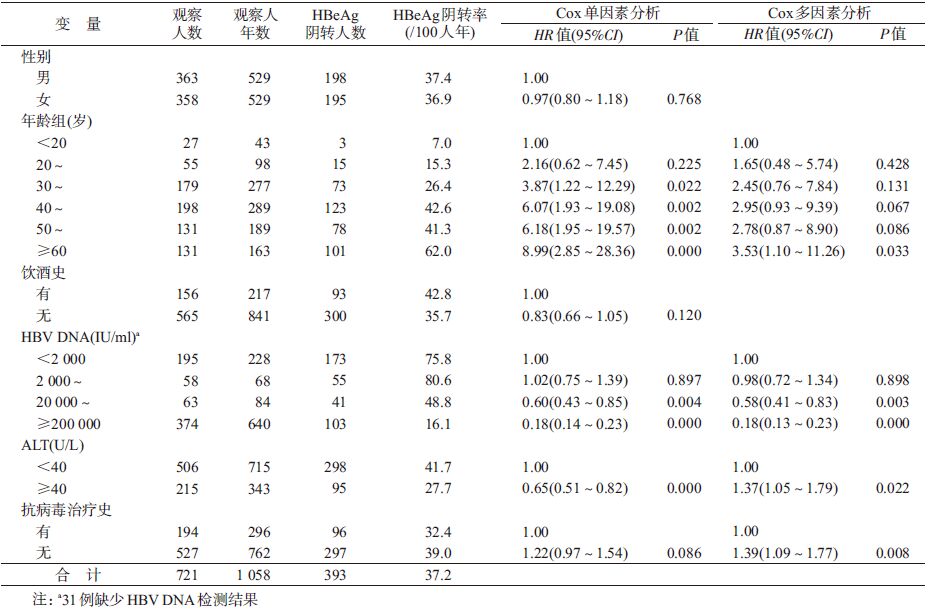
结 果1. 基本情况:2012年721例HBeAg阳性慢性HBV感染者,男性363例,占50.3%;2012年平均年龄(45.2±14.2)岁,<20、20~、30~、40~、50~和≥60岁对象分别占3.7%、7.6%、24.8%、27.5%、18.2%和18.2%;21.6%的研究对象有饮酒史;70.2%的研究对象ALT<40 U/L;HBV DNA(IU/ml)<2 000、2 000~、20 000~和≥200 000者分别占HBV携带者的27.0%、8.0%、8.7%和51.9%;26.9%的研究对象有抗病毒治疗史。
2. HBeAg阴转的特征及影响因素分析:2012年721例HBeAg阳性慢性HBV感染者随访到2014年时393例发生HBeAg阴转,累计HBeAg阴转率为54.5%,共观察1 058人年,HBeAg阴转率为37.2/100人年。HBeAg阴转率从<20岁组的7.0/100人年上升到≥60岁组的62.0/100人年。ALT<40 U/L的感染者HBeAg阴转率为41.7/100人年,高于ALT≥40 U/L者(27.7/100人年)。HBV DNA<2 000 IU/ml的感染者HBeAg阴转率为75.8/100人年,低于HBV DNA在2 000~19 999 IU/ml范围者(80.6/100人年),高于HBV DNA在20 000~199 999 IU/ml范围者(48.8/100人年)和≥200 000 IU/ml者(16.1/100人年)。有抗病毒治疗史的感染者HBeAg阴转率为32.4/100人年,无抗病毒治疗史的感染者HBeAg阴转率为39.0/100人年。
Cox单因素分析显示,相对于<20岁组,30~39岁组(HR=3.87,95%CI:1.22~12.29,P=0.022)、40~49岁组(HR=6.07,95%CI:1.93~19.08,P=0.002)、50~59岁组(HR=6.18,95%CI:1.95~19.57,P=0.002)、≥60岁组(HR=8.99,95%CI:2.85~28.36,P<0.001)感染者HBeAg阴转的可能性增加。相对于ALT<40 U/L的感染者,ALT≥40 U/L者的HBeAg阴转的可能性降低(HR=0.65,95%CI:0.51~0.82,P<0.001)。相对于HBV DNA<2 000 IU/ml者,HBV DNA为20 000~199 999 IU/ml范围(HR=0.60,95%CI:0.43~0.85,P=0.004)和≥200 000 IU/ml(HR=0.18,95%CI:0.14~0.23,P<0.001)的感染者HBeAg阴转的可能性降低。不同性别、饮酒史和抗病毒治疗史慢性HBV感染者HBeAg阴转率差异无统计学意义(P>0.05)。
Cox多因素分析显示,感染者的年龄、ALT、抗病毒治疗史和HBV DNA是发生HBeAg阴转的影响因素。相对于<20岁组,≥60岁年龄组的感染者HBeAg阴转的可能性增加(HR=3.53,95%CI:1.10~11.26,P=0.033);相对于ALT<40 U/L的感染者,ALT≥40 U/L者的HBeAg阴转可能性增加(HR=1.37,95%CI:1.05~1.79,P=0.022);相对于有抗病毒治疗史的感染者,无抗病毒治疗史者HBeAg阳性的可能性更大(HR=1.39,95%CI:1.09~1.77,P=0.008);相对于HBV DNA<2 000 IU/ml者,HBV DNA在20 000~199 999 IU/ml(HR=0.58,95%CI:0.41~0.83,P=0.003)范围和≥200 000 IU/ml(HR=0.18,95%CI:0.13~0.23,P<0.001)的感染者HBeAg阴转的可能性降低(表 1)。
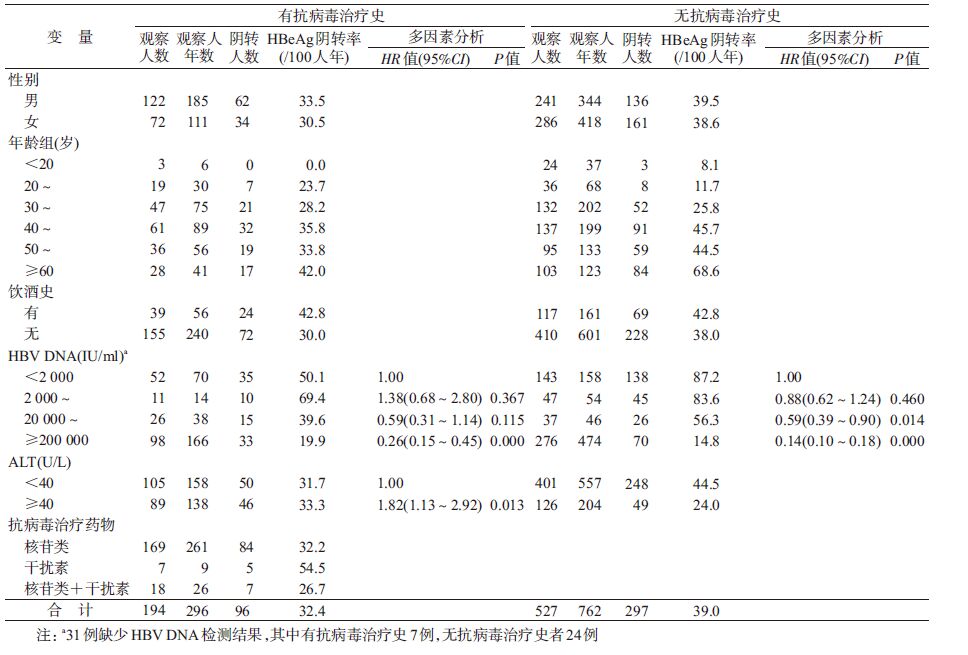
3. 不同抗病毒治疗史HBeAg阳性慢性HBV感染者HBeAg阴转特征分层分析:194例有抗病毒治疗史的HBeAg阳性慢性HBV感染者中,169例(87.1%)采用核苷类药物治疗,7例(3.6%)采用干扰素药物治疗,18例(9.3%)采用核苷类干扰素联合治疗,3种药物治疗后的HBeAg阴转率分别为32.2/100人年、54.5/100人年和26.7/100人年。Cox多因素分析显示,有抗病毒治疗史的HBeAg阳性慢性HBV感染者,ALT和HBV DNA是发生HBeAg阴转的影响因素。相对于ALT<40 U/L者,ALT≥40 U/L感染者的HBeAg阴转的可能性增加(HR=1.82,95%CI:1.13~2.92,P=0.013);相对于HBV DNA<2 000 IU/ml的感染者,HBV DNA≥200 000 IU/ml者HBeAg阴转的可能性降低(HR=0.26,95%CI:0.15~0.45,P<0.001)。
对527例无抗病毒治疗史的HBeAg阳性慢性HBV感染者,Cox多因素分析显示,HBV DNA是发生HBeAg阴转的影响因素。相对于HBV DNA<2 000 IU/ml者,HBV DNA在20 000~199 999 IU/ml范围(HR=0.59,95%CI:0.39~0.90,P=0.014)和≥200 000 IU/ml(HR=0.14,95%CI:0.10~0.18,P<0.001)的感染者HBeAg阴转的可能性降低(表 2)。
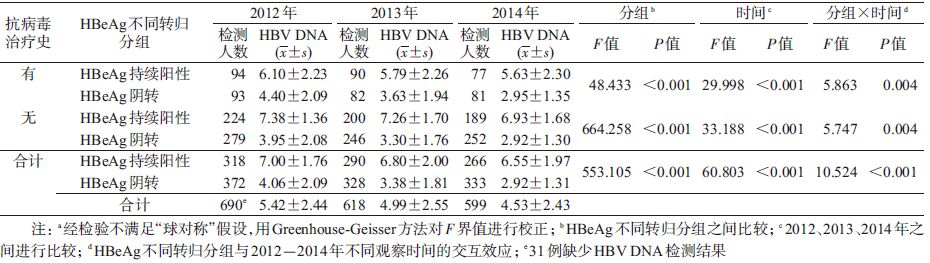
4. 不同HBeAg变化特征与HBV DNA变化趋势的关系分析:通过重复测量数据方差分析,不同HBeAg转归组间HBV DNA差异有统计学意义(F=10.524,P<0.001),提示在考虑了重复测量之后,两组间HBV DNA下降趋势不同,HBeAg阴转组的HBV DNA下降更快。按照亚组分析,结果显示,无论有无抗病毒治疗史,HBeAg阴转组的HBV DNA较HBeAg持续阳性组均下降更快(P<0.001)。见表 3。
103例基线HBV DNA≥200 000 IU/ml的HBeAg阴转者,2014年HBV DNA≥200 000 IU/ml者占16.1%。253例基线HBV DNA<20 000 IU/ml的感染者中,随访观察期间25例尚未发生HBeAg阴转(18例有抗病毒治疗史),其中5例在2012-2014年间HBV DNA检测值上升了1 log IU/ml以上(4例有抗病毒治疗史)。
讨 论在宿主免疫压力或抗病毒治疗下,HBeAg阳性感染者HBeAg阴转,减缓了患者肝脏的病损进程,同时降低了人群传播的风险,具有重要的公共卫生意义。本研究结果显示,721例HBeAg阳性慢性HBV感染者,随访1 058人年,发生HBeAg阴转393人,累计阴转率为54.5%,平均阴转率为37.2/100人年。对于HBeAg阳性慢性HBV感染者固定队列或定群,累计HBeAg阴转率受该队列分年龄段人口构成和各年龄段的HBeAg阴转率影响。本研究结果和既往研究结果显示[8-10],慢性HBV感染者中年长者的HBeAg阴转率较高,因而,随着随访观察时间延长,该队列平均年龄逐渐增加,高年龄段人口偏多,累计HBeAg阴转的人数逐渐增加。
本研究结果显示,有抗病毒治疗史的感染者HBeAg阴转率为32.4/100人年,其中20~29岁年龄组和30~39岁年龄组的HBeAg阴转率分别为23.7/100人年和28.2/100人年。Xie等[3]对72例采用干扰素治疗的患者(平均年龄29.5岁)随访发现HBeAg年阴转率为25.9%,对73例联合干扰素和核苷类药物治疗的患者(平均年龄30.0岁)随访发现HBeAg年阴转率为16.9%。Minde等[4]对480例采用核苷类药物治疗患者(平均年龄31.0岁)随访1年时HBeAg阴转率为14.0%,5年时HBeAg阴转率为50.0%。本研究同年龄段有抗病毒治疗史的感染者HBeAg阴转率相对稍高,差异可能由研究人群差异、治疗时长、治疗结束后间隔时长等原因造成。
Chen等[11]研究发现相对于在30岁之前就发生HBeAg阴转的慢性HBV感染者,40岁以后才发生HBeAg阴转的对象预后相对较差。本研究发现年长的慢性HBV感染者HBeAg阴转率高于年轻者,无抗病毒史者与有抗病毒感染者相比,阴转率受年龄的影响更大。由于宿主机体免疫系统、肝细胞与病毒的相互作用,低年龄段感染者常处于免疫耐受期,不易发生HBeAg阴转[12-13]。本课题组前期研究发现[14],在HBV感染者中,HBeAg阳性率随着年龄增大而逐渐降低,从<30岁年龄组的36.4%下降到≥40岁年龄组的5.9%。尽管大部分感染者最终可发生HBeAg阴转,但部分患者阴转时间晚,或部分患者不发生阴转,因而,进一步提高<30岁HBeAg阳性感染者的HBeAg阴转率,及时发现≥40岁符合抗病毒治疗指征的HBeAg阳性感染者,对于降低感染者总HBeAg阳性率和提升HBeAg阴转者良好预后具有重大价值。
高水平HBV DNA载量降低了HBeAg阴转可能性,HBeAg阴转组的HBV DNA的下降趋势明显快于HBeAg持续阳性者,提示HBeAg消失伴随着HBV DNA水平的快速下降。Song等[15]同样发现低水平的HBV DNA是预测HBeAg阴转的重要因素。本研究结果显示,253例HBV DNA<20 000 IU/ml的感染者中,随访观察期间25例尚未发生HBeAg阴转,其中18例有抗病毒治疗史,因此对于低病毒载量的HBeAg持续阳性感染者,尤其是给予抗病毒治疗的研究对象,应定期检测HBV DNA。基线HBV DNA≥200 000 IU/ml的HBeAg阴转者中,16.1%的对象在HBeAg阴转后,HBV DNA水平仍≥200 000 IU/ml,可能是发生了病毒PC区1 896位和BCP区1 762/1 764位核苷酸突变,这些突变停止或下调了HBeAg的表达,但不影响病毒的复制,导致成为HBeAg阴性慢性肝炎[16]。
Cox多因素分析结果显示,对于所有感染者和抗病毒治疗者,除了较低的HBV DNA水平外,ALT≥40 U/L增加了HBeAg阴转的可能性(HR值分别为1.37和1.82,P<0.05)。Liaw[17]的综述发现更高值的ALT可能反映机体对HBV有更强的免疫清除作用,此时更有可能发生HBV DNA水平的下降和HBeAg的阴转。本研究所有感染者和无抗病毒治疗史的对象中,虽然ALT<40 U/L者HBeAg阴转率均高于ALT≥40 U/L者,但经过Cox多因素分析后,所有感染者中出现ALT≥40 U/L增加了HBeAg阴转的可能性,而无抗病毒治疗史者ALT不是影响HBeAg阴转的因素。在发生HBeAg阴转之前,ALT值常处于一个较长期的正常值,但会出现一个或多个短的先上升再下降的峰波[17-19]。本研究ALT基线值仅是一个点,这个点值可能处于波峰前、峰波上或波峰后,如果该点处于峰波上(即ALT异常),在此后随访期间常可发生HBeAg阴转;如果ALT值正常,无法准确判断其处于波峰前或波峰后,因而无法判断其对HBeAg阴转的影响。
本研究存在局限性。基线仅有1次ALT检测结果,当连续监测ALT的变化趋势时,才可分析其与HBeAg阴转的时间关系[15]。病毒基因型别是影响乙肝相关疾病转归的重要因素,文献报道感染C病毒基因型的HBeAg阳性不易发生HBeAg阴转[13],江苏省以C基因型为主[20]。由于目前无法对队列研究对象全部检测病毒基因型,本研究尚未将对象感染病毒基因型纳入影响因素分析。
本课题基本阐明了江苏省传染病防治示范区HBeAg阳性慢性HBV感染者HBeAg阴转的总体特征,小年龄段和高病毒载量对象的HBeAg阴转率相对较低,当发生HBeAg阴转时,病毒载量有较快速度的下降。建议对低年龄段的社区HBeAg阳性感染者加强管理和干预,对采取抗病毒治疗的HBeAg阳性感染者加强监测ALT和HBV DNA。
志谢: 本研究得到张家港市、丹阳市和泰兴市疾病预防控制中心和基层医疗卫生机构工作人员以及南京市第二医院张小玉、冯艳红主任医师的大力支持,在此表示感谢利益冲突: 无
| [1] | Hsu YS, Chien RN, Yeh CT, et al. Long-term outcome after spontaneous HBeAg seroconversion in patients with chronic hepatitis B[J]. Hepatology, 2002, 35(6): 1522–1527. DOI:10.1053/jhep.2002.33638 |
| [2] | Chu CM, Hung SJ, Lin J, et al. Natural history of hepatitis B e antigen to antibody seroconversion in patients with normal serum aminotransferase levels[J]. Am J Med, 2004, 116(12): 829–834. DOI:10.1016/j.amjmed.2003.12.040 |
| [3] | Xie Q, Zhou HJ, Bai XF, et al. A randomized,open-label clinical study of combined pegylated interferon Alfa-2a(40 KD) and entecavir treatment for hepatitis B "e" antigen-positive chronic hepatitis B[J]. Clin Infect Dis, 2014, 59(12): 1714–1723. DOI:10.1093/cid/ciu702 |
| [4] | Minde Z, Yimin M, Guangbi Y, et al. Five years of treatment with adefovir dipivoxil in Chinese patients with HBeAg-positive chronic hepatitis B[J]. Liver Int, 2011, 32(1): 137–146. DOI:10.1111/j.1478-3231.2011.02641.x |
| [5] |
朱立国, 田华, 姜洁, 等.
江苏省2012-2014年慢性HBV感染者HBeAg血清学转换后再逆转的特征分析[J]. 中华流行病学杂志, 2017, 38(1): 43–48.
Zhu LG, Tian H, Jiang J, et al. Epidemiological characteristics of HBeAg reversion in chronic hepatitis B patients with HBeAg seroconversion in Jiangsu province,2012-2014[J]. Chin J Epidemiol, 2017, 38(1): 43–48. DOI:10.3760/cma.j.issn.0254-6450.2017.01.008 |
| [6] |
中华医学会肝病学分会, 中华医学会感染病学分会.
慢性乙型肝炎防治指南(2015年版)[J]. 中华实验和临床感染病杂志:电子版, 2015, 9(5): 570–589.
Chinese Society of Hepatology and Chinese Society of Infectious Diseases, Chinese Medical Association. The guideline of prevention and treatment for chronic hepatitis B:a 2015 update[J]. Chin J Exp Clin Infect Dis:Electronic Ed, 2015, 9(5): 570–589. DOI:10.3877/cma.j.issn.1674-1358.2015.05.001 |
| [7] |
高俊岭, 杨春, 朱美英, 等.
应用重复测量统计分析方法评价高血压自我管理的效果[J]. 中华流行病学杂志, 2008, 29(9): 869–872.
Gao JL, Yang C, Zhu MY, et al. Using repeated measurement of ‘analysis of variance’ on hypertension patients to evaluate the self-management program in the communities[J]. Chin J Epidemiol, 2008, 29(9): 869–872. DOI:10.3321/j.issn.0254-6450.2008.09.005 |
| [8] |
闫红静, 张新江, 贾慧娟, 等.
慢性乙型肝炎病毒携带者HBeAg自然血清学转换的纵向队列研究[J]. 中华微生物学和免疫学杂志, 2013, 33(1): 15–18.
Yan HJ, Zhang XJ, Jia HJ, et al. Longitudinal cohort study on the spontaneous HBeAg seroconversion among chronic HBV carriers[J]. Chin J Microbiol Immunol, 2013, 33(1): 15–18. DOI:10.3760/cma.j.issn.0254-5101.2013.01.006 |
| [9] |
巫贵成, 周卫平, 赵有蓉, 等.
慢性乙型肝炎HBeAg和HBsAg的远期转阴率随访[J]. 重庆医科大学学报, 2003, 28(2): 169–171.
Wu GC, Zhou WP, Zhao YR, et al. Study on the long-term clearance rate of HBeAg and HBsAg of chronic hepatitis B[J]. J Chongqing Med Univ, 2003, 28(2): 169–171. DOI:10.3969/j.issn.0253-3626.2003.02.015 |
| [10] | Lok AS, Lai CL, Wu PC, et al. Spontaneous hepatitis B e antigen to antibody seroconversion and reversion in Chinese patients with chronic hepatitis B virus infection[J]. Gastroenterology, 1987, 92(6): 1839–1843. DOI:10.1016/0016-5085(87)90613-5 |
| [11] | Chen YC, Chu CM, Liaw YF. Age-specific prognosis following spontaneous hepatitis B e antigen seroconversion in chronic hepatitis B[J]. Hepatology, 2010, 51(2): 435–444. DOI:10.1002/hep.23348 |
| [12] | Hui CK, Leung N, Yuen ST, et al. Natural history and disease progression in Chinese chronic hepatitis B patients in immune-tolerant phase[J]. Hepatology, 2007, 46(2): 395–401. DOI:10.1002/hep.21724 |
| [13] | Liaw YF. Natural history of chronic hepatitis B virus infection and long-term outcome under treatment[J]. Liver Int, 2009, 29(Suppl 1): S100–107. DOI:10.1111/j.1478-3231.2008.01941.x |
| [14] |
常宝龙, 翟祥军, 许卫国, 等.
乙肝病毒慢性感染者HBeAg、ALT水平分布及其影响因素的现况调查[J]. 南京医科大学学报:自然科学版, 2012, 32(2): 160–162.
Chang BL, Zhai XJ, Xu WG, et al. Cross-sectional investigation of HBeAg and ALT distribution and influence factor in chronic hepatitis B patients[J]. Acta Univ Med Nanjing:Nat Sci, 2012, 32(2): 160–162. |
| [15] | Song GJ, Rao HY, Feng B, et al. Prediction of spontaneous HBeAg seroconversion in HBeAg-positive chronic hepatitis B patients during the immune clearance phase[J]. J Med Virol, 2014, 86(11): 1838–1844. DOI:10.1002/jmv.24032 |
| [16] | Trépo C, Chan HLY, Lok A. Hepatitis B virus infection[J]. Lancet, 2014, 384(9959): 2053–2063. DOI:10.1016/S0140-6736(14)60220-8 |
| [17] | Liaw YF. Hepatitis flares and hepatitis B e antigen seroconversion:implication in anti-hepatitis B virus therapy[J]. J Gastroenterol Hepatol, 2003, 18(3): 246–252. DOI:10.1046/j.1440-1746.2003.02976.x |
| [18] | World Health Organization. Guidelines for the prevention,care and treatment of persons with chronic hepatitis B infection,2015[EB/OL].[2016-05-31]. http://www.who.int/hiv/pub/hepatitis/hepatitis-b-guidelines/en/. |
| [19] | Ganem D, Prince AM. Hepatitis B virus infection-natural history and clinical consequences[J]. N Engl J Med, 2004, 350(11): 1118–1129. DOI:10.1056/NEJMra031087 |
| [20] | Yin JH, Zhang HW, He YC, et al. Distribution and hepatocellular carcinoma-related viral properties of hepatitis B virus genotypes in Mainland China:a community-based study[J]. Cancer Epidemiol Biomarkers Prev, 2010, 19(3): 777–786. DOI:10.1158/1055-9965.EPI-09-1001 |
 2017, Vol. 38
2017, Vol. 38