文章信息
- 张莉君, 郭常义, 许慧慧, 许东, 沈先标, 杜向阳, 章敏华, 谈建国, 张江华, 东春阳, 钱海雷, 施烨闻, 潘梅竹, 周晓丹 .
- Zhang Lijun, Guo Changyi, Xu Huihui, Xu Dong, Shen Xianbiao, Du Xiangyang, Zhang Minhua, Tan Jianguo, Zhang Jianghua, Dong Chunyang, Qian Hailei, Shi Yewen, Pan Meizhu, Zhou Xiaodan .
- 上海市大气污染对小学生肺功能小气道指标的急性效应研究
- Acute effect of ambient air pollution on small airway lung functions among school children in Shanghai
- 中华流行病学杂志, 2017, 38(2): 147-153
- CHINESE JOURNAL OF EPIDEMIOLOGY, 2017, 38(2): 147-153
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2017.02.003
-
文章历史
收稿日期: 2016-09-22
2. 200336 上海市疾病预防控制中心/上海市预防医学研究院中心办公室;
3. 200336 上海市疾病预防控制中心/上海市预防医学研究院公共服务与健康安全评价所;
4. 200237 上海市徐汇区疾病预防控制中心环境职业卫生科;
5. 201901 上海市宝山区疾病预防控制中心环境卫生科;
6. 200023 上海市黄浦区疾病预防控制中心环境卫生科;
7. 200030 上海市气象局气象与健康重点实验室
2. General Office, Shanghai Municipal Center for Disease Control and Prevention/Shanghai Institute for Prevention Medicine, Shanghai 200336, China;
3. Division of Public Health Service and Safety Assessment, Shanghai Municipal Center for Disease Control and Prevention/Shanghai Institute for Prevention Medicine, Shanghai 200336, China;
4. Environmental and Occupational Health Department, Shanghai Xuhui Centre for Disease Control and Prevention, Shanghai 200237, China;
5. Environmental Health Department, Shanghai Baoshan Centre for Disease Control and Prevention, Shanghai 201901, China;
6. Environmental Health Department, Shanghai Huangpu Centre for Disease Control and Prevention, Shanghai 200023, China;
7. Shanghai Key Laboratory of Meteorology and Health, Shanghai Meteorological Service, Shanghai 200030, China
近几十年,中国作为全球最大的发展中国家,经历了高速经济发展和城市化进程,但大气污染正成为影响居民健康的主要环境因素。儿童是大气污染的敏感人群之一[1],美国、墨西哥、瑞典等多个国家和地区的流行病学研究显示,暴露于高浓度的大气污染物与儿童肺功能的下降或增长率降低明显相关[2],如室外颗粒物浓度与第一秒用力呼吸容积(FEV1)呈负相关[3];儿童最大中段呼气流速(MMEF)的降低与儿童二氧化氮(NO2)和元素碳(EC)暴露相关等[4]。国内相关研究则多集中在比较不同区域污染水平下,儿童肺功能的差异性,而冬季频发雾霾的情况下,是否对儿童肺功能造成影响,尚未见有关报道。2013年12月至2015年5月本研究采用定群追踪设计(panel study),上海市内、中、外环的3所小学开展了肺功能重复测定,并分析大气复合型污染对儿童肺功能小气道指标的急性影响。
对象与方法1. 研究对象:按照整群抽样原则在上海市内、中、外环区域内各选择小学一所(A、B、C校),每所学校3~5年级随机抽取一个班级,共233名正常儿童作为调查对象(已排除哮喘等慢性呼吸道疾病的学生),本研究获得上海市CDC伦理委员会批准(编号2013-3),征得所有调查对象、家长或主要监护人同意,并填写知情同意书。
2. 研究方法:
(1)大气污染及气象资料:分别在线收集2013年12月、2014年12月、2014年6月和2015年5月上海市环境监测中心网站(http://www.semc.gov.cn/aqi/home/Station.aspx)公布的上师大(距离A校约0.8 km)、虹口凉城(距离B校约4.7 km)和卢湾师专附小(大气监测站位于C校内)监测点细颗粒物(PM2.5)、可吸入颗粒物(PM10)、二氧化硫(SO2)和NO2的1 h平均浓度,计算日均浓度;从上海市气象局收集同期每日平均气温和平均相对湿度。
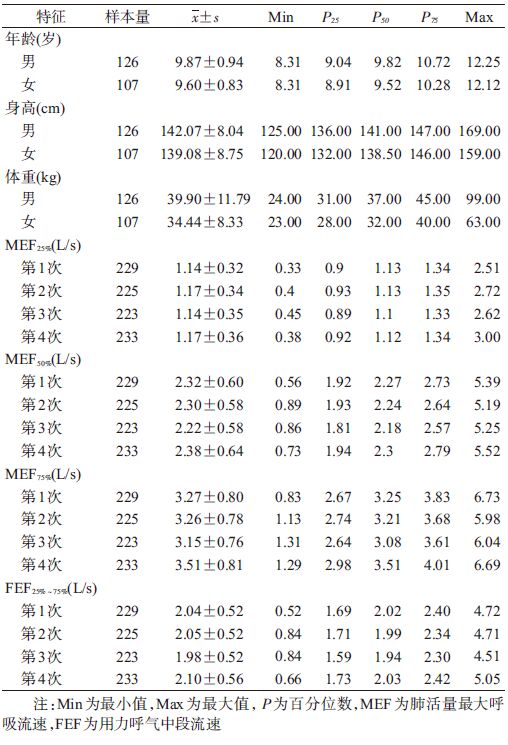
(2)肺功能测定:采用自动便携式肺功能检测仪(Pony FX,意大利Cosmed公司)对A、B校调查儿童在2013年12月测定肺功能3次,每次间隔约1周(A校测量日期为2013年12月12、19和23日,B校测量日期为2013年12月10、16-17和25日),2014年6月4-5日A、B校重复第4次测量;对C校儿童,按同样方法分别在2014年12月16、23和30日及2015年5月19日完成4次测量。所有测量均需录入性别、出生年月、身高和体重,第4次测量时重新检查身高和体重,仪器自动出具检测报告,指标包括MEF25%、MEF50%、MEF75%和FEF25%~75%等。
(3)质量控制:为保证肺功能检测的准确性,全程固定聘请2名专业临床肺功能检测医生;仪器使用前检查稳定性。测量前儿童避免剧烈运动,测量时取立位并带好鼻夹,按医生指示完成吸气和呼气,仪器当场出具检测数据,如检测结果不理想,重复测量至最佳结果。
3. 统计学分析:以EpiData 3.1软件建立数据库,SAS 9.3软件统计分析,正态分布数据用均数、标准差、百分位数(P25,P50,P75)、最大值(Max)和最小值(Min)描述,非正态数据用中位数(M)、四分位间距(IQR)、Max和Min描述;Spearman秩相关分析相关性;线性混合效应模型(linear mixed-effects regression models)[5-7]分析大气污染对各肺功能的滞后效应,模型矩阵形式为:Y=Xb+Zu+e,Y表示反应变量的测量值向量,为增加数据正态性,取不同时间测量的肺功能实测值常用对数值;X为固定效应自变量的设计矩阵,即大气污染物,不同时间的气温、相对湿度、年龄、身高和体重为控制变量,b为X对应的固定效应参数向量;Z为随机效应变量的设计矩阵,本研究中个体为随机效应,u为随机效应参数向量;e为剩余误差向量,通过模型估计各大气污染物对肺功能的滞后效应。为验证模型稳定性和敏感性,采用多种协方差结构建模,包括一阶自回归结构[AR(1)]、复合对称结构(CS)、空间幂相关结构[SP(POW)]和无结构(UN),最终以选择似然比统计量(-2 log likehood)、Akaike’s Information Criterion(AIC)及Schwartz’s Bayesian Criterion(BIC)最小化原则,选择无结构协方差(type=UN)建模。在分析单污染物和双污染物模型时,将时间、气温、相对湿度作为主要控制变量,再依次纳入性别、身高、体重,以AIC值最小者作为最优模型。经验证,当变量均作为控制变量时,模型稳定性最佳。入选标准为0.05,移除标准为0.10,以P<0.05为差异有统计学意义。本文的效应结果统一转换为肺功能指标变化百分率(P),计算公式[8]:
P=[10(β×IQR)-1]×100% 95%CI=[10(IQR×(β±1.96)×sx)-1]×100%
结 果1. 一般情况:各校均完成4次肺功能测定,完成1~4次肺功能检查的学生分别为229人(98.28%)、228人(97.85%)、231人(99.14%)和233人(100%),完成全部4次检查的学生共229人(98.28%)。从肺功能各指标均数来看,除MEF25%以外,其余指标表现为前三次逐渐降低,第4次有回升趋势,肺功能各指标及年龄、身高、体重分布见表 1。
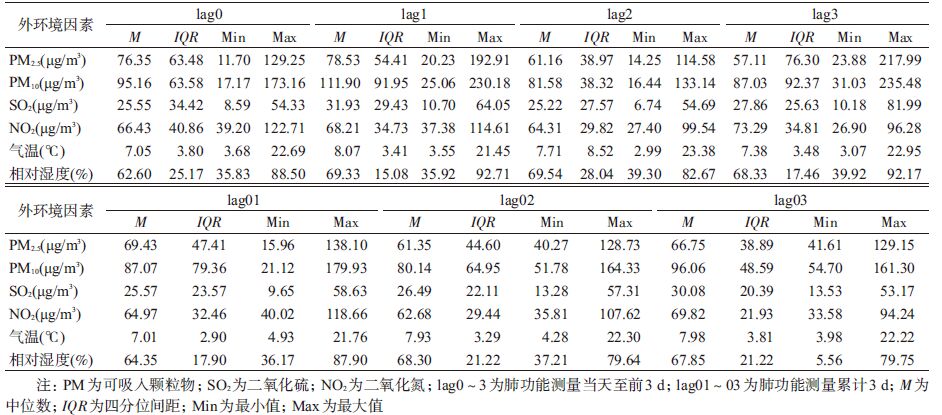
2. 大气污染物及气象指标:由于大气污染物3日平均值及PM2.5的成分均会对肺功能造成短期影响[9],故本文分析肺功能测量当天(lag0)、前3 d(lag1、lag2、lag3)及累计3 d(lag01、lag02和lag03)的大气污染状况和气象条件,结果显示PM2.5和PM10日均浓度均超过国家一级或二级标准[10],SO2和NO2日均浓度均符合国家标准,但各污染物的最大浓度仍存在明显的超标现象。调查期间日平均气温7~8 ℃,最低温度2.99 ℃,最高温度23.38 ℃;日平均相对湿度均>60%,日最小相对湿度35.83%,日最大相对湿度92.71%,各时间大气污染物浓度及气象指标见表 2。
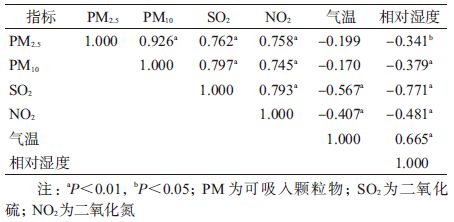
3. 外环境监测数据关联性分析:逐日污染物浓度和气象数据之间的相关性分析结果显示,相关性较强的为PM2.5与PM10(r=0.926);其次为SO2与PM2.5、PM10、NO2;再次为NO2与PM2.5、PM10;气温与SO2、NO2为负相关,r值分别为-0.567和-0.407;相对湿度与各污染物均呈负相关,与气温呈正相关,其中与SO2相关程度最为显著(r=-0.771,P<0.01),见表 3。
4. 大气污染物对肺功能的滞后效应分析:
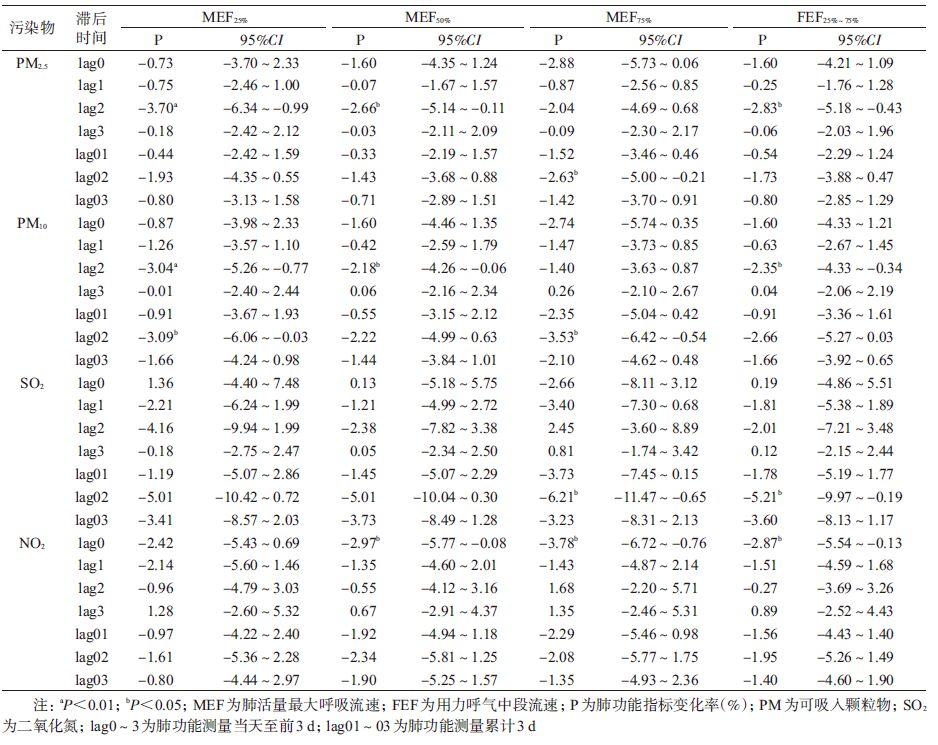
(1)单污染物模型:单污染物模型显示,4种大气污染物对儿童肺功能MEF25%、MEF50%、MEF75%和FEF25%~75%有不同程度的滞后效应和累计滞后效应。其中PM2.5表现为lag2日的滞后影响和lag02日的累积滞后影响,lag2日浓度每增加一个IQR(38.97 μg/m3),MEF25%、MEF50%和FEF25%~75%分别相应降低3.70%(95%CI:-6.34~-0.99)、2.66%(95%CI:-5.14~-0.11)和2.83%(95%CI:-5.18~-0.43); lag02日浓度每增加一个IQR(44.60 μg/m3),MEF75%下降2.63%(95%CI:-5.00~-0.21)。PM10也表现为lag2日滞后影响和lag02日累积滞后影响,其中lag2日浓度每增加一个IQR(38.32 μg/m3),MEF25%、MEF50%和FEF25%~75%分别相应的降低3.04%(95%CI:-5.26~-0.77)、2.18%(95%CI:-4.26~-0.06)和2.35%(95%CI:-4.33~-0.34);lag02日浓度每增加一个IQR(64.95 μg/m3),MEF25%和MEF75%分别下降3.09%(95%CI:-6.06~-0.03)和3.53%(95%CI:-6.42~-0.54)。SO2仅在lag02日对MEF75%和FEF25%~75%有累积滞后影响,表现为污染物浓度每增加一个IQR(22.11 μg/m3),MEF75%和FEF25%~75%分别相应下降6.21%(95%CI:-11.47~-0.65)和5.21%(95%CI:-9.97~-0.19)。NO2的效应发生在肺功能检测当日(lag0),浓度每增加一个IQR(40.86 μg/m3),MEF50%、MEF75%和FEF25%~75%分别相应的降低2.97%(95%CI:-5.77~-0.08)、3.78%(95%CI:-6.72~-0.76)和2.87%(95%CI:-5.54~-0.13),差异均有统计学意义(P<0.05或P<0.01),见表 4。
(2)双污染物模型:由于大气污染物间可能存在相互影响,拟合双污染物模型进行分析,本研究只关注各污染物的主效应,依据单污染物模型分析结果,根据效应值最大原则确定lag2日为最佳滞后日[11],分别分析2种污染物共存时对肺功能小气道指标的影响,表现为分别控制PM2.5和PM10时,SO2和NO2与2种颗粒物的双污染物模型差异均有统计学意义(P<0.05或P<0.01),且滞后效应值大于SO2和NO2的单污染物模型,但分别控制SO2或NO2时,PM2.5和PM10与SO2或NO2的双污染物模型差异均无统计学意义,未发现SO2和NO2共存时有明显滞后效应(图 1)。
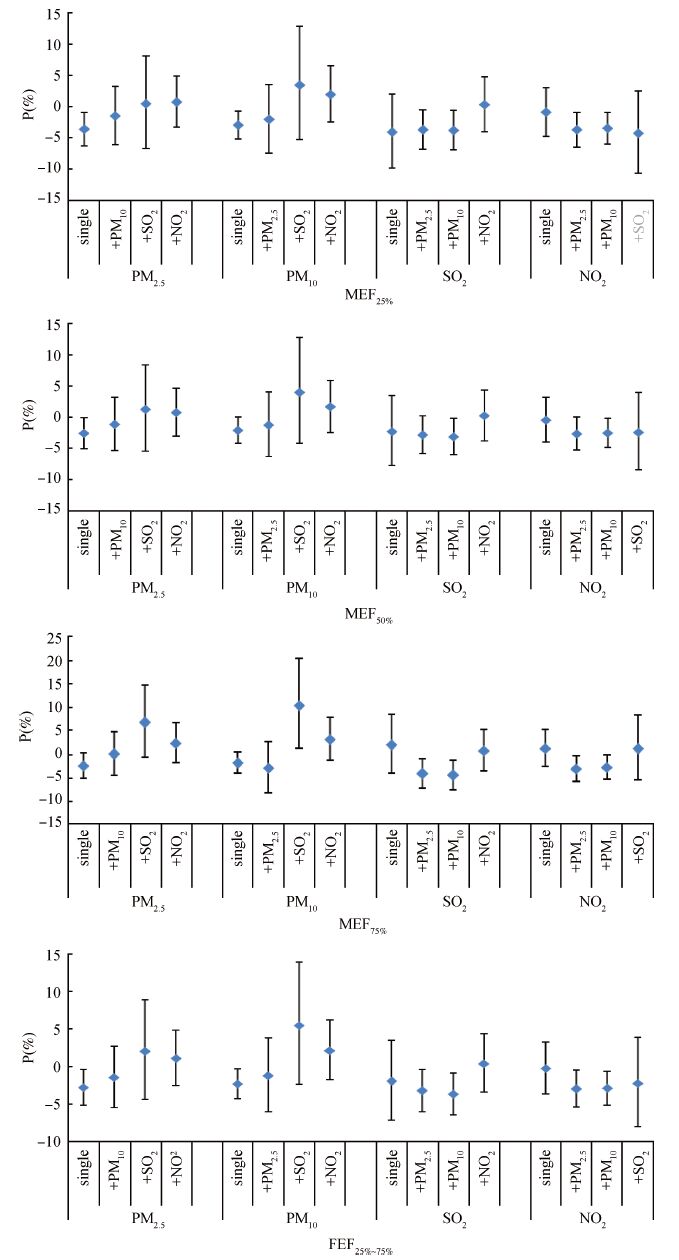
|
| 注: P为肺功能指标变化率(%); single为单模型; PM为可吸入颗粒物; SO2为二氧化硫; NO2为二氧化氮; MEF为肺活量最大呼吸流速; FEF为用力呼气中段流速 图 1 大气污染物与肺功能各指标的双污染物模型分析 |
肺功能是评价儿童呼吸系统发育状况的常用指标,也常用于评价大气污染对儿童呼吸系统的影响,其中MEF75%、MEF50%、MEF25%和FEF25%~75%均是反映小气道早期病变的敏感指标[12]。
国外报道显示,大气污染物浓度升高对儿童的肺功能造成不同程度的影响。荷兰RAPTES项目发现NO2、NOx等大气污染物浓度变化与急性呼吸道炎症指标和肺功能减弱有关[13]; Delfino等[14]研究显示,PM2.5个人暴露1 h浓度每增加71 μg/m3,儿童肺功能FEV1预测值下降1.32%,NO2 2日平均暴露浓度每增加16.8 ppb,FEV1预测值下降2.45%;美国Gauderman等[15]对南加州3 677名儿童的追踪8年的队列研究显示,儿童暴露于交通污染,会导致FEV1、MMEF分别下降81 ml/s和127 ml/s;Liu等[16]对加拿大哮喘儿童的调查显示,SO2、NO2和PM2.5增加5.4 ppb、6.8 ppb和5.4 μg/m3,哮喘儿童FEF25%~75%分别降低3.1%、2.8%和3.0%。国外报道多集中在FEV1和FEF25%~75%指标,尚未知其余小气道指标是否改变。
我国少见类似报道,仅有王欣等[17]报道北京市大气PM2.5和PM10对儿童肺功能存在短期负效应,并存在滞后性(lag01和lag02);我国台湾地区Chen 等[18]报道PM2.5每增加12 μg/m3,儿童的MMEF下降102 ml/s;其余报道则集中在其他人群或横断面研究[9, 19]。本文采用定群追踪研究,结合线性混合效应模型分析显示,大气污染物对儿童肺功能小气道指标MEF25%、MEF50%、MEF75%和FEF25%~75%均有不同程度的滞后效应和累计滞后效应,PM2.5和PM10的影响主要发生在lag2影响和lag02后;SO2主要是lag02后;NO2的效应与lag0的浓度明显相关,本文还对其暴露反应关系进行了估算,证明大气污染物浓度每升高一个IQR,肺功能小气道指标会有所下降。由于大气污染物间可能存在相互影响,双污染物模型分析显示分别控制PM2.5和PM10时,SO2和NO2与2种颗粒物的双污染物模型均有统计学意义,且滞后效应大于SO2和NO2的单独存在时,但控制SO2或NO2后,PM2.5和PM10与二者的双污染物模型均无统计学意义,也未发现SO2和NO2共存时有明显滞后效应,该结果提示,在大气污染对肺功能影响中,PM2.5、PM10与SO2和NO2存在交互影响。有研究显示[17, 20],当有SO2和NO2与PM2.5和PM10污染共存,对肺功能的影响可能加剧,推测原因,SO2易被呼吸道黏膜表面吸附而形成亚硫酸(H2SO3),部分还会被氧化为硫酸(H2SO4),NO2也可以与水蒸气化合形成HNO3,当颗粒物与SO2和NO2共存时,颗粒物会将这类酸性气溶胶带入各级气管、支气管或肺泡,由于儿童呼吸系统和免疫系统发育尚不完善,SO2和NO2的存在,加速了PM2.5和PM10对呼吸系统的炎症反应,也将加剧对肺功能的损害[21]。
综上所述,上海市2013年和2014年大气污染物PM2.5、PM10、SO2和NO2与儿童肺功能小气道指标的降低明显相关,PM2.5、PM10和SO2表现为滞后效应及累计滞后效应,NO2表现为当日效应,且lag2的SO2和NO2叠加PM2.5、PM10污染时,对肺功能小气道指标更有显著影响。本研究仅是短期追踪,并未对个体暴露、家庭暴露及生活习惯等进行同步追踪,尚不能确定大气污染的急性暴露与儿童肺功能改变的因果关联,但提示了短期持续暴露于大气污染与儿童肺功能急性损伤有较强关联,所以建议开展长期队列追踪研究。
志谢: 感谢上海市CDC虞慧婷统计师和臧嘉捷博士及复旦大学公共卫生学院陈仁杰博士在数据分析中给予的指导与建议以及各监测点小学在现场调查中给予的协助利益冲突: 无
| [1] | Götschi T, Heinrich J, Sunyer J, et al. Long-term effects of ambient air pollution on lung function:a review[J]. Epidemiology, 2008, 19(5): 690–701. DOI:10.1097/EDE.0b013e318181650f |
| [2] | Hwang BF, Chen YH, Lin YT, et al. Relationship between exposure to fine particulates and ozone and reduced lung function in children[J]. Environ Res, 2015, 137: 382–390. DOI:10.1016/j.envres.2015.01.009 |
| [3] | Delfino RJ, Quintana PJE, Floro J, et al. Association of FEV1 in asthmatic children with personal and microenvironmental exposure to airborne particulate matter[J]. Environ Health Perspect, 2004, 112(8): 932–941. DOI:10.1289/ehp.6815 |
| [4] | Chen Z, Salam MT, Eckel SP, et al. Chronic effects of air pollution on respiratory health in Southern California children:findings from the Southern California Children's Health Study[J]. J Thorac Dis, 2015, 7(1): 46–58. DOI:10.3978/j.issn.2072-1439.2014.12.20 |
| [5] | Cnaan A, Laird NM, Slasor P. Using the general linear mixed model to analyse unbalanced repeated measures and longitudinal data[J]. Stat Med, 1997, 16(20): 2349–2380. DOI:10.1002/(SICI)1097-0258(19971030)16:20<2349::AID-SIM667>3.0.CO;2-E |
| [6] | Krueger C, Tian L. A comparison of the general linear mixed model and repeated measures ANOVA using a dataset with multiple missing data points[J]. Biol Res Nurs, 2004, 6(2): 151–157. DOI:10.1177/1099800404267682 |
| [7] |
王维华, 范小静, 刘如如, 等.
拉萨藏族农村地区0~12月龄婴儿体格发育的纵向随访研究[J]. 中华流行病学杂志, 2014, 35(1): 13–18.
Wang WH, Fan XJ, Liu RR, et al. Growth pattern of Tibetan infants:one-year follow-up study after birth in rural Tibet[J]. Chin J Epidemiol, 2014, 35(1): 13–18. DOI:10.3760/cma.j.issn.0254-6450.2014.01.004 |
| [8] | Wu SW, Deng FR, Niu J, et al. Association of heart rate variability in taxi drivers with marked changes in particulate air pollution in Beijing in 2008[J]. Environ Health Perspect, 2010, 118(1): 87–91. DOI:10.1289/ehp.0900818 |
| [9] | Wu SW, Deng FR, Wang X, et al. Association of lung function in a panel of young healthy adults with various chemical components of ambient fine particulate air pollution in Beijing,China[J]. Atm Environ, 2013, 77: 873–874. DOI:10.1016/j.atmosenv.2013.06.018 |
| [10] |
中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. GB 3095-2012环境空气质量标准[S]. 北京:中国环境科学出版社,2012.
The state administration of quality supervision,inspection and quarantine of the People's Republic of China,China national standardization management committee. GB 3095-2012 Ambient air quality standards[S]. Beijing:China Environmental Science Press,2012. |
| [11] |
苏畅, 郭玉明, FranckU, 等.
大气污染物与呼吸系统疾病急诊就诊关系的病例交叉研究[J]. 中华流行病学杂志, 2010, 31(8): 845–849.
Su C, Guo YM, Franck U, et al. Association between ambient air pollution and hospital emergency room visits for respiratory diseases:a case-crossover study[J]. Chin J Epidemiol, 2010, 31(8): 845–849. DOI:10.3760/cma.j.issn.0254-6450.2010.08.002 |
| [12] | Lebecque P, Kiakulanda P, Coates AL. Spirometry in the asthmatic child:is FEF25-75 a more sensitive test than FEV1/FVC?[J]. Pediatr Pulmonol, 1993, 6(1): 19–22. DOI:10.1002/ppul.1950160105 |
| [13] | Strak M, Janssen NA, Godri KJ, et al. Respiratory health effects of airborne particulate matter:the role of particle size,composition,and oxidative potential-the RAPTES project[J]. Environ Health Perspect, 2012, 120(8): 1183–1189. DOI:10.1289/ehp.1104389 |
| [14] | Delfino RJ, Staimer N, Tjoa T, et al. Personal and ambient air pollution exposures and lung function decrements in children with asthma[J]. Environ Health Perspect, 2008, 116(4): 550–558. DOI:10.1289/ehp.10911 |
| [15] | Gauderman WJ, Vora H, McConnell R, et al. Effect of exposure to traffic on lung development from 10 to 18 years of age:a cohort study[J]. Lancet, 2007, 369(9561): 571–577. DOI:10.1016/S0140-6736(07)60037-3 |
| [16] | Liu L, Poon R, Chen L, et al. Acute effects of air pollution on pulmonary function,airway inflammation,and oxidative stress in asthmatic children[J]. Environ Health Perspect, 2009, 117(4): 668–674. DOI:10.1289/ehp11813 |
| [17] |
王欣, 邓芙蓉, 吴少伟, 等.
北京市某区大气可吸入颗粒物和细颗粒物对儿童肺功能的短期影响[J]. 北京大学学报:医学版, 2010, 42(3): 340–344.
Wang X, Deng FR, Wu SW, et al. Short-time effects of inhalable particles and fine particles on children's lung function in a district in Beijing[J]. J Pek Univer:Health Sci, 2010, 42(3): 340–344. DOI:10.3969/j.issn.1671-167X.2010.03.020 |
| [18] | Chen CH, Chan CC, Chen BY, et al. Effects of particulate air pollution and ozone on lung function in non-asthmatic children[J]. Environ Res, 2015, 137: 40–48. DOI:10.1016/j.envres.2014.11.021 |
| [19] |
李娇元, 马露, 刘历志, 等.
武汉市秋冬季空气颗粒物暴露对大学生肺功能的短期影响[J]. 中华预防医学杂志, 2013, 47(2): 155–159.
Li JY, Ma L, Liu LZ, et al. The short-term effects of particulate matter on lung function of college students in autumn and winter in Wuhan[J]. Cin J Prev Med, 2013, 47(2): 155–159. DOI:10.3760/cma.j.issn.0253-9624.2013.02.013 |
| [20] | Aekplakorn W, Loomis D, Vichit-Vadakan N, et al. Acute effect of sulphur dioxide from a power plant on pulmonary function of children,Thailand[J]. Int J Epidemiol, 2003, 32(5): 854–861. DOI:10.1093/ije/dyg237 |
| [21] | Liu SK, Cai S, Chen Y, et al. The effect of pollutional haze on pulmonary function[J]. J Thorac Dis, 2016, 8(1): E41–56. DOI:10.3978/j.issn.2072-1439.2016.01.18 |
 2017, Vol. 38
2017, Vol. 38