文章信息
- 樊石磊, 丁玲, 任志英, 陈霄, 孙雪松, 李聪聪, 刘春亮, 贾吴琳, 李巧玲, 王金桃 .
- Fan Shilei, Ding Ling, Ren Zhiying, Chen Xiao, Sun Xuesong, Li Congcong, Liu Chunliang, Jia Wulin, Li Qiaoling, Wang Jintao .
- 细胞外信号调节激酶1/2表达与HPV16感染及其交互效应在子宫颈癌变中的作用
- Effect of extracellular signal-regulated kinas 1/2 expression and HPV16 infection and their interaction in progression of cervical cancerization
- 中华流行病学杂志, 2017, 38(1): 96-101
- Chinese journal of Epidemiology, 2017, 38(1): 96-101
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2017.01.019
-
文章历史
收稿日期: 2016-08-24
2. 030001 太原, 山西省心血管病医院社区健康中心
2. Community Health Centre, Shanxi Cardiovascular Hospital, Taiyuan 030001, China
子宫颈癌是女性常见的恶性肿瘤之一,全世界每年有近50万新发病例,死亡27.4万例[1],其发病率占女性肿瘤的5%[2],且85%以上的子宫颈癌发生在发展中国家[3]。流行病学与分子生物学研究表明,人乳头瘤病毒(HPV)特别是HPV16感染是子宫颈癌的主要病因[4]。育龄女性HPV感染现象普遍存在,但只有小部分发展成子宫颈癌[5],提示HPV感染并不是子宫颈癌发生的唯一影响因素。细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)是丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPK)三级酶促级联反应中重要的一个家族。ERK家族的5个亚家族中,ERK1/2作为Ras/Raf/MEK/ERK信号通路的重要成分,是将信号从细胞表面受体转导至细胞核的关键成员。ERK1/2被激活后,以磷酸化(p-ERK1/2)的形式介导信号由细胞质向细胞核传递,参与调节细胞的生长、发育、分化、分裂、死亡等多种生理过程,并在细胞的恶性转化中起重要作用[6]。已有研究表明,ERK1/2的活性与HPV16密切相关[7-8]。在HPV16感染时,尖锐湿疣角质形成细胞中可能使ERK激活增加[9]。Crusius等[10]也发现HPV16 E5基因产物能通过EGF依赖途径激活ERK和促细胞增殖。然而,ERK1/2表达在子宫颈癌变过程中的作用及其与HPV16感染的关系相关研究较少。本研究从人群研究和体外研究的角度,探讨ERK1/2在子宫颈癌变中的表达及其与HPV16感染的交互作用,以期为子宫颈癌的研究提供一定的理论依据。
对象与方法1.研究对象:选取2013年9月至2014年3月在山西省肿瘤医院、山西省妇幼保健院、山西省晋煤集团总医院经组织病理学确诊的各种子宫颈病变女性176例为研究对象,包括正常子宫颈(normal cervical,NC)女性34例、低度子宫颈上皮内瘤变(cervical intraepithelial neoplasm Ⅰ,CINⅠ)患者26例、高度子宫颈上皮内瘤变(cervical intraepithelial neoplasmⅡ/Ⅲ,CINⅡ/Ⅲ)患者57例、子宫颈鳞状细胞癌(squamous cell carcinoma,SCC)患者59例。其中,CINⅠ、CINⅡ/Ⅲ和SCC组均为新发病例,且术前未接受放疗或化疗,并排除其他严重疾病患者和其他肿瘤患者。NC组为医院进行子宫颈癌筛查、TCT检测和阴道镜下病检均无异常的女性,以及住院患者中行子宫肌瘤切除术后子宫颈病检正常的女性。
2.资料收集:本研究通过山西医科大学医学伦理委员会批准,研究对象均签署知情同意书。采用结构式问卷收集研究对象的人口学特征、生活习惯、月经婚育史、妇科病史、肿瘤家族史等资料。同时收集全部研究对象经手术或活检的子宫颈石蜡组织标本。
3.子宫颈癌细胞株的选择与ERK抑制:选择HPV16阳性Siha子宫颈癌细胞和HPV阴性C33A子宫颈癌细胞进行研究。以施加和不施加ERK抑制剂U0126作为干预组和对照组。经过对U0126不同时间、不同浓度的抑制效果预实验,最终确定24 h、4 μmol/L和24 h、1 μmol/L分别为Siha细胞和C33A细胞的最适时间和最适浓度。
4.实验方法:
(1)PCR法检测HPV16感染:采用酚-氯仿蛋白酶K法提取子宫颈组织DNA,用PCR仪进行HPV16 DNA的扩增,将HPV16 DNA扩增产物进行琼脂糖凝胶电泳以确定HPV16感染状态,具体步骤见文献[11]。
(2)免疫组化法检测子宫颈组织中p-ERK1/2蛋白的表达:取石蜡包埋组织,连续切片至4 μm,置于载玻片上。严格按照免疫组化试剂盒(PV-900,北京中杉金桥生物技术有限公司)操作步骤进行检测,p-ERK1/2抗体购自英国Abcam公司,1 : 100稀释。染色后由2名观察者进行盲法阅片:染色程度不着色、淡棕色、棕色、深棕色分别计为0、1、2、3分;阳性范围0%、1%~25%、26%~50%、>50%分别计为0、1、2、3分。最终将两者相加为总分:0~1分为(-),2分为(+),3~4分为(++),5~6分为(+++)。阳性表达率为结果“+~+++”的例数占总例数的比例。
(3)细胞计数法测定细胞生长:取对数生长期的细胞(1×105个/ml)培养24 h后,向干预组加U0126,对照组添加培养液,24 h后收集细胞制成细胞悬液,台盼蓝染色,计数。活细胞不着色,死细胞着蓝色,每孔重复计数3次。细胞抑制率=(对照组细胞总数-干预组细胞总数)/对照组细胞总数×100%
(4)流式细胞仪检测细胞周期与凋亡:取对数生长期细胞(1×105/ml),用0.25%的胰蛋白酶进行消化,制成细胞悬液,离心,弃上清。PBS洗涤,过滤,离心,弃上清。PE染色(Annexin V-PE凋亡试剂),用流式细胞仪检测、分析细胞的增殖和凋亡。
5.统计学分析:利用SPSS 20.0软件,采用χ2检验、趋势χ2检验比较组间率的差异;采用OR值及其95%CI评价疾病与因素间的关联强度;应用相加模型进行交互作用定性和定量评估。以P<0.05为差异有统计学意义。
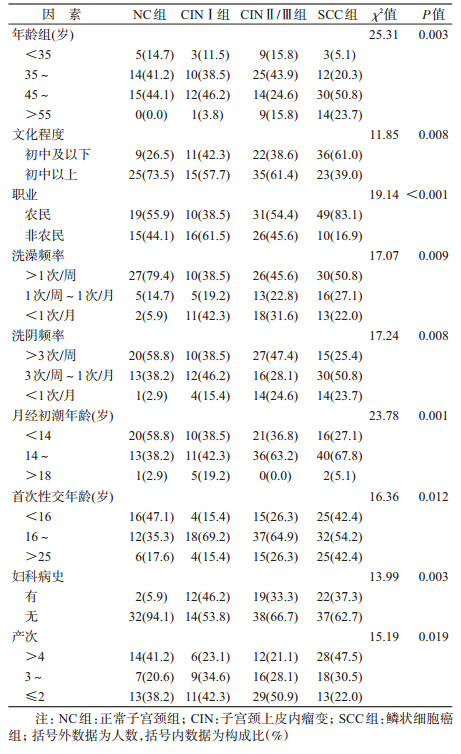
结果1.子宫颈癌变的相关因素分析:NC组、CINⅠ组、CINⅡ/Ⅲ组和SCC组的年龄分别为29~55(42.97±6.91)岁、29~56(44.35±7.69)岁、28~64(44.05±8.33)岁和28~70(50.25±8.32)岁。各组间在年龄、文化程度、职业、洗澡频率、洗阴频率、首次性交年龄、月经初潮年龄、妇科病史、产次等方面的差异有统计学意义(均P<0.05),在肿瘤家族史、吸烟、饮酒、人工流产史、经期性生活、性生活后清洗、首次生育年龄、绝经、孕次等方面的差异无统计学意义(均P>0.05),见表 1。
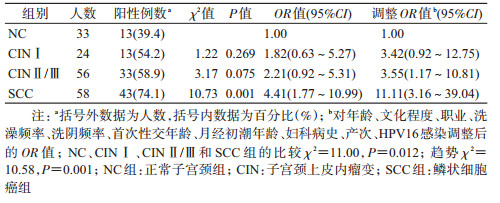
2. HPV16感染与子宫颈癌变的关系:HPV16感染率在CINⅠ组(42.3%)、CINⅡ/Ⅲ组(56.1%)及SCC组(62.7%)均高于NC组(17.6%)。随着子宫颈病变程度的加重,HPV16感染导致的子宫颈癌变风险呈逐渐升高趋势(趋势χ2=17.99,P<0.001),尤其是在调整子宫颈癌变相关因素后,在CINⅡ/Ⅲ组和SCC组的致病危险性有统计学意义,见表 2。
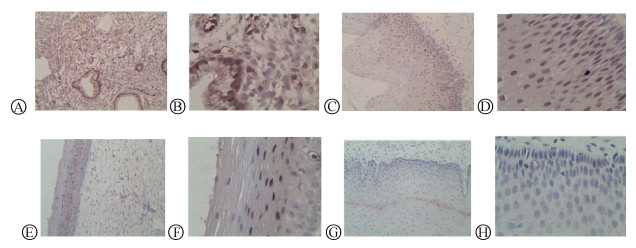
3. p-ERK1/2蛋白表达与子宫颈癌变的关系:p-ERK蛋白阳性表达主要位于细胞核,部分出现于细胞质,呈点、片状分布,在各子宫颈病变组中均有不同程度的表达(图 1)。p-ERK1/2蛋白的阳性表达率在NC组、CINⅠ组、CINⅡ/Ⅲ组和SCC组分别为39.4%、54.2%、58.9%和74.1%,总体分布差异有统计学意义。随着子宫颈病变的加重,p-ERK1/2蛋白引起的子宫颈癌变危险性呈逐渐升高趋势(趋势χ2=10.58,P=0.001),特别是在CINⅡ/Ⅲ组和SCC组,这种效应在调整子宫颈病变相关因素后依然存在,见表 3。
|
| 注:细胞核呈棕黄色染色为p-ERK表达阳性;A、B:子宫颈癌组;C、D:CINⅡ/Ⅲ组;E、F:CINⅠ组;G、H:NC组 图 1 p-ERK1/2蛋白在不同程度子宫颈病变组织中的表达(A、C、E、G:免疫组化×100;B、D、F、H:免疫组化×400) |
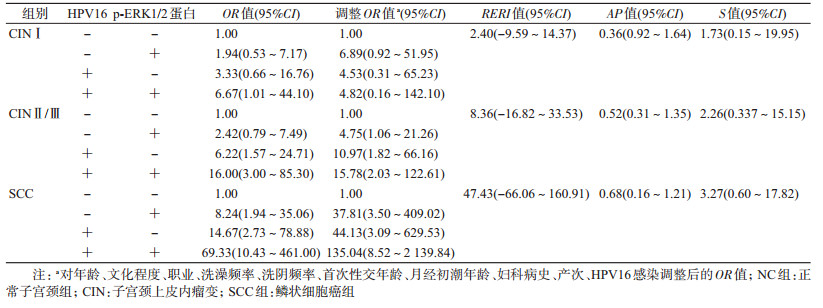
4. p-ERK1/2蛋白表达与HPV16感染之间的相互作用:以NC组为对照,应用相加效应模型对子宫颈病变中HPV16感染和p-ERK1/2蛋白表达进行交互作用分析,结果显示,HPV16感染和p-ERK1/2蛋白阳性表达在CINⅠ组、CINⅡ/Ⅲ组和SCC组均存在正相加交互作用,交互作用指标AP值显示正相加效应,见表 4。
5. ERK对子宫颈癌细胞增殖、凋亡的影响:采用U0126干预Siha和C33A两种细胞后,在不同时间点,干预组活细胞数少于对照组,差异有统计学意义(均P<0.001)。随着干预时间的延长两细胞的抑制率逐渐增加,72 h达到高峰并持续至120 h无明显变化,且2种细胞在各时点的抑制率差异无统计学意义(图 2A)。采用流式细胞仪检测细胞凋亡和周期变化的结果显示,干预组2种细胞的凋亡率均明显增加(P<0.01),而细胞增殖指数[PI={(S+G2/M)÷(G0/G1+S+G2/M)}×100%]降低(图 2B)。干预后,Siha细胞的增殖指数较C33A细胞高,而凋亡率则低(图 2C)。
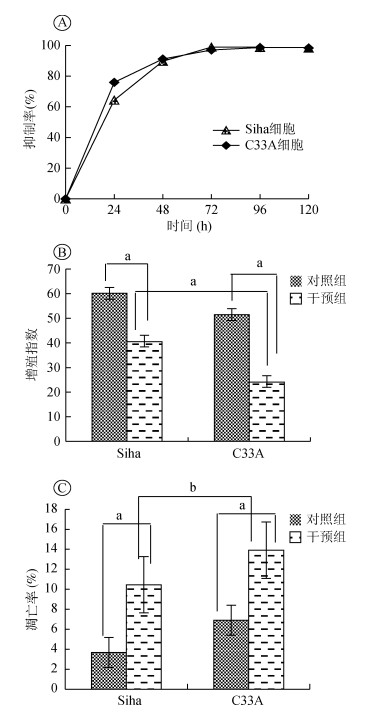
|
| 注:A:U0126干预对Siha和C33A细胞的抑制作用;B:U0126干预对Siha和C33A细胞增殖的影响;C:U0126干预对Siha和C33A细胞凋亡的影响;aP<0.01,bP>0.05 图 2 U0126干预对子宫颈癌细胞增殖、细胞周期和凋亡的影响 |
ERK发现于20世纪80年代末,属于丝氨酸/苏氨酸激酶类信号蛋白,可将细胞外各种刺激信号传递到细胞内,并引发一系列生物反应,其持续活化最终促进细胞的增殖和恶性转化。ERK可被多种癌基因产物激活发生磷酸化,形成的p-ERK是ERK信号通路被激活的标志。有研究表明,ERK的异常活化与子宫颈内瘤变有关。Chen等[12]研究显示,从CN组、子宫颈癌前病变组到子宫颈癌组,p-ERK1/2的表达水平逐渐增高。章丽霞等[13]的研究也表明,随着子宫颈病变的加重,ERK2和p-ERK1/2在各子宫颈病变组中的表达率逐渐升高,同时发现ERK2和p-ERK1/2在子宫颈癌不同临床分期、病理分级以及淋巴转移者中的表达有差异,提示ERK2和p-ERK1/2与子宫颈癌变的发生、发展和预后密切相关。
本研究结果显示,随着子宫颈病变的加重,p-ERK1/2蛋白的表达量呈逐渐升高的趋势,特别是在CIN组p-ERK1/2的蛋白表达水平明显高于NC组,提示p-ERK1/2高表达可增加子宫颈癌及癌前病变的危险,p-ERK1/2的异常表达可作为子宫颈癌变发生的早期预警标志。同时,本研究结果表明,对子宫颈癌细胞进行ERK抑制后,抑制了细胞的增殖、促进了细胞的凋亡、提高了细胞在G0/G1期的比例、降低了G2/M期比例,不仅验证了子宫颈癌的发生与ERK的活化密切关联的理论,而且揭示ERK对子宫颈癌细胞具有促进增殖、抑制凋亡和致细胞周期紊乱的作用、进而促进了子宫颈癌的发生。
大量证据表明,高危型HPV持续感染是子宫颈癌及其癌前病变最主要的病因,而HPV16在子宫颈癌患者中检出率达50%以上,是至今在全球范围内最常见的致癌型别[14],HPV16 E6、E7癌蛋白是HPV DNA与宿主DNA整合后发生致癌作用的主要元凶。有研究用E6转染不同子宫颈癌细胞株发现,转染后的子宫颈癌细胞株中MAPK信号通路活性增强,提示E6癌蛋白与ERK信号通路密切相关[7]。Yuan等[8]发现,E7癌蛋白可通过MEK-ERK和AP-1信号转导通路来调节钙粘蛋白的表达,而在调节钙粘蛋白介导的细胞连接的过程中,该信号通路的活性也增强。
本研究发现,随着子宫颈病变程度的加重,HPV16的感染率逐渐升高,且HPV16感染和p-ERK1/2蛋白表达在子宫颈癌变中存在正相加交互效应。交互作用定量分析的结果进一步揭示,与正常子宫颈组相比,HPV16感染和p-ERK1/2蛋白高表达的交互作用导致CINⅠ、CINⅡ/ Ⅲ和SCC的危险性是其他因子所致危险性的2.40、8.36和35.82倍,分别占CINⅠ、CINⅡ/Ⅲ和SCC发病风险的36%、52%和69%;同时由交互作用分析S值可知,两因素同时存在所致CINⅠ、CINⅡ/Ⅲ和SCC发生的危险性是其各自单独存在所致危险性之和的1.73、2.26和3.36倍。提示随着子宫颈病变的加重,这种交互作用可能有逐渐增强的趋势。同时,在本研究中发现,抑制ERK后,HPV16阳性的Siha细胞增殖指数高于HPV阴性的C33A细胞,而凋亡率则低于C33A细胞。结合本组前期研究[15],ERK抑制后,HPV阳性的Hela细胞的p-ERK1/2蛋白表达水平高于HPV阴性的C33A细胞,提示HPV感染可能有增加ERK1/2蛋白活化的作用。这一发现对于临床制定个体化治疗方案具有指导意义,为深入研究HPV感染激活生物信号通路,寻找有效生物治疗靶点开拓了新思路。
本研究选择了不同子宫颈病变阶段的女性为研究对象,从群体角度揭示了从NC、CINⅠ、CINⅡ/Ⅲ到SCC发展过程中ERK表达和HPV16感染的变化特点和相互作用规律,但未从前瞻性观察的角度揭示这一过程。此外,本研究对象均来自医院,可能存在一定的选择偏倚。为了进一步验证ERK表达和HPV16感染对宫颈癌变发生与进展的作用,尚需进行前瞻性队列研究,以提供更为可靠的证据。
利益冲突: 无
| [1] | Haedicke J, Iftner T. Human papillomaviruses and cancer[J]. Radiother Oncol , 2013, 108(3) : 397–402. DOI:10.1016/j.radonc.2013.06.004 |
| [2] | Hovland S, Muller S, Skomedal H, et al. E6/E7 mRNA expression analysis:a test for the objective assessment of cervical adenocarcinoma in clinical prognostic procedure[J]. Int J Oncol , 2010, 36(6) : 1533–1539. DOI:10.3892/ijo_00000640 |
| [3] | Arbyn M, Castellsagué X, de Sanjosé S, et al. Worldwide burden of cervical cancer in 2008[J]. Ann Oncol , 2011, 22(12) : 2675–2686. DOI:10.1093/annonc/mdr015 |
| [4] | Shukla S, Mahata S, Shishodia G, et al. Functional regulatory role of STAT3 in HPV16-mediated cervical carcinogenesis[J]. PLoS One , 2013, 8(7) : e67849. DOI:10.1371/journal.pone.0067849 |
| [5] | Yang HP, Zuna RE, Schiffman M, et al. Clinical and pathological heterogeneity of cervical intraepithelial neoplasia grade 3[J]. PLoS One , 2012, 7(1) : e29051. DOI:10.1371/journal.pone.0029051 |
| [6] | Eblen ST, Slack JK, Weber MJ, et al. Rac-PAK signaling stimulates extracellular signal-regulated kinase (ERK) activation by regulating formation of MEK1-ERK complexes[J]. Mol Cell Biol , 2002, 22(17) : 6023–6033. DOI:10.1128/MCB.22.17.6023-6033.2002 |
| [7] | Chakrabarti O, Veeraraghavalu K, Tergaonkar V, et al. Human papillomavirus type 16 E6 amino acid 83 variants enhance E6-mediated MAPK signaling and differentially regulate tumorigenesis by notch signaling and oncogenic Ras[J]. J Virol , 2004, 78(11) : 5934–5945. DOI:10.1128/JVI.78.11.5934-5945.2004 |
| [8] | Yuan H, Ito S, Senga T, et al. Human papillomavirus type 16 oncoprotein E7 suppresses cadherin-mediated cell adhesion via ERK and AP-1 signaling[J]. Int J Oncol , 2009, 35(2) : 309–314. DOI:10.3892/ijo_00000341 |
| [9] |
苏明, 程浩, 盛彩霞, 等.
尖锐湿疣患者角质形成细胞中活化型细胞外信号调控蛋白激酶和活化型p38的检测[J]. 中华皮肤科杂志 , 2004, 37(10) : 567–571.
Su M, Cheng H, Sheng CX, et al. Expression of Activated ERK and p38 Kinase in HPV-Infected Keratinocytes[J]. Chin J Dermatol , 2004, 37(10) : 567–571. DOI:10.3760/j.issn.0412-4030.2004.10.003 |
| [10] | Crusius K, Rodriguez I, Alonso A. The human papillomavirus type 16 E5 protein modulates ERK1/2 and p38 MAP kinase activation by an EGFR-independent process in stressed human keratinocytes[J]. Virus Genes , 2000, 20(1) : 65–69. DOI:10.1023/A:1008112207824 |
| [11] |
王金桃, 高尔生, 程玉英, 等.
内源性雌、孕激素与人乳头瘤病毒在宫颈癌发生中的协同作用研究[J]. 中华流行病学杂志 , 2005, 26(5) : 370–373.
Wang JT, Gao ES, Cheng YY, et al. Analysis on synergistic action between estrogen, progesterone and human papillomaviruses in cervical cancer[J]. Chin J Epidemiol , 2005, 26(5) : 370–373. DOI:10.3760/j.issn.0254-6450.2005.05.017 |
| [12] | Chen TP, Chen CM, Chang HW, et al. Increased expression of SKP2 and phosphor-MAPK/ERK1/2 and decreased expression of p27 during tumor progression of cervical neoplasms[J]. Gynecol Oncol , 2007, 104(3) : 516–523. DOI:10.1016/j.ygyno.2006.09.015 |
| [13] |
章丽霞, 刘钧, 黄一凡, 等.
ERK2和p-ERK1/2蛋白在宫颈癌中的表达和意义[J]. 现代肿瘤医学 , 2012, 20(2) : 353–356.
Zhang LX, Liu J, Huang YF, et al. Expression and significance of ERK2 and p-ERK1/2 in cervical carcinoma[J]. J Mod Oncol , 2012, 20(2) : 353–356. DOI:10.3969/j.issn.1672-4992.2012.02.43 |
| [14] | Guan P, Howell-Jones R, Li N, et al. Human papillomavirus types in 115789 HPV-positive women:a meta-analysis from cervical infection to cancer[J]. Int J Cancer , 2012, 131(10) : 2349–2359. DOI:10.1002/ijc.27485 |
| [15] | Bai LX, Mao R, Wang JT, et al. ERK1/2 promoted proliferation and inhibited apoptosis of human cervical cancer cells and regulated the expression of c-Fos and c-Jun proteins[J]. Med Oncol , 2015, 32(3) : 57. DOI:10.1007/s12032-015-0490-5 |
 2017, Vol. 38
2017, Vol. 38