文章信息
- 兰丰铃, 李嘉琛, 余灿清, 郭彧, 卞铮, 谭云龙, 裴培, 陈君石, 陈铮鸣, 曹卫华, 吕筠, 李立明 .
- Lan Fengling, Li Jiachen, Yu Canqing, Guo Yu, Bian Zheng, Tan Yunlong, Pei Pei, Chen Junshi, Chen Zhengming, Cao Weihua, Lyu Jun, Li Liming .
- 中国成年人气流受限与慢性病主要死亡风险的前瞻性研究
- Associations between airflow obstruction and total and cause-specific mortality in adults in China
- 中华流行病学杂志, 2017, 38(1): 13-19
- Chinese journal of Epidemiology, 2017, 38(1): 13-19
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2017.01.003
-
文章历史
收稿日期: 2016-07-20
2. 100730 北京, 中国医学科学院;
3. 100022 北京, 国家食品安全风险评估中心;
4. OX12JD 牛津大学临床试验中心和流行病研究中心/纳菲尔德人群健康部
2. Chinese Academy of Medical Sciences, Beijing 100730, China;
3. China National Center for Food Safety Risk Assessment, Beijing 100022, China;
4. Clinical Trial Service Unit and Epidemiological Studies Unit, Nuffield Department of Population Health, University of Oxford, Oxford OX12JD, UK
气流受限常用于衡量肺功能好坏,同时是诊断COPD和评价严重程度的主要指标。当前,全球>40岁人群中COPD患病率为9%~10%[1],国内≥40岁人群的患病率为8.2%[2]。在过去几十年,已经有多项研究发现了气流受限与慢性病全死因死亡、心血管疾病、呼吸系统疾病、恶性肿瘤死亡有关联[3-4]。本研究利用中国慢性病前瞻性研究(China Kadoorie Biobank,CKB)的随访数据,探讨气流受限与慢性病死亡风险之间的关系。
对象与方法1.研究对象:CKB项目是一项覆盖中国10个地区、募集有50余万人的前瞻性队列研究。项目于2004-2008年完成队列成员的募集,个体完成基线调查后随即开始对其进行发病与死亡结局的长期随访。最终CKB项目共招募512 891例合格的调查对象并完成基线调查,包括有完整的问卷调查数据、体格测量数据。项目具体信息参见文献[5-7]。在有完整基线调查数据的对象中,本研究剔除了肺功能指标第一秒用力呼气容积(Forced Expiratory Volume in one second,FEV1)/用力肺活量(Forced Vital Capacity,FVC)>1者(n=396)、基线患有心脏病(n=15 472)、脑卒中(n=8 884)和恶性肿瘤(n=2 577)者、主要分析变量缺失者(n=2)以及基线调查完成后即失访者(n=3)。最终有486 994例纳入分析。
2.研究内容:
(1)气流受限的测量与分类标准:本研究使用的手握微型电子肺功能仪精度较高(±3%)。考虑到样本量较大且近半数研究对象在农村,为了方便调查,经过培训的调查员使用手握微型电子肺功能仪测定研究对象的FEV1和FVC(单位L)。在调查前研究对象接受吹气培训和试吹,最终测定2次,取最大值进行分析[8],研究对象均未使用支气管扩张剂。用COPD全球倡议(GOLD)标准判断气流受限情况。GOLD标准:①正常:FEV1/FVC≥70%;②气流受限:FEV1/FVC<70%。气流受限组分为4级:GOLD-1:FEV1≥80%的预计值;GOLD-2:50%的预计值≤FEV1<80%的预计值;GOLD-3:30%的预计值≤FEV1<50%的预计值;GOLD-4:FEV1<30%的预计值。预计值根据全球肺功能行动(global lung function initiative,GLI)2012年提出的公式计算而得;该公式整合了地区、年龄、性别、身高、种族等信息[9]。根据中国地理南北方分界线(即秦岭-淮河线)将哈尔滨、青岛、甘肃和河南人群归于东北亚人群,其他地区归于东南亚人群。
(2)协变量评价:①一般情况:省(市)、年龄、性别、受教育程度、职业;②吸烟情况:根据戒烟时间和每日吸烟量分为13组[10];③累计吸烟量:吸烟量(包/年)=累计吸烟年限×[每日吸烟量(支)/20];④饮酒情况:根据既往饮酒分为6组[11];⑤膳食摄入频率:包括肉类、蔬菜、水果、频率分为5组;⑥体力活动:根据工作、交通出行、休闲和家务活动得到每天体力活动的水平(MET-h/d)[12];⑦呼吸系统症状:平地行走时感到气短、胸部不适而减速或停止行走;最近一年白天或晚上经常咳嗽;最近一年每天醒后经常咳出痰液;每个症状有则赋值为1,无则赋值为0,计算呼吸系统症状数量,最大为4,最小为0;⑧疾病史:高血压、糖尿病、肺结核、慢性支气管炎/肺气肿/肺心病、哮喘;⑨家族史:急性心肌梗死、中风、恶性肿瘤,若一级亲属有人患上述疾病则认为有家族史;⑩被动吸烟:根据与吸烟者同居情况和累计年限、每周暴露于烟雾的天数和累计时长分为未暴露、与吸烟者居住<20年、与吸烟者居住≥20年且每周暴露时间<20 h、与吸烟者同居时间≥20年且每周暴露时间≥20 h;现居所室内空气污染:做饭等装置是否有排烟设备、做饭污染(无厨房或不做饭,偶尔使用天然气/电、煤/柴炭、其他燃料、每天使用天然气/电、煤/柴炭、其他燃料);取暖污染:不取暖,或使用清洁燃料、煤/柴炭、其他燃料;BMI:体重和身高统一测量,BMI=体重/身高2(kg/m2)。
(3)死亡结局确定:通过中国疾病监测点系统和户籍系统获取研究对象的死亡信息。每年开展定向监测,即比对户籍系统常住居民搬迁记录、访问社区或直接联系研究对象,以减少死亡漏报并确定永久迁出的研究对象。死因信息主要是通过居民死亡证明书获得,同时辅以研究对象既往的医院病案记录或入户调查进行死因推测。死因分类采用国际疾病分类(International Classification of Diseases,ICD)第10版,即ICD-10。主要终点包括全死因死亡和5类死因别死亡,即COPD(J41~J44)、缺血性心脏病(I20~I25)、脑血管病(I60~I69)、恶性肿瘤(C00~C97)及其他。
3.统计学分析:数据分析使用Stata 13.0软件,所有检验为双侧检验,P<0.05为差异有统计学意义。比较不同气流受限分组研究对象的基线特征,连续型变量采用协方差分析,分类变量采用二元logistic回归或多元logistic回归模型,报告调整年龄及地区后的均数或构成比。随访人年的计算从个体完成基线调查的日期开始,到死亡日期、失访日期或2013年12月31日为止。经Schoenfeld残差图法检验,本研究数据基本符合Cox比例风险假设,因此使用Cox比例风险回归模型分析气流受限与死亡之间的关联,计算HR值及其95%CI。模型以年龄作为时间尺度,并按年龄(5岁1组)和项目地(10个省市)分层。多变量模型对已知或可能影响死亡风险的因素进行分步调整。在检验气流受限与死亡关联的线性趋势时,将气流受限等级按连续型变量纳入方程。为了检验结果的稳定性,进行以下敏感性分析:剔除随访最初两年死亡的个体;剔除基线患有呼吸系统疾病(哮喘、肺结核、慢性支气管炎/肺气肿/肺心病)的个体。
结果1.基线特征:截至2013年12月31日,平均随访7.2年,累计随访3 494 079人年。在随访期间,21 649人死亡。气流正常、气流受限GOLD-1~GOLD-4等级的全人群粗死亡率(/1 000人年)分别为5.5、9.9、13.1、32.4和63.3。在调整年龄和项目地区后,与气流正常的研究对象相比,气流受限程度越高、农村人口比例越大、年长者越多、累计吸烟量越高、体力活动水平越低、BMI水平越低的研究对象患有呼吸系统疾病以及至少有一个呼吸系统症状的比例越高,见表 1。
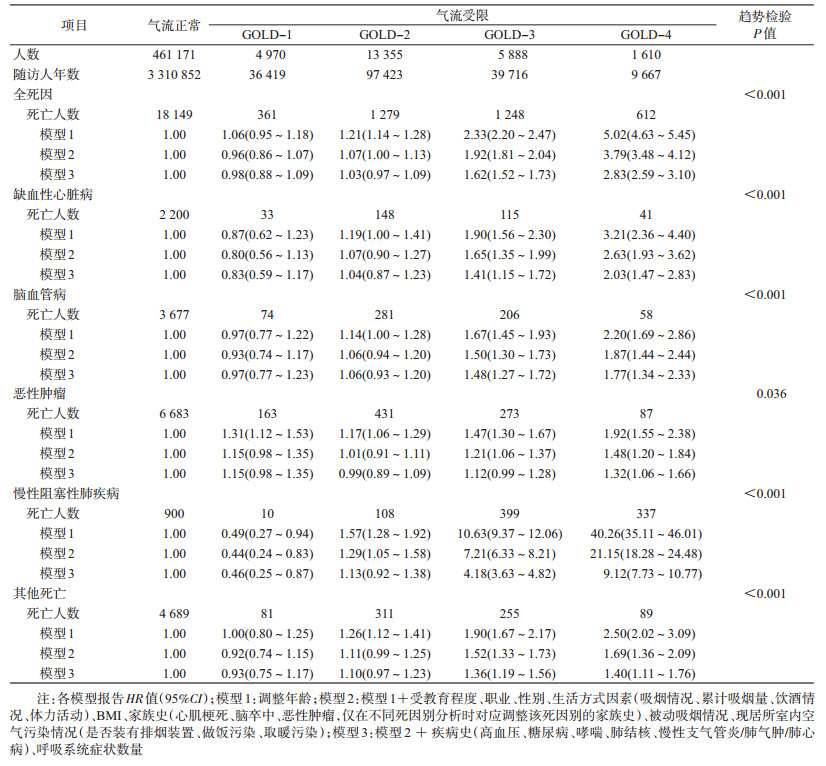
2.气流受限与死亡之间的关系:在调整可能的混杂因素后,气流受限与全死因死亡风险关联差异有统计学意义。全人群中,在多因素调整后,与气流正常的人群相比,随着气流受限严重程度的增加,个体的死亡风险逐渐升高(趋势检验P<0.001),GOLD-1~GOLD-4的HR值(95%CI)依次为0.98(0.88~1.09)、1.03(0.97~1.09)、1.62(1.53~1.73)和2.83(2.59~3.10),见表 2。
男性GOLD-1~GOLD-4的HR值(95%CI)分别为0.94(0.82~1.07)、1.01(0.94~1.09)、1.55(1.43~1.67)和2.79(2.50~3.11);女性GOLD-1~GOLD-4的HR值(95%CI)分别为1.05(0.88~1.26)、1.05(0.95~1.15)、1.78(1.60~1.98)和2.80(2.38~3.29)。上述关联差异有统计学意义(交互作用P<0.001)。见表 3。
与全死因相似,随着气流受限等级升高,缺血性心脏病、脑血管病和COPD死亡风险升高。男性和女性的恶性肿瘤死亡风险中未见有统计学意义的线性增加趋势(趋势检验P值分别为0.130和0.505)。气流受限与各死因别死亡之间的关联在男女间均无统计学意义(交互作用P>0.05)。
3.敏感性分析:剔除随访最初两年死亡或剔除基线患有呼吸系统疾病的个体后,气流受限与全死因死亡风险的HR值并未发生明显变化,在各死因别中,GOLD-3和GOLD-4等级下的死亡风险值略有改变,但死亡风险值仍有统计学意义(结果未显示)。
讨论本研究利用大规模的中国人群前瞻性队列数据分析了气流受限与死亡风险间的关联。结果显示,控制可能的混杂因素后,患有气流受限或气流受限程度越严重,个体发生死亡及因缺血性心脏病、脑血管病和COPD死亡的风险越高。这种关联在男性和女性中均存在。
本研究的结果与欧美国家开展的研究结果一致。一项在挪威开展的样本量为10 491例(≥19岁)的队列研究在随访12~14年后显示,气流受限等级为GOLD-3合并GOLD-4的男性和女性全死因HR值(95%CI)分别为3.88(2.60~5.79)和6.85(4.46~10.52),心血管疾病死亡的HR值(95%CI)分别为3.86(1.51~9.89)和2.21(1.14~4.29)[3]。美国肺部健康研究针对5 320例≥35岁的研究对象随访10年后显示,与正常人群相比,GOLD-3合并GOLD-4人群的全死因死亡HR值(95%CI)为2.68(1.51~4.75)[13]。美国社区动脉粥样硬化风险研究在随访15 440例43~66岁的人群后发现与正常人群相比,GOLD-3合并GOLD-4人群的全死因死亡HR值(95%CI)为4.5(3.5~5.8)[14]。美国国家和健康营养调查第1次在随访5 542例25~74岁研究对象17~21年后发现,GOLD-4人群的HR值(95%CI)为2.7(2.1~3.5)[15]。本研究显示,慢性病气流受限与死亡关联的效应值略低于国外研究,提示气流受限的影响可能存在人种差异。另外,本研究使用的是吸入支气管扩张剂前的肺功能指标,会将部分健康人群判断为气流受限患者,有可能导致效应值被低估。
气流受限与慢性病死亡的生理病理机制还在探索中,目前认为炎症是主要病因之一。近几年研究已证实,炎症会增加发生动脉粥样硬化的风险,并累及心血管疾病[16]。其中纤维蛋白原和C反应蛋白是预示心血管疾病发生的重要炎症标记物,近来有研究显示下降的肺功能与上述标记物相关[17]。此外,美国的第3次全国健康与营养检查调查研究发现,低级别系统炎症同时与中度或重度的气流受限(GOLD-3~GOLD-4)、心血管疾病的发生风险有关联,这或许能部分解释肺功能差的人发生心血管疾病的概率高[18]。此外,炎症被认为是导致肺组织损伤、小气道狭窄的原因之一,肺部和气道炎症在肺癌的发病机制中起着重要的作用[19]。
本研究发现,女性慢性病因气流受限而导致的全死因死亡风险比略高于男性,其他研究也发现类似现象[4, 20]。已有队列研究发现,健康女性的肺功能峰值可以持续到40岁,而男性肺功能在23岁后就呈下降趋势。同时,女性的肺功能每年的下降率也低于男性[21]。因此,若女性患有气流受限则说明其肺功能或机体可能遭受更大的损伤,增大了发病或死亡的风险。
本研究是前瞻性研究,样本量大,控制了已知和可能的混杂因素。研究对象在基线时患有的基础疾病会增加个体的死亡风险,而基础疾病也可能会导致个体的肺功能下降,从而影响气流受限与死亡风险间的关联。本研究剔除了基线时患有心脏病、脑卒中和恶性肿瘤的个体,一定程度上控制了这种情况可能带来的偏倚。另外,研究对象的气流受限情况非自报,是通过器械检查、根据全球公认的判定标准确定。
本研究存在局限性。①本研究使用的是吸入支气管扩张剂前的肺功能指标,会将部分健康人群判断为气流受限患者[22];可能低估气流受限与死亡风险间的关联。不过,有研究发现,不论是否吸入支气管扩张剂,都可以观察到根据GOLD标准判断的气流受限与死亡风险间的关联,且二者的HR值差异不大[13];②本研究根据基线调查一次性测量的肺功能水平确定研究对象的气流受限情况,未考虑长期随访过程中肺功能可能发生的变化;③虽然本研究已经调整了一些已知和可能的混杂因素,但仍然存在其他未测量或未知的生物学和社会学因素导致的混杂作用。比如室外空气污染,已有研究发现其与肺功能下降[23]和死亡[24-25]都相关。
综上所述,本研究发现,慢性病患者有气流受限或是随着气流受限严重程度的增加,全死因死亡风险及因缺血性心脏病、脑血管病、恶性肿瘤和COPD导致的死亡风险均增加,因而通过肺功能检查提早发现气流受限人群并施以适当的措施,具有重要的公共卫生学意义。在今后的研究中还可以通过测量最大呼气流量-容积曲线多个角度判断研究对象的气流受限情况,继而探讨其与疾病结局的关联。
志谢: 感谢所有参加CKB项目的队列成员和各项目地的现场调查员,项目管理委员会、国家项目办公室、牛津协作中心和10个项目地办公室的工作人员利益冲突: 无
| [1] | Halbert RJ, Natoli JL, Gano A, et al. Global burden of COPD:systematic review and meta-analysis[J]. Eur Respir J , 2006, 28(3) : 523–532. DOI:10.1183/09031936.06.00124605 |
| [2] | Zhong NS, Wang C, Yao WZ, et al. Prevalence of chronic obstructive pulmonary disease in China:a large, population-based survey[J]. Am J Respir Crit Care Med , 2007, 176(8) : 753–760. DOI:10.1164/rccm.200612-1749OC |
| [3] | Leivseth L, Nilsen TI, Mai XM, et al. Lung function and respiratory symptoms in association with mortality:The HUNT Study[J]. COPD , 2014, 11(1) : 59–80. DOI:10.3109/15412555 |
| [4] | Mannino DM, Reichert MM, Davis KJ. Lung function decline and outcomes in an adult population[J]. Am J Respir Crit Care Med , 2006, 173(9) : 985–990. DOI:10.1164/rccm.200508-1344OC |
| [5] |
李立明, 吕筠, 郭彧, 等.
中国慢性病前瞻性研究:研究方法和调查对象的基线特征[J]. 中华流行病学杂志 , 2012, 33(3) : 249–255.
Li LM, Lyu J, Guo Y, et al. The China Kadoorie Biobank:related methodology and baseline characteristics of the participants[J]. Chin J Epidemiol , 2012, 33(3) : 249–255. DOI:10.3760/cma.j.issn.0254-6450.2012.03.001 |
| [6] | Chen ZM, Chen JS, Collins R, et al. China Kadoorie Biobank of 0.5 million people:survey methods, baseline characteristics and long-term follow-up[J]. Int J Epidemiol , 2011, 40(6) : 1652–1666. DOI:10.1093/ije/dyr120 |
| [7] | Chen ZM, Lee LM, Chen JS, et al. Cohort profile:The Kadoorie Study of Chronic Disease in China (KSCDC)[J]. Int J Epidemiol , 2005, 34(6) : 1243–1249. DOI:10.1093/ije/dyi174 |
| [8] | Smith M, Li LM, Augustyn M, et al. Prevalence and correlates of airflow obstruction in 317000 never-smokers in China[J]. Eur Respir J , 2014, 44(1) : 66–77. DOI:10.1183/09031936.00152413 |
| [9] | Quanjer PH, Stanojevic S, Cole TJ, et al. Multi-ethnic reference values for spirometry for the 3-95-yr age range:the global lung function 2012 equations[J]. Eur Respir J , 2012, 40(6) : 1324–1343. DOI:10.1183/09031936.00080312 |
| [10] |
王昕, 吕筠, 郭彧, 等.
中国慢性病前瞻性研究:10个项目地区成年人群吸烟行为特征差异分析[J]. 中华流行病学杂志 , 2015, 36(11) : 1200–1204.
Wang X, Lyu J, Guo Y, et al. Regional differences in patterns of smoking:findings from China Kadoorie Biobank study in 10 areas in China[J]. Chin J Epidemiol , 2015, 36(11) : 1200–1204. DOI:10.3760/cma.j.issn.0254-6450.2015.11.004 |
| [11] |
吕筠, 郭彧, 卞铮, 等.
中国慢性病前瞻性研究:10个项目地区人群饮酒行为特征差异的分析[J]. 中华流行病学杂志 , 2014, 35(8) : 875–881.
Lyu J, Guo Y, Bian Z, et al. Regional differences in patterns of alcohol consumption:findings from the China Kadoorie Biobank study on half a million people from 10 regions[J]. Chin J Epidemiol , 2014, 35(8) : 875–881. DOI:10.3760/cma.j.issn.0254-6450.2014.08.001 |
| [12] |
樊萌语, 吕筠, 郭彧, 等.
中国慢性病前瞻性研究:10个项目地区成人体力活动和休闲静坐时间特征差异的分析[J]. 中华流行病学杂志 , 2015, 36(8) : 779–785.
Fan MY, Lyu J, Guo Y, et al. Regional differences on patterns of physical activity and leisure sedentary time:findings from the China Kadoorie Biobank study, including a million people from 10 regions[J]. Chin J Epidemiol , 2015, 36(8) : 779–785. DOI:10.3760/cma.j.issn.0254-6450.2015.08.002 |
| [13] | Mannino DM, Diaz-Guzman E, Buist S. Pre-and post-bronchodilator lung function as predictors of mortality in the Lung Health Study[J]. Respir Res , 2011, 12 : 136. DOI:10.1186/1465-9921-12-136 |
| [14] | Mannino DM, Doherty DE, Sonia BA. Global Initiative on Obstructive Lung Disease (GOLD) classification of lung disease and mortality:findings from the Atherosclerosis Risk in Communities (ARIC) study[J]. Respir Med , 2006, 100(1) : 115–122. DOI:10.1016/j.rmed.2005.03.035 |
| [15] | Mannino DM, Buist AS, Petty TL, et al. Lung function and mortality in the United States:data from the First National Health and Nutrition Examination Survey follow up study[J]. Thorax , 2003, 58(5) : 388–393. DOI:10.1136/thorax.58.5.388 |
| [16] | Danesh J, Whincup P, Walker M, et al. Low grade inflammation and coronary heart disease:prospective study and updated meta-analyses[J]. BMJ , 2000, 321(7255) : 199–204. DOI:10.1136/bmj.321.7255.199 |
| [17] | Ahmadi-Abhari S, Kaptoge S, Luben RN, et al. Longitudinal association of C-reactive protein and lung function over 13 years:The EPIC-Norfolk study[J]. Am J Epidemiol , 2014, 179(1) : 48–56. DOI:10.1093/aje/kwt208 |
| [18] | Sin DD, Man SF. Why are patients with chronic obstructive pulmonary disease at increased risk of cardiovascular diseases? The potential role of systemic inflammation in chronic obstructive pulmonary disease[J]. Circulation , 2003, 107(11) : 1514–1519. DOI:10.1161/01.CIR.0000056767.69054.B3 |
| [19] | Wasswa-Kintu S, Gan WQ, Man SF, et al. Relationship between reduced forced expiratory volume in one second and the risk of lung cancer:a systematic review and meta-analysis[J]. Thorax , 2005, 60(7) : 570–575. DOI:10.1136/thx.2004.037135 |
| [20] | Ryan G, Knuiman MW, Divitini ML, et al. Decline in lung function and mortality:the Busselton Health Study[J]. J Epidemiol Community Health , 1999, 53(4) : 230–234. DOI:10.1136/jech.53.4.230 |
| [21] | Kohansal R, Martinez-Camblor P, Agustí A, et al. The natural history of chronic airflow obstruction revisited:an analysis of the Framingham offspring cohort[J]. Am J Respir Crit Care Med , 2009, 180(1) : 3–10. DOI:10.1164/rccm.200901-0047OC |
| [22] | Párez-Padilla R, Hallal PC, Vázquez-García JC, et al. Impact of bronchodilator use on the prevalence of COPD in population-based samples[J]. COPD , 2007, 4(2) : 113–120. DOI:10.1080/15412550701341012 |
| [23] | Schikowski T, Sugiri D, Ranft U, et al. Long-term air pollution exposure and living close to busy roads are associated with COPD in women[J]. Respir Res , 2005, 6 : 152. DOI:10.1186/1465-9921-6-152 |
| [24] |
刘昌景, 黄飞, 杨志洲, 等.
我国空气污染物与人群呼吸系统疾病死亡急性效应的Meta分析[J]. 中华流行病学杂志 , 2015, 36(8) : 889–895.
Liu CJ, Huang F, Yang ZZ, et al. A Meta analysis on the associations between air pollution and respiratory mortality in China[J]. Chin J Epidemiol , 2015, 36(8) : 889–895. DOI:10.3760/cma.j.issn.0254-6450.2015.08.026 |
| [25] | Lelieveld J, Evans JS, Fnais M, et al. The contribution of outdoor air pollution sources to premature mortality on a global scale[J]. Nature , 2015, 525(7569) : 367–371. DOI:10.1038/nature15371 |
 2017, Vol. 38
2017, Vol. 38